摘要:
目的:探讨胞壁酰二肽(MDP)对儿童急性白血病骨髓树突状细胞(DC)功能的影响。方法:应用Ficoll-Hypaque法分离急性白血病患儿骨髓单个核细胞,对照组:用细胞因子诱导培养DC;实验组实验组分为5个亚组,1组:与对照组等量的MNC+ MDP (10 ug/l),2~5组分别对应为:与对照组等量的MNC + 与对照组等量的细胞因子 + 不同浓度的MDP (10
2 ug/l,10
2 ug/l,10
3 ug/l,10
4 ug/l);分别诱导培养DC,第9天收获各组DC,与同种异体外周血T淋巴细胞混合反应96 h,观察淋巴细胞的增殖情况,ELISA方法检测上清液中IL-12、IFN-γ的含量;经HL-60抗原致敏后的DC与T淋巴细胞混合培养6 d后,加入HL-60细胞共同孵育12 h,LDH释放改良法检测各组细胞毒T淋巴细胞(CTL)的杀伤活性。结果:1) 混合淋巴细胞反应显示:① T细胞扩增指数:固定刺激细胞数,不同组比较,对照组与1组、2组比较均无显著性差异(p均 > 0.05);3组、4组、5组T细胞扩增指数明显高于对照组,亦明显高于1组(p均 < 0.01)。当刺激细胞数量为1 × 10
3至1 × 10
4,同组间T细胞扩增指数逐渐增加(p均 < 0.01),1 × 10
4与5 × 10
4之间T细胞扩增指数的增加无统计学意义(p > 0.05)。② T细胞分泌细胞因子:当刺激细胞数为5 × 10
4时,对照组与1组、2组IL-12含量的比较均无显著性差异(p > 0.05);3组、4组、5组明显高于对照组,亦明显高于1组(p均 < 0.01)。对照组与1组、2组IFN-γ含量的比较均无显著性差异(p > 0.05);3组、4组、5组明显高于对照组,亦明显高于1组(p均 < 0.01)。2) 杀瘤活性结果显示:实验各组杀伤HL-60细胞活性均较对照组显著增强(p均 < 0.01);当MDP浓度由10
2 ug/l递增至10
4 ug/l,2组、3组、4组、5组组间比较,杀伤活性逐渐增加(p均 < 0.01),以5组杀伤HL-60细胞活性最强。结论:① 当MDP诱导后的DC数量 ≥ 1 × 10
3时,即能促进T细胞的增殖,且有MDP浓度依赖性。② 经MDP诱导后的DC具有促进T细胞分泌的作用,与细胞因子联合作用更强。③ MDP能从儿童急性白血病骨髓中诱导出有较强的抗原刺激能力的DC,且有MDP浓度依赖性。
Abstract:
Objective: To investigate the effect of Muramyl Dipeptide (MDP) on the function of dendritic cells (DC) derived from bone marrow in children with acute leukemia. Methods: The mononuclear cells were isolated from bone marrow in children with acute leukemia by the method of Ficoll-Hypaque and cultured with cytokines in the control group. The test groups contained five subgroups: used MDP (102 ug/l) alone (Group 1), cytokines combined with MDP of different concentration, which was put in 3rd day (Group 2, 10 ug/l; Group 3, 102 ug/l; Group 4, 103 ug/l; Group 5, 104 ug/l). The DCs were collected in the 9th day. The DCs of different groups were mixed with allogeneic peripheral blood T cells for 96 hours, the numbers of T cells in different groups were counted and the contents of interleukin (IL)-12, interferon-γ (IFN-γ) were tested by enzyme-linked immunosorbent assay (ELISA). The DCs of different groups and T cells (cultured with rhIL-2 + 10%FCS of RPMI1640 for 6 days) and HL-60 cells were cultured for 12 hours, cytotoxicity assay were measured by LDH release. Results: 1) Mixed lymphocyte reaction ① The stimulation index of T cell: When the number of stimulation cells was fixed, the proliferation of allogeneic lymphocytes could be strongly stimulated. There was no difference among the control group, group 1 and group 2; but the group3, group 4 and group 5 were higher than the control group and group 1 (p < 0.01). With the increasing of the number of stimulation cells from 1 × 103 to 1 × 104, the stimulation index of T cells was rising, and the group3, group 4 and group 5 were significantly higher than the control group and group 1, but there was no difference among the control group, group 1 and group 2. ② The contains of IL-12, IFN-γ: When the number of stimulation cells was 5 × 104, there was no difference among the contains of IL-12 of the control group, group 1 and group 2; the group 3, group 4 and group 5 were higher than the control group and group 1 (p < 0.01). There was no difference among the contains of IFN-γ of the control group, group 1 and group 2; the group 3, group 4 and group 5 were higher than the control group and group 1 (p < 0.01). 2) Cytotoxicity assay showed that killing activity on HL-60 cells of T cells in test groups was higher than that of the control group, and in test groups, with the increasing of the concentration of MDP from 102 ug/l to 104 ug/l, the killing activity on HL-60 cells was dramatically enhanced (p < 0.01), among which the killing activity of the group 5 was the strongest. Conclusion: ① The proliferation of T cells could be promoted when the number of DCs induced with MDP is ≥ 1 × 103, and its function has MDP concentration dependence. ② The DCs induced with MDP could promote T cells secretion, and has no difference between cytokines, but the combined application effect is more obvious. ③ MDP could induce functional DCs to be generated from bone marrow in children with acute leukemia, and its function has MDP concentration dependence.
1. 引言
免疫细胞治疗是继化疗、骨髓移植(bone marrow transplantation, BMT)后治疗白血病的一种新方法,在治疗白血病及清除微小残留病(minimal residual disease, MRD)中被寄予很大希望。树突状细胞(dendritic cell, DC)是目前所知抗原提呈能力最强的抗原提呈细胞(antigen presenting cells, APC),在肿瘤细胞和 T淋巴细胞的相互作用中起桥梁和枢纽作用。大量的动物实验证明,DC可以诱导机体特异性免疫反应的发生,使机体得以抵御肿瘤的入侵或消灭机体现存的肿瘤 [1] [2]。胞壁酰二肽(N-乙酰胞壁酰-L-Ala-D-isoGln,即壁氨酰-L-丙氨酰-D-谷氨酰胺,Muramyl Dipeptide,简称MDP)是具有免疫增强活性的分枝杆菌细胞壁的最小有效成分 [3],对肿瘤及病原微生物具有免疫刺激及免疫治疗作用。本文就MDP在体外对儿童急性白血病骨髓来源DC的扩增和相关免疫功能进行研究。
2. 材料和方法
2.1. 材料
2.1.1. 骨髓来源
急性淋巴细胞性白血病患儿诊断和疗效均按血液病诊断及疗效标准,其中诊断标准:临床出现典型的症状体征(贫血、出血、感染、脏器浸润症状),外周血有/无幼稚细胞,骨髓原始加幼稚淋巴细胞 ≥ 30%;完全缓解的标准:1) 临床无贫血、出血、感染及白血病细胞浸润表现;2) 血象:血红蛋白 > 90 g/L,白细胞正常或减低,分类无幼稚细胞,血小板 > 100 × 109/L;3) 骨髓象:原始加幼稚淋巴细胞 < 5%,红细胞系统及巨核细胞系统正常。所有患儿均顺利完成化疗并完全缓解达6个月以上,无复发及其它并发症。住院当日无菌采集骨髓5 ml,肝素抗凝(20 U/ml)。
2.1.2. 细胞来源
HL-60细胞株购自中国科学院上海生命科学研究院。
2.1.3. 主要试剂
胞壁酰二肽(Sigma公司);重组人粒细胞–巨噬细胞集落刺激因子(recombinant human granulocyte-macrophage colony-stimulating factor, rhGM-CSF)、重组人肿瘤坏死因子-α (recombinant human tumor necrosis factor-α, rhTNF-α)、重组人白细胞介素(Recombinant human interleukin, rhIL)-2, 4 (Peprotech Asia公司);人白介素-12定量酶联检测试剂盒(IL-12)、人干扰素-γ定量酶联检测试剂盒(IFN-γ) (Jingmei Biotech公司)。
2.2. 方法
2.2.1. HL-60细胞株的培养及其全细胞抗原的制备
以含10% FCS的IMDM培养液于37℃、5% CO2、饱和湿度培养箱中孵育,每2~3天半量换液,传代培养HL-60细胞。收集对数生长期HL-60细胞,PBS洗涤(约1.0 × 106 cells/ml),放入液氮中速冻,后迅速放入37℃水浴中慢融,反复4次,所得细胞裂解液离心后,上清液稀释至1 ml,0.22 um微孔滤膜过滤,−20℃保存备用。
2.2.2. 骨髓单个核细胞(Mononuclear Cells, MNC)的分离
无菌采集抗凝骨髓5 ml,Ficoll-paque法分离MNC,调整细胞浓度为1 × 106/ml,接种于24孔培养板,于37℃,5% CO2孵箱中贴壁3~4 h。
2.2.3. 骨髓血树突状细胞(DC)的诱导
将上述细胞分组:对照组:MNC + rhGM-CSF (100 ng/ml) + IL-4 (100 ng/ml) + rhTNF-α (20 ng/ml);实验组分为5个亚组,1组:与对照组等量的MNC + MDP (10 ug/l),2~5组分别对应为:与对照组等量的MNC+与对照组等量的细胞因子+不同浓度的MDP (102 ug/l,102 ug/l,103 ug/l,104 ug/l);各组细胞均在37℃,5% CO2孵箱中培养,隔天半量换液及全量补充细胞因子与MDP。
培养过程中,倒置显微镜下每日观察细胞生长情况及形态变化。培养第9天,收取各组细胞进行实验。
2.2.4. 混合淋巴细胞反应(Mixed Lymphocyte Reaction, MLR)
无菌采集抗凝外周血5 ml,Ficoll-paque法分离获得MNC,37℃、5% CO2孵箱中贴壁3~4 h后取收集悬浮细胞,调整细胞浓度为1 × 106/ml,加入rhIL-2 (20 ng/ml),37℃,5% CO2孵箱中培养,隔天半量换液及全量补充细胞因子,第7天收获全部悬浮细胞,作为效应细胞。取培养第9天的对照组及实验组的DC作为刺激细胞。
1) 淋巴细胞增殖能力测定
刺激细胞分别以空白/孔、1 × 103/孔、5 × 103/孔、1 × 104/孔、5 × 104/孔接种于96孔培养板,分别加入1 × 105效应细胞,于37℃、5% CO2孵箱中进行混合淋巴细胞培养96 h后,加入MTT (20 ul/孔),继续孵育4 h,400×g,10 min终止培养,吸走上清,加入DMSO (150 ul/孔),酶标仪上于波长490 nm处检测A490值。
2) 细胞因子IL-12和IFN-γ的测定
MLR 96 h后,在刺激细胞为5 × 104/孔条件下,ELISA法测定上清中IL-12和IFN-γ含量。
2.2.5. 抗白血病细胞(HL-60)细胞毒效应
1) DC致敏
同上述骨髓MNC的分离和DC的培养方法一致,但分别于第4天、第7天的DC培养体系中两次加入HL-60全细胞抗原肽(DC:HL-60 = 10:1),致敏DC。将106/ml淋巴细胞与105/ml致敏后DCHL-60细胞混合培养于96孔板中,加入rhIL-2 (20 ng/ml)共培养6 d,获得细胞毒T淋巴细胞(cytotoxic T lymphocyte, CTL),作为效应细胞。调整HL-60细胞浓度为1.0 × 105/ml作为靶细胞(效:靶 = 10:1),37℃、5% CO2孵箱中12 h后,离心收集上清液,采用LDH释放试剂盒检测LDH含量,酶标仪上于波长490 nm处测定吸光度(A)。
杀伤活性 = (实验组A − 靶细胞自然释放组A − 效应细胞自然释放组A)/(靶细胞最大释放组A − 靶细胞自然释放组A) × 100% [4] [5]
2.2.6. 统计学处理
数据用均数 ± 标准差(
± S)表示,随机区组设计资料采用方差分析,均数间的相互比较采用t检验。
3. 结果
3.1. 对T细胞扩增的影响
当刺激细胞数一定时,不同组比较,对照组与1组、2组比较均无显著性差异(p均 > 0.05);3组、4组、5组T细胞扩增指数明显高于对照组,亦明显高于1组(p均 < 0.01)。当刺激细胞数量为1 × 103至1 × 104,同组间T细胞扩增指数逐渐增加(p均 < 0.01),1 × 104与5 × 104之间T细胞扩增指数的增加无统计学意义(p > 0.05)。见表1。
3.2. 对T细胞分泌细胞因子的影响
当刺激细胞数为5 × 104时,对照组与1组IL-12含量分别为(69.78 ± 7.40) pg/ml,(67.94 ± 9.69) pg/ml,两组间比较无显著性差异(t = 0.43, p > 0.05);2组为(78.18 ± 10.72) pg/ml,与对照组及1组比较均无显著性差异(t = 1.82、2.00, p > 0.05);3组、4组、5组明显高于对照组(t = 8.31、10.63、12.16,p均 < 0.01),亦明显高于1组(t = 8.25、10.61、11.90,p均 < 0.01)。
对照组与1组IFN-γ含量分别为(75.93 ± 9.25) pg/ml,(73.17 ± 8.13) pg/ml,两组间比较无显著性差异(t = 0.63, p > 0.05);2组为(81.92 ± 10.01) pg/ml,与对照组及1组比较均无显著性差异(t = 1.24、1.92, p > 0.05);3组、4组、5组明显高于对照组(t = 9.21、12.62、15.38,p均 < 0.01),亦明显高于1组(t = 9.59、12.77、15.66,p均 < 0.01)。见图1。
3.3. DC诱导的特异性抗白血病细胞毒效应
各组杀伤活性:对照组(47.54 ± 3.62)%;1组(58.43 ± 2.91)%;2组(73.58 ± 3.88)%;3组(82.12 ± 3.21)%;4组(90.53 ± 3.85)%;5组(98.90 ± 3.72)%。实验各组杀伤HL-60细胞活性均较对照组组显著增强(t = 5.24、10.97、15.98、18.19、22.69,p均 < 0.01);当MDP浓度由102 ug/l递增至104 ug/l,2组、3组、4组、5组组间比较,杀伤活性逐渐增加(2组与其余组比较:t = 3.79、7.34、10.32;3组与4、5组比较:t = 3.75、7.38;4与5组比较:t = 3.50,p均 < 0.01),以5组杀伤HL-60细胞活性最强。见图2。

Table 1. Comparison of the stimulation index of T cell in different groups ( x ¯ ± S)
表1. 不同组间T细胞扩增指数比较
F1 = 40.50, F2 = 32.36, p < 0.01; ΔP < 0.01, compared among group C, B and A, t = 8.96, 9.94, 12.23; ▼P > 0.05, compared group D with C, t = 0.16; ★P > 0.05, compared with the control group, t = 0.67, 0.28, 0.27, 0.36; compared with the group 1, t = 1.15, 0.50, 0.56, 0.77; ●P > 0.05, compared with the control group, t = 0.66, 0.18, 0.23, 0.35; ◆P < 0.01, compared with the control group, tA = 7.37, 10.10, 13.53, tB = 4.44, 6.30, 8.54, tC = 4.77, 5.96, 9.12, tD = 4.55, 5.57, 8.54; compared with the group 1, tA = 8.49, 10.24, 13.39, tB = 4.84, 6.74, 8.13, tC = 5.53, 6.78, 10.32, tD = 5.16, 6.19, 9.35.

Figure 1. The contents of IL-12、IFN-γ by ELISA (pg/ml)
图1. T细胞分泌细胞因子(IL-12、IFN-γ)含量
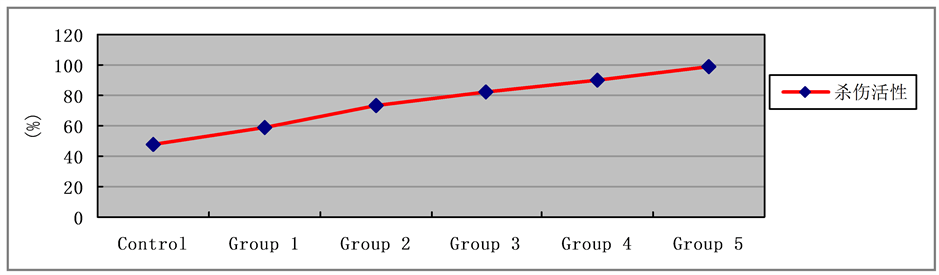
Figure 2. Cytotoxicity assay by LDH release
图2. LDH法检测细胞杀伤活性
4. 讨论
MRD是白血病容易复发的主要根源,是治愈白血病的主要障碍。通过相关的技术方法增强白血病细胞的免疫原性,进而诱导机体产生肿瘤特异性的细胞免疫应答消除肿瘤细胞,可望达到治愈白血病的目的。
CD8+ CTL是有效的抗肿瘤细胞免疫的核心。但是由于肿瘤细胞抗原表达较弱、共刺激因子缺乏等原因,宿主T细胞不能有效地识别和杀伤肿瘤细胞。因而如何更好地激发机体抗肿瘤免疫成为研究的热点。
DC是免疫系统中最强的APCs,表面HLA和共刺激因子的表达增强,可释放T细胞刺激因子(主要是IL-12),T细胞增殖且特异性针对DC递呈的抗原发挥作用。在混合淋巴细胞反应中,DC不仅能原位致敏CD4+T淋巴细胞,而且在体外可有效地诱导同种异体CD8+T淋巴细胞增殖,是DC用于临床治疗恶性肿瘤的基础 [6] [7] [8]。
MDP是人工合成的分枝杆菌细胞壁中具有佐剂活性作用的最小结构单位,可有效提高IL-1、IL-6和GSF等多种细胞因子的分泌水平,对一部分肿瘤已显示出明确的免疫治疗作用 [9]。目前,极多数学者研究卡介苗激活DCs为主的APCs对肿瘤抗原的递呈能力增强进而激活CTLs针对肿瘤细胞的特异性免疫反应,以及可诱导肿瘤细胞和局部免疫细胞产生IL-1、IL-6、IL-8、IL-2、IL-12、INF-γ等细胞因子,发挥直接抗肿瘤作用、免疫细胞网络调节效应和放大免疫细胞抗肿瘤活性 [10]。推测MDP也可能具有诱导扩增DC,促进T细胞的增殖、分泌及杀瘤的功能。
本研究组既往实验证实:从儿童急性白血病骨髓中分离出MNC,分别采用GM-CSF+IL-4+TNF-α、MDP及GM-CSF + IL-4 + TNF-α + MDP诱导,均得到一定数量的典型DCs [11]。本文中MDP诱导后的DC,在1 × 103即能促进T细胞的增殖和分泌IL-12、IFN-γ,且随着MDP浓度由102 ug/l递增至104 ug/l,作用进一步增强;并且CTL细胞的杀瘤活性亦随着MDP浓度的增加逐步增强。生理情况下IL-12主要来源于DC,除有明显的抗肿瘤作用外,尚能促进T淋巴细胞增殖,诱导产生IFN-γ。IFN-γ促进DC迅速增殖,并分化为成熟的效应性CTL,发挥免疫抗肿瘤作用 [12]。以上作用在细胞因子联合MDP应用后效果更为明显。说明当MDP诱导后的DC数量 ≥ 1 × 103时,即能促进T细胞的增殖,且有MDP浓度依赖性。而且,经MDP诱导后的DC具有促进T细胞分泌的作用,与细胞因子联合作用更强。另外,MDP能从儿童急性白血病骨髓中诱导出有较强的抗原刺激能力的DC,亦具有MDP浓度依赖性。由于MDP具有免疫增强活性和高效低毒特点,对肿瘤进行免疫治疗,将可能具有较大的临床潜在应用价值。
NOTES
*并列第一作者。
#通讯作者。