1. 引言
脑外伤具有很高的发病率、致残率和死亡率,其中认知障碍严重影响患者的预后和生存质量 [1] 。目前对脑外伤后认知障碍的药物治疗尚明确的循证医学证据 [2] 。研究证实,促红细胞生成素(erythropoietin, EPO)具有一定的神经保护和促进神经修复功能,在脑瘫、缺血性脑血管病、脑外伤、老年性痴呆、癌症放疗后脑损伤等有基础或临床的研究报道 [3] [4] [5] [6] [7] 。针对EPO治疗对脑外伤后认知障碍的影响,有研究通过大鼠模型探索了其用药剂量和疗效的关系,并通过测量病灶体积和神经元丢失的数量探索其可能机制 [8] 。但尚缺乏不同给药时间对疗效影响的研究,也缺乏针对神经递质相关的神经可塑性变化的机制研究。
本研究以成年雄性SD大鼠为研究对象,采用控制性皮层损伤(controlled cortical impact, CCI)方法制作双侧额叶正中皮质重度脑外伤模型,然后对大鼠模型进行不同时间点的EPO干预治疗,通过Morris水迷宫实验对比各组大鼠知功能障碍的改变,观察相关脑组织的神经细胞数及神经递质的变化,综合分析EPO治疗对脑外伤后认知功能的疗效差异以及作用机制。
2. 材料和方法
2.1. 实验对象
所有程序均符合中国首都医科大学动物福利准则,并经首都医科大学动物保护与使用委员会批准。选取3月龄、体重(275 ± 25) g的健康清洁级雄性SD大鼠(购于中国人民解放军军事医学科学院实验动物中心) 40只,随机分为对照组和三个治疗亚组(各10只)。所有动物先在温度为21℃ ± 1℃、光/暗周期为12 h/12 h、光照时间为7:00~19:00的条件下饲养适应7天,术前、术后均每日给予充足的水分及食物。每周更换垫料一次,保持干燥,造模前禁食12 h。
2.2. CCI模型制备
应用10%水合氯醛以0.30 mg/kg腹腔内注射进行麻醉。将大鼠固定在Kopf立体定向装置上,固定双侧头皮,在前囟门及人字缝之间距中线3 mm进行去骨瓣手术 [9] 。利用美国eCCI-6.3装置进行打击,打击速度:3.5 m/s,打击深度:1.5 mm,停留时间:400 ms [10] 。术后将头部切口进行缝合,并于腹腔内注射抗生素,防止感染。
2.3. 干预方法
治疗组三个亚组分别在造模后1周、2周、3周进行EPO腹腔内注射治疗(5000 U/kg/次,每天8:00一次性给药,连续3天),对照组不予治疗。
2.4. Morris水迷宫测试
所有实验大鼠于手术后4周进行一次Morris水迷宫测试。首先进行定位航行实验,每只大鼠每天测试4次,两次测试间隔15~20 min,计算4次测试的平均值作为当日的逃避潜伏期,以此作为空间学习能力的指标。次日进行空间探索实验,将大鼠由原先平台象限的对侧放入水中,记录大鼠在原先平台的象限所花的时间占总时间的百分比,以此作为空间记忆能力的指标。
2.5. 生长相关蛋白(growth associated protein-43, GAP-43)、突触素(synaptophysin, SYN)测定及分析
所有大鼠进行水迷宫测试后处死大鼠,取脑组织,分离海马组织。采用Western-blot定量检测GAP-43和SYN蛋白表达。应用Image Pro-Plus 6.0软件分析免疫组化图片:每组每张切片随机挑选3个200倍视野进行拍照。应用Image-Pro Plus 6.0软件选取相同的棕黄色作为判断所有照片阳性的统一标准,对每张照片进行分析,得出每张照片阳性的累积光密度值。
2.6. 统计分析
数据采用SPSS 16.0软件进行分析。数据以平均值±标准误的形式表示。各时间点水迷宫测试结果进行重复测量方差分析,相同时间点各组间采用单因素方差分析,对水迷宫测试结果采用Post hoc中LSD检验进行组间比较。各组空间探索实验在目标象限所用时间各组间采用单因素方差分析。将各组水迷宫定位航行实验结果换算为分数,即最高分60,最低分1,分别对应所用时间的整数,然后进行3日结果平均值的计算,结果作为认知功能测试得分。P < 0.05为差异有统计学意义。
3. 结果
3.1. 对照组和各个治疗组的测试结果
通过水迷宫测试逃避潜伏期变化反应大鼠的空间学习能力,目标象限停留时间变化反应大鼠的空间记忆功能,对照组和各个治疗组的测试结果参见表1。

Table 1. Comparison of escape latency and percentage of target quadrant residence time in water maze tests of each group
表1. 各组水迷宫测试逃避潜伏期和目标象限停留时间百分比的比较
#与对照组相比,P < 0.05;1周和2周开始治疗组与对照组相比,逃避潜伏期和目标象限停留时间均有统计学差异(P < 0.05);但3周开始治疗组与对照组相比,无统计学差异(P > 0.05)。
3.2. 各组脑外伤大鼠对海马区GAP-43和SYN阳性细胞IOD值的影响结果
各组脑外伤大鼠对海马区GAP-43和SYN阳性细胞IOD值的影响,结果参见表2和图1,图2。

Table 2. The IOD values of GAP-43 and SYN positive cells in hippocampus of rats in each group were compared
表2. 各组大鼠海马区GAP-43和SYN阳性细胞IOD值对比
#与对照组相比,P < 0.05;三个治疗组与对照组相比,GAP-43和SYN均有统计学差异(P < 0.05)。
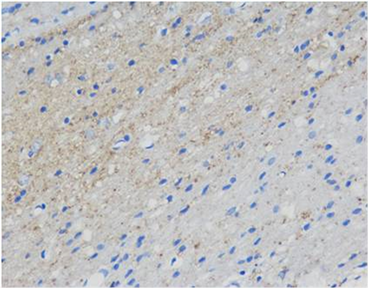 (A)
(A) 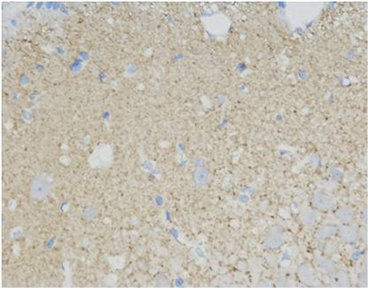 (B)
(B)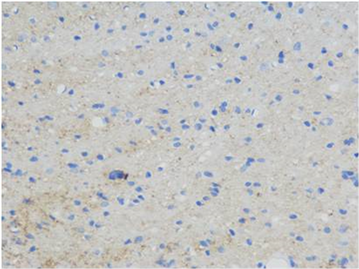 (C)
(C)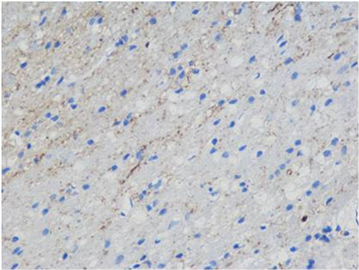 (D)
(D)
Figure 1. Immunohistochemical staining of the hippocampal area of rats in each group showed positive cells of GAP-43 (Blue. 400 times larger), (A) was the control group, (B) was the treatment group at week 1, (C) was the treatment group at week 2 and (D) was the treatment group at week 3
图1. 各组大鼠海马区免疫组化染色显示GAP-43阳性细胞(蓝色,放大400倍),(A)为对照组,(B)为1周开始治疗组,(C)为2周开始治疗组,(D)为3周开始治疗组
 (A)
(A)  (B)
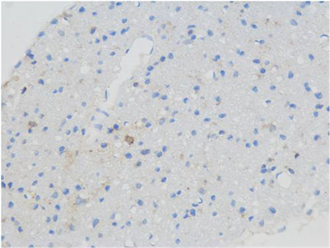
(B)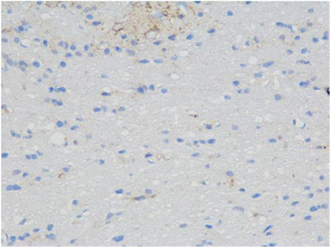 (C)
(C)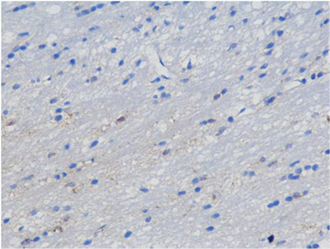 (D)
(D)
Figure 2. Immunohistochemical staining in the hippocampal area of rats in each group showed SYN positive cells (blue, 400 times amplified), (A) was the control group, (B) was the treatment group at week 1, (C) was the treatment group at week 2 and (D) was the treatment group at week 3
图2. 各组大鼠海马区免疫组化染色显示SYN阳性细胞(蓝色,放大400倍),(A)为对照组,(B)为1周开始治疗组,(C)为2周开始治疗组,(D)为3周开始治疗组
4. 讨论
临床研究发现,针对新生儿的缺血缺氧损伤,EPO治疗具有一定的神经保护和修复效果 [11] 。通过EPO治疗可以改善1型糖尿病、抑郁症、精神分裂症、乳腺癌化疗术后、Alzheimer病等患者的某些认知行为症状 [3] [4] [5] [6] [7] 。说明EPO具有一定的神经系统的治疗作用,尤其表现在改善认知功能方面,但是这些研究仅是小样本的报道。针对Epo的神经保护作用对认知功能的影响及其作用机制,进行了一定的基础研究,主要应用啮齿类动物的各种脑损伤模型 [12] [13] [14] ,但是针对Epo的促神经修复作用,缺少神经递质方面的研究。
本研究使用的CCI造模方法可精确控制打击部位、打击速度及停留时间,重复性更高,受个体差异因素影响较小 [15] ,可制备不同部位和严重程度的脑外伤模型。GAP-43是一个轴突膜蛋白,是一种神经特异性的蛋白质,参与神经细胞外生长及突触发育形成和神经细胞再生。在神经元发育和再生过程中以高水平表达,能调解轴突延伸作用,改变细胞形态。突触素可作为突触前终末的特异性标记物,用来检测突触的密度和分布 [16] ,已被广泛应用于研究动物模型及人类疾病的突触发生,并作为神经重塑的重要标记之一。
本研究对比成年脑外伤模型大鼠不同时间开始EPO治疗对认知功能的疗效影响,发现1周或2周开始治疗组的空间学习和记忆能力改善最为明显,和对照组相比均达到了显著性水平;而3周开始治疗组的认知功能改善和对照组相比均未达到显著性水平。因此可以初步说明,EPO的开始治疗时间对于改善脑外伤后认知功能障碍的疗效存在一定的影响,造模后1周至2周开始的疗效可能更好。
通过测定第4周时大鼠海马中与神经重塑相关的指标(GAP-43和SYN),发现在相同的治疗剂量(5000 U/kg)和疗程(连续3天)下,三个治疗组海马的GAP-43和SYN表达水平均较对照组有显著性差异,尤其是2周开始治疗组的GAP-43和SYN表达水平最高。GAP-43和SYN表达水平和水迷宫测试结果并不完全一致,这可能说明了不管治疗开始的时间早或晚(伤后1至3周),EPO治疗对神经可塑性都具有一定的促进作用,但第3周开始治疗对认知功能的改善效果不及更早期开始治疗那么明显,或者可能需要更长疗程才能体现。
通过与神经可塑性相关的研究,可以进一步揭示EPO对脑外伤的治疗机制。脑损伤后神经功能的改善是以结构和功能的重组为基础的,因此我们推测在脑外伤恢复期,类似于生长激素或者高压氧治疗,EPO也可能是通过影响与认知相关部位的神经重塑,达到改善认知功能的效果 [17] [18] 。
5. 结论
不管治疗开始的时间早或晚(伤后1至3周),EPO治疗对神经可塑性都具有一定的促进作用,但是EPO的开始治疗时间对于改善脑外伤后认知功能障碍的疗效存在一定的影响,造模后1周至2周开始的疗效可能更好。
基金项目
中央级公益性科研院所基本科研业务费专项资金课题(2015CZ-37)。
NOTES
*通讯作者。