1. 前言
心血管疾病患病人群逐年增加,不但严重威胁人群健康,而且严重消耗国家医疗资源,给家庭和社会造成沉重负担。心肌细胞肥大及纤维化是心血管疾病发展的主要病理表现,许多因素在这一病理过程中发挥不同作用。心肌肥大是许多心血管疾病共有的病理改变,是心脏对负荷增加、内分泌激活和能量代谢障碍体液因子改变、等多种刺激的一种适应性应答反应 [1] [2]。早期的心肌肥大有利于维持正常的心脏功能,但这种代偿并非是良性的,越来越多的研究证明长期的应激最终会导致心律失常、心力衰竭、猝死,这说明心肌肥大是多种心血管事件的独立危险因素 [3]。
microRNA是一种长度为22nt的短链RNA,能够通过调节基因表达来参与多种生命过程,包括早期发育,细胞增殖、凋亡和分化等。研究发现在心室重构、心力衰竭、心肌细胞凋亡等过程都受到miRNA的调控 [4] [5] [6] [7]。目前证实在心脏重构/心衰过程中表达下调的miRNAs主要有miR-1、miR-133、miR-30、miR-29、miR-10、miR-19、miR-101等 [8]。其中miR-29a可能参与心肌纤维化和心肌肥大的发生和发展。心肌梗死后心肌纤维化的形成伴随着miR-29a表达下调和Collagen 1A1基因表达增加 [9] ,而且心肌肥大患者的血浆miR-29a表达水平上升,能够作为心肌肥大和纤维化的分子标志物 [10]。同时,miR-29a还参与细胞周期的调节 [11] [12] [13] ,但是目前仍未有研究阐明miR-29a如何调控心肌肥大及其表达变化是否能够影响心肌细胞周期。
本研究主要通过血管紧张素II构建H9C2体外肥大心肌细胞模型,比较正常心肌细胞和肥大心肌细胞中miR-29a、CyclinA2、Bcl-2、Plk-1的表达水平,确定肥大心肌细胞中miR-29a的表达变化和细胞周期的变化。
2. 材料与方法
2.1. 材料与设备
2.1.1. 材料
大鼠心肌细胞系H9C2,购自武汉普诺赛生命科技有限公司。
2.1.2. 主要设备
TE2000-U倒置显微镜(Nikon);CO2培养箱(Thermo);NanoDrop 2000微量分光光度计(Thermo);PCR仪(Thermo);Light Cycler® 96 PCR仪(Roche);高速低温离心机(Thermo)。
2.1.3. 主要试剂
胰蛋白酶、DMEM培养基、胎牛血清(FBS)、磷酸盐缓冲液(PBS)均购于以色列Biological Industries公司;DMSO、血管紧张素(AngII)购于美国SIGMA公司,TransZolUP、细胞蛋白提取试剂盒、无酶水购于北京全式金公司;异丙醇,无水乙醇,氯仿均购于天津凯通化学试剂有限公司;GoScriptTM Reverse Transcription System,Go Taq® qPCR Master Mix购于普洛麦格(北京)生物技术有限公司;引物由上海生工生物技术有限公司合成,序列如表1所示。

Table 1. Sequences of primers for qPCR
表1. qPCR引物序列
2.2. 方法
2.2.1. 细胞培养和肥大心肌细胞诱导
常规培养H9C2细胞。将常规传代的H9C2细胞以1 × 105个/孔的细胞数量接种于6孔板中,使用含10%胎牛血清的DMEM高糖培养液于37℃、5% CO2、饱和湿度培养箱中培养,待其生长至汇合度达到50%~70%后,添加终浓度为0、1 × 10−5 mol/L,1 × 10−6 mol/L,1 × 10−7 mol/L的AngII诱导48 h,分别记作CTRL、105、106、107组。
诱导48 h后,对各组细胞进行拍照,使用ImageJ软件对细胞进行面积测量,比较各组间细胞面积差异。再将细胞重悬后,计数相同数量的细胞,使用试剂盒提取细胞总蛋白,使用BAC法测定总蛋白量。
2.2.2. 基因表达检测
使用全式金公司TransZol up总RNA提取试剂盒提取各组总RNA,分别按照反转录试剂盒说明书进行microRNA反转录和mRNA反转录,再使用qPCR技术检测各组miR-29a、Cyclin A2、Bcl-2、Plk-1相对表达量。
2.2.3. 统计学分析
采用GraphPad Prism 8进行统计学分析,数据使用ANOVA法进行单因素方差分析,比较各组与CTRL间的均数标准差差异,p < 0.05认为具有显著性差异。
3. 结果
3.1. 肥大心肌模型建立
正常H9C2心肌细胞呈梭形,折光性良好,细胞饱满;经过不同浓度AngII诱导48h后,细胞的表面积增加,向周围伸展较大,其中以1 × 10−5 mol/L浓度的AngII处理后的细胞体积最大。经过诱导后的细胞蛋白总量上升(图1,表2)。
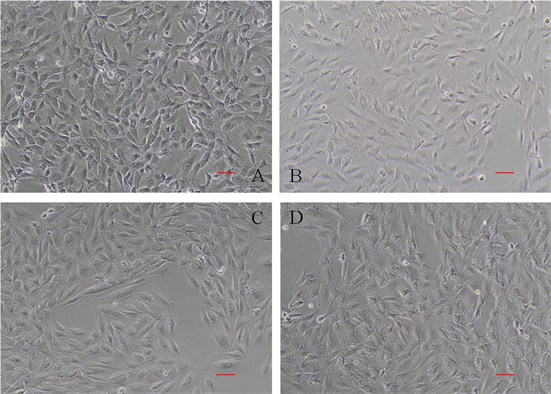 A、B、C、D分别为CTRL、105、106、107组细胞生长状态,各组加入的AngII终浓度分别为0、1 × 10−5、1 × 10−6、1 × 10−7 mol/L。Bar = 10 um。
A、B、C、D分别为CTRL、105、106、107组细胞生长状态,各组加入的AngII终浓度分别为0、1 × 10−5、1 × 10−6、1 × 10−7 mol/L。Bar = 10 um。
Figure 1. Growth status of H9C2 after AngII induced for 48 h (200×)
图1. H9C2细胞经AngII诱导48 h后生长状态(200×)

Table 2. Contrast of cell surface areas and total protein concentrations after AngII induced for 48 h ( x ¯ ± S )
表2. 不同浓度AngII诱导48 h后H9C2细胞面积和蛋白总量比较(
)
注:*与CTRL比较,p < 0.05。
3.2. miR-29a,CyclinA2,Bcl-2,Plk-1的表达
使用qPCR方法对miR-29a、Plk-1、Bcl-2和Cyclin A2的表达情况进行检测后发现(图2),与CTRL组相比,在使用1 × 10−5 mol/L的AngII诱导后,miR-29a、Plk-1、Bcl-2和Cyclin A2的表达水平发生了显著上调;用1 × 10−6 mol/L的AngII诱导后miR-29a表达水平上升最高,Bcl-2、Cyclin A2表达水平也上升,但较105组低,而Plk-1表达水平下降;107组的miR-29a表达水平与CTRL没有差异,而Plk-1和Bcl-2的表达水平降低,Cyclin A2表达水平较CTRL略有升高。
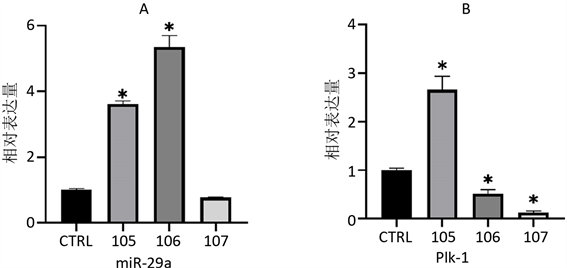
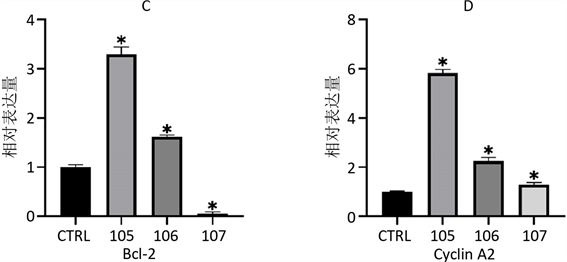 A、B、C、D分别为使用AngII诱导48 h后,细胞总miR-29a、PlK-1、Bcl-2和Cyclin A2的表达情况。*与CTRL相比,p < 0.05。
A、B、C、D分别为使用AngII诱导48 h后,细胞总miR-29a、PlK-1、Bcl-2和Cyclin A2的表达情况。*与CTRL相比,p < 0.05。
Figure 2. Relative expression changes of genes of every groups
图2. 不同处理组基因相对表达量变化
4. 讨论
有研究证实miR-29a能够靶向Cyclin D2抑制细胞周期 [14] ,而且低表达水平的miR-29a与肿瘤的增殖相关 [15] [16] [17] [18] ,高表达miR-29a则可抑制肿瘤细胞的增殖。在肥厚型心肌病患者的外周血miRNAs中,miR-29a水平与心脏MRI显示的心肌肥厚及纤维化程度密切相关 [10] ,它对心肌成纤维细胞的活化增殖起抑制作用,最终抑制纤维化的发生和发展 [19] ,并且能够调节心肌细胞的代谢或引起心肌细胞的凋亡 [20] ,抑制心肌肥大。本研究中使用AngII诱导H9C2细胞后,miR-29a表达水平显著上升,这与其他研究人员的发现类似,其高表达miR-29a后可能能够抑制正常心肌细胞向肥大心肌细胞转变。
Plk-1是存在于哺乳动物中的丝/苏氨酸激酶,位于细胞周期运行的中心环节,是调节细胞周期的重要分子 [21]。Plk-1作为一种癌基因,在多种恶性肿瘤中高表达,参与了肿瘤的侵袭与转移 [22] ,抑制Plk-1表达后,可导致多种肿瘤细胞生长的显著抑制和大规模细胞凋亡 [23]。Plk-1表达水平在106组中下调,而105组中上调,这与肥大心肌细胞诱导后细胞活力下降相符。
Bcl-2是一种抗凋亡蛋白,对细胞凋亡有抑制作用 [24]。miR-29可以直接靶向Bcl-2增加肝癌细胞(HCC)细胞对凋亡的敏感性,而且引入外源的miR-29到裸鼠体内,能够抑制肝癌细胞在裸鼠体内形成肿瘤的能力。这些研究结果表明,miR-29可通过抑制Bcl-2在线粒体通路促进细胞凋亡 [25] [26]。本研究中Bcl-2的表达量水平在10−5 mol/L,10−6 mol/L AngII诱导后的H9C2细胞中分别是空白对照组的3.30倍,1.60倍,表达量水平上调,但Bcl-2在高表达miR-29a组(106组)中的表达水平比低表达miR-29a组(105组)低,有可能miR-29a的高表达会导致Bcl-2的表达量下调,降低细胞活力。
Cyclin A2与有丝分裂紧密相关,它具有正性调节细胞周期活动的作用。Chaudhry H W等的研究中曾指出,哺乳动物心肌细胞的Cyclin A2在出生后不久便沉默,也就导致了成年哺乳动物心肌细胞几乎丧失了增殖能力 [27]。但是最近不少相关研究表明成熟心肌细胞具有分裂增殖能力,可以重回细胞周期,分裂产生新细胞以适应负荷改变 [28] [29]。在研究心肌肥大机制时发现,在肥大初期Cyclin、CDK等细胞周期正性调节因子明显上调,CDKI等细胞周期负性调节因子明显下调 [30]。在本研究中,10−5 mol/L、10−6 mol/L、10−7 mol/L AngII对H9C2细胞诱导48h后,心肌细胞CyclinA2的表达量水平分别是空白对照组的5.82倍、2.25倍、1.29倍,可能是多种心肌肥大的信号机制共同调节,使得心肌细胞中CyclinA2的表达量水平上调,促进细胞增殖,以满足细胞肥大时对合成蛋白的需要。可以推测诱导时给予的AngII浓度越大,心肌细胞受到的刺激越强,增殖表达越强。
综上所述,心肌细胞在肥大初期,心肌细胞增殖在多种因素形成的复杂网络调控机制协同调控下,使得心肌细胞启动细胞分裂和增殖。与正常心肌细胞相比较,miR-29a、Bcl-2和Cyclin A2的表达水平都上调,并且高表达的miR-29a能够对细胞周期相关基因产生抑制,但尚不足以控制细胞的肥大变化,这需要进一步调控miR-29a后观察。同时miR-29a通过直接还是间接地靶向细胞周期相关基因调节心肌细胞的肥大变化还不清楚,也需要进一步的研究证实。
基金项目
本研究受到内蒙古自然科学基金(2017BS0301),内蒙古高等学校科研项目(NJZY17260),包头医学院博士基金(BSJJ201608)和包头医学院杨帆计划(BYJJ-YF 201625)支持。
NOTES
*通讯作者。