1. 引言
造纸污泥是造纸废水处理产生的固态/半固态产物,其最主要特征为含有大量机物,占比处在40%~60%之间,含水量高,基本不含重金属,是亟待开发利用的生物质资源 [1] [2] [3] [4]。在中国境内,造纸行业平均每年会产出高达1.25亿t的污泥 [5]。然而,大部分均是以目直接填埋、随意堆放的形式来处置 [6] [7] [8],不但要占据大量的土地,还会导致严重的二次污染问题,引起生态环境的破坏 [9]。因此,如何实现造纸污泥的资源化利用,保护生态环境,引起了业内专家、学者的特别关注。
针对目前的污泥资源利用技术,主要是:土地利用、制堆肥、厌氧消化、建筑材料以及能源转换等 [10] [11] [12]。笔者所在课题组针对污泥转换利用展开相关研究过程中,意识到造纸污泥经过热解反应之后所产生的生物炭,有着活性位点数量多、孔隙良好、高位热值等优势。它不但能够用于调理污泥脱水,促使经脱水后的泥饼含水率从80%减少到40%,获得生物质燃料,快速达到污泥利用目标 [13] [14],还能够利用污泥中的有机和无机成分,高温烧结制备功能材料。高温烧结能够分解有机污染物,杀死病菌以及寄生虫,有效固化重金属,防止产生不必要的二次污染问题 [15]。本文以造纸污泥为主要原料,制备造纸污泥功能陶粒,意在探讨功能陶粒对Cu2+的吸附程度,为造纸污泥的有效利用以及相关技术提升,提供新思路与方法。
2. 实验部分
2.1. 实验原料及仪器
造纸污泥:选自广东省某造纸厂,测算发现含水率是33.92%,其具体数据见下表1所示:

Table 1. Industry analysis of sludge
表1. 污泥工业分析
试剂:硅酸钠、碳酸钙、氢氧化钠、OP乳化剂、铜试剂、氨水等,均为分析纯 [14]。
仪器:101型电热鼓风干燥箱;尤尼柯2100型分光光度计;SHA-B恒温振荡器;STM-3-14高温箱式电阻炉 [14];Nicolet 6700型傅里叶变换红外光谱仪;JSM-6380LV型扫描电子显微镜;Thermo escalab 250Xi型X−射线光电子能谱仪。
2.2. 造纸污泥制备功能陶粒(GTL)的方法
首先,将造纸污泥干燥并破碎至粒度小于200目,与膨润土、碳酸钙、硅酸钠按一定的比例混合均匀,人工造粒成粒径为50 ± 5 mm的球粒;然后将造粒球体送入恒温鼓风干燥箱中干燥至水分小于5%;把经干燥处理之后的球粒置于马弗炉内进行预热,高温烧结得到多孔陶粒(TL530);最后用氢氧化钠对陶粒改性,获得对重金属有较好吸附效果的GTL。
2.3. 含Cu2+模拟废水的配制及Cu2+浓度的测定方法
模拟废水中需要一定量的Cu2+,Cu2+质量浓度是100 mg/L,试验过程中依据需要进行稀释,采用可见分光光度方法来测算Cu2+的实际浓度,并求出陶粒对于Cu2+的去除率以及吸附容量值的大小,采用GTL对Cu2+的去除率以及吸附容量的大小评价其实际吸附水平 [14]。
Cu2+标准溶液的配制:事先称取出约0.3765 g CuNO3∙3H2O固体放置烧杯内实现溶解,而后放置于1000 mL容量瓶内实现定容,振荡摇匀,可获得100 mg/LCu2+标准溶液,其pH值 = 5.23,放置于安全地方等待使用。
Cu2+浓度的测定:事先将一定量的测溶液放置在25 mL比色管内,而后分别添加5 mL pH = 9的铵—氯化铵缓冲液、1 mL 2% OP乳化剂、13 mL 1 g/L铜试剂。在每一次添加结束之后,都要进行适度振荡操作。添加适量去离子水物质,使其与刻度线视线相平行,摇匀之后,置于一旁(时间控制在18 min)。采用分光光度计于443 nm波长,以去离子水作为参照物体,测算该溶液的吸光度,按照Cu2+标准曲线来测算浓度水平 [14]。
Cu2+标准曲线绘制:配制20 mg/L的Cu2+标准溶液,分别取0.5、1、1.5、2、2.5 mL于25 mL比色管内,参考Cu2+浓度测算公式,得到Cu2+标准曲线,其纵坐标是吸光度,横坐标是Cu2+浓度。见图1。
3. 实验结果与讨论
3.1. 造纸污泥制备GTL的最佳工艺条件
3.1.1. 造纸污泥煅烧多孔陶粒(TL530)的最佳工艺条件
造纸污泥制备TL530的关键影响因素为原料(造纸污泥、膨润土、碳酸钙、硅酸钠)配比、预干燥T、预干燥t、烧结T、烧结t。以陶粒比表面积最大化为目标,采用正交实验方法,最终获得造纸污泥制备多孔陶粒的最佳工艺条件是:污泥、膨润土、碳酸钙、硅酸钠比例是5:3:1:1,预热温度是450℃、预热时长是25 min、烧结温度是1000℃、烧结时长是25 min,所得陶粒比表面积是11.43 m2∙g−1。
3.1.2. TL530改性制备GTL的技术条件
用NaOH对TL530改性制备GTL的关键影响因素为NaOH浓度、NaOH的添加量、NaOH与TL530的作用时间。以GTL吸附模拟废水中的Cu2+最大化为目标,采用正交实验方法,得到TL530改性制备GTL的适宜技术条件为:1 g TL530添加浓度是2.5 mol/L的NaOH 30 mL,放置反应6 h,得到吸附重金属性能良好的GTL。
具体而言,造纸污泥制备GTL的方法如下:用粒径小于200目的造纸污泥(干基) 50 g与膨润土30 g、碳酸钙10 g、硅酸钠10 g混合均匀,加入一定量的水,手动制成粒径为50 ± 5 mm的球粒,然后将球粒在450℃ (升温速率控制在15℃/min)下恒温进行预热,时间控制在25 min左右。随后,在1000℃下恒温进行烧结,时间控制在20min左右。接着,借助于炉使其降低到室温,获得多孔陶粒TL530;称取50 g TL530,加入摩尔浓度为2.5 mol/L的NaOH溶液1500 mL,放入30℃恒温摇床里进行振荡,反应时间控制在6 h。使其冷却到室温,并以去离子水将其转变成中性,置于105℃烘箱内进行干燥,得到改性陶粒41.3 g。
3.2. GTL对Cu2+的吸附性能
3.2.1. GTL的投加量对 GTL吸附Cu2+效果的影响
为了了解吸附时长和陶粒吸附Cu2+水平的内在关联性,在自然pH条件中,将40 mL100 mg/L的Cu2+模拟废水放置到100 mL烧杯内,添加0.1 g陶粒,再放置到30℃恒温摇床内进行振荡,发生吸附反应,当吸附时间依次是0.5、1、1.5、2、2.5、4、6、8、12、14 h时,测定烧杯里模拟废水的Cu2+去除率,具体见下图2。

Figure 2. Relationship between adsorption time and GTL adsorption of Cu2+
图2. GTL的投加量和GTL吸附Cu2+效果的关系
伴随吸附时长的增加,Cu2+去除率也在逐步增加,直到完全饱和状态。通常情况下,可将吸附划分成以下几个部分:1) 4 h之前:主要是外表面活性位点进行吸附,整体速度较快;2) 4~6 h,这个阶段,外表面活性位点大部分均已经充分吸附,转变成内部吸附,整体速度放慢,即处在缓慢过渡期;3) 6~12 h,Cu2+经表面空隙逐步深入内部细孔的过程,速度也有所放缓;4) 12~18 h,大部分均已经形成平衡,Cu2+去除率超过99%。与其他Cu2+吸附材料相比,具有吸附容量高等优势,如表2所示。

Table 2. Comparison of GTL adsorbability for copper with other adsorbents in the literature
表2. GTL对铜的吸附能力与其他文献的吸附剂的比较
3.2.2. 吸附时间对GTL吸附Cu2+效果的影响
为了了解吸附时长和陶粒吸附Cu2+水平的内在关联性,在自然pH条件中,将40 mL100 mg/L的Cu2+模拟废水放置到100 mL烧杯里,添加0.1 g陶粒,而后放置到30℃恒温摇床内进行振荡,发生吸附反应。发现,如果吸附时长是0.5、1、1.5、2、2.5、4、6、8、12、14 h时,通过测算模拟废水的Cu2+去除率可见图3所示。
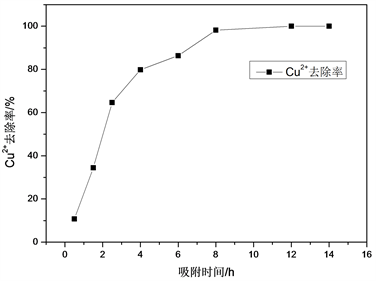
Figure 3. Relationship between adsorption time and GTL adsorption of Cu2+
图3. 吸附时间和GTL吸附Cu2+效果的关系
伴随吸附时长的增加,Cu2+去除率也在逐步增加,直到完全饱和状态。通常情况下,可将吸附划分成以下几个部分:1) 4 h之前:主要是外表面活性位点进行吸附,整体速度较快;2) 4~6 h,这个阶段,外表面活性位点大部分均已经充分吸附,转变成内部吸附,整体速度放慢,即处在缓慢过渡期;3) 6~12 h,Cu2+经表面空隙逐步深入内部细孔的过程,速度也有所放缓(4) 12~18 h,大部分均已经形成平衡,Cu2+去除率超过99%。
3.2.3. Cu2+初始浓度对GTL吸附Cu2+作用的影响
为了求证模拟废水里Cu2+初始浓度对于陶粒吸附Cu2+的水平,本次研究基于自然pH值条件限制,向9个内装40 mL Cu2+初始质量浓度依次是为60、80、100、120、140、160、180、200、220 mg/L的锥形瓶内各投入0.1 g陶粒,置于30℃恒温摇床中进行振荡吸附,把握在12 h左右,依次计算9个锥形瓶里的Cu2+去除率,具体结果见下图4。

Figure 4. Effect of Cu2+ initial concentration on Cu2+ removal rate
图4. Cu2+初始浓度对Cu2+去除率的作用
在Cu2+初始浓度≤120 mg/L,Cu2+去除率都超过了99%;但是,如果Cu2+浓度>100 mg/L,Cu2+去除率伴随浓度的提升而下降。这是由于陶粒增加值固定时,吸附位点也保持不变,吸附充分饱和时,提升Cu2+浓度,使得单位质量吸附剂周边的Cu2+增加,从而提高平衡浓度,Cu2+去除率下降,对Cu2+吸附容量不产生影响。因此,在Cu2+初始浓度设置成120 mg/L时,增加值等于0.0025 g/mL的吸附作用最明显。
3.2.4. pH值对GTL吸附Cu2+作用的影响
为了求证模拟废水里pH对GTL吸附Cu2+的作用效果,依次取40 mL 100 mg/LCu2+模拟废水7份放入锥形瓶内,调整pH值依次是1、2、3、4、5、6、7,都加入GTL质量是0.0025 g/mL,置于40℃恒温摇床内进行振荡,控制在12 h左右,具体结果见下图5。
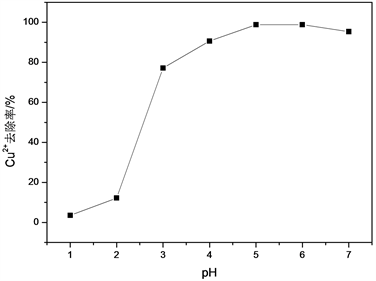
Figure 5. Effect of pH of Cu2+ simulated wastewater on Cu2+ removal rate
图5. Cu2+模拟废水的pH对Cu2+去除率的影响
伴随pH值的提升,Cu2+去除率也逐步增加。在较低的pH值时,其酸性较强,H+和GTL里的羟基相作用,耗费了许多羟基位点,抑制GTL对Cu2+的吸附能力;伴随pH值的提升,酸性慢慢减弱,H+浓度下降,耗费的羟基位点变少,GTL对Cu2+的吸附能力回升至高点,Cu2+去除率增加。当pH值 = 5~6,Cu2+去除率逐步偏向稳定。因此,可取pH = 5~6时,Cu2+去除率达到最佳为98.74%。
3.3. GTL吸附Cu2+的机理探讨
3.3.1. GTL对Cu2+的吸附模型
为了更好地阐述GTL对Cu2+的吸附过程,在此借助于Langmuir吸附等温模型拟合曲线来展开进一步的研究,表达式见下式(1) [14]:
(1)
其中:Ce是平衡质量浓度,mg/L;Qe是平衡容量,mg/g;Q0是最大容量,mg/g;Ka是常数,L/mg。
向8个内装40 mLCu2+浓度依次是60、80、100、120、140、160、180、 200、220 mg/L的模拟废水里,添加GTL质量是0.0025 g/mL,将其放置于40℃恒温摇床内进行振荡,发生吸附时间控制在12 h。Ce是横坐标,Ce/Qe是纵坐标,可得图6,拟合方程是式(2) [14],方程线性相关度R2 = 0.998 19。意味着,Langmuir等温式可用来阐述GTL对Cu2+的吸附过程。
(2)
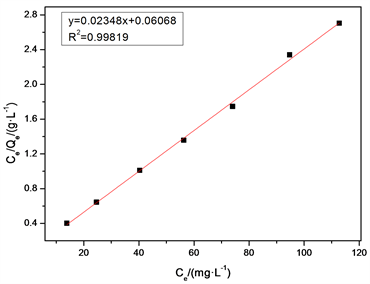
Figure 6. Langmuir adsorption isothermal model fitting curve
图6. Langmuir吸附等温模型拟合曲线
3.3.2. 机理探讨
1) 红外光谱分析
采用美国Nicolet公司生产的Nicolet6 700型红外光谱仪来对TL530、GTL进行官能团的表征,相关数据见下图7。在图7中,从下到上依次是GTL (改性后陶粒)、TL530 (未改性陶粒)。
通过分析红外光谱图发现,陶粒与改性后陶粒在波长922、1012、3432 cm−1处都有吸收峰,但是所发挥的作用效果不一。具体而言,于3432 cm−1处是宽峰,于1012 cm−1处属于中强度,提示有羟基。且就吸收强度而言,改性前 < 改性后,提示改性后羟基官能团数量多于改性前。也正是因为改性后存在大量的羟基官能团,Cu2+可以和羟基转变为络合物,基于化学键作用而固定,进而实现去除铜离子的目标。
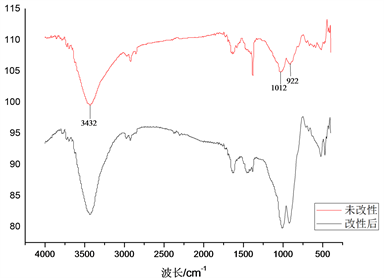
Figure 7. Infrared spectrum of TL530 and GTL
图7. TL5300及GTL的红外光谱图
2) 扫描电镜及能谱图
以JSM-6 380LV型显微镜对改性陶粒和吸附Cu2+的改性陶粒表面形态进行表征,可见下图8。通过观察下图8(a)发现,吸附前样品表面大多出现聚集型微小颗粒,结晶熔融状态呈现较好,主要以微孔为主,图8(b)为改性吸附后,样品表面有许多球状颗粒结构,这是由于改性后的羟基和铜离子产生吸附反应,形成含铜离子沉淀物质,经过絮凝作用,转变成体积较大的沉淀团,基于化学键被固定吸附于样品表面及孔内。
 (a)
(a)  (b)
(b)
Figure 8. Scanning electron micrograph of GTL (a) and GTL (b) Adsorbing Cu2+
图8. GTL (a)及吸附Cu2+ (b)的GTL扫描电镜图
另外,改性后陶粒和吸附Cu2+的陶粒的能谱图见下图9,表3是能谱图中的元素重量百分比。根据表3可得,改性陶粒里含有许多氧元素,且氧元素含量增加,验证了改性后的羟基增加(可能含有其它含氧基团),有利于Cu2+的吸附。由于羟基是吸附反应过程里的关键基团,氧元素的含量可以体现出构成的基团含量比例,而铜元素重量百分比由发生吸附之前的0%提高到3.39%,可进一步证实Cu2+被吸附固定于改性陶粒。

Table 3. Element weight percentage of GTL and GTL adsorbing Cu2+
表3. GTL与吸附Cu2+的GTL的元素重量百分比

Figure 9. Energy spectrum of GTL (a) and GTL (b) adsorption Cu2+
图9. GTL (a)及吸附Cu2+的GTL (b)能谱图
4. 结论
1) 用粒径小于200目的造纸污泥(干基) 50 g与膨润土30 g、碳酸钠10 g、硅酸钠10 g混合均匀,加入一定量的水,手动制成粒径为50 ± 5 mm的球粒,然后将球粒在450℃下恒温预热25 min,随后,在1000℃条件下进行恒温烧结,时间控制在20min。而后,借助于炉使其降低到室温,获得多孔陶粒TL530;用50 g TL530,加入摩尔浓度为2.5 mol/L的NaOH溶液1500 mL,置于30℃恒温摇床内进行振荡,时间控制在6 h,而后将其降低到室温,以去离子水将其转变为中性,放置105℃烘箱内进行干燥,可得到吸附性能良好的GTL 41.3 g。
2) GTL对于Cu2+具备较强的吸附作用,如果将GTL添加量控制在0.0025 g/mL模拟废水,则Cu2+去除率接近98.13%。
3) GTL对于Cu2+的吸附表现,与Langmuir吸附等温模型相类似,提升GTL对于Cu2+的吸附。
4) GTL吸附铜离子的机理是化学吸附,也就是GTL里富含羟基官能团,Cu2+可以和羟基共同作用转化为络合物,基于化学键固定于GTL的表面或是孔内,进而实现祛除模拟废水内铜离子的目标。
基金项目
国家自然科学基金资助项目(No. 51478182)。
NOTES
*通讯作者。