1. 引言
乳腺癌是女性最常见的恶性肿瘤,2020年世界卫生组织国际癌症研究机构(IARC)最新数据显示,乳腺癌已取代肺癌成为全球发病率最高的癌症,新增人数高达226万,全球死亡病例68万。乳腺癌的复发、转移是全球女性癌症死亡的主要原因,近年来乳腺癌患者脑膜转移的发生率逐年升高,因其治疗手段有限、预后较差严重影响乳腺癌患者的生存。青岛大学附属医院乳腺病诊疗中心收治1例乳腺癌新辅助化疗后脑膜转移的患者,现结合国内外相关文献对其诊治经过进行回顾分析,以期为临床诊治提供参考。
2. 病例资料
患者,女性,56岁,于2020年5月14日因“发现右乳肿块1年”入院。查体:右乳12点距乳头2 cm处可及1枚肿物,大小约2.0 × 2.0 cm,质硬,形态不规则,活动度差,右腋下触及肿大质硬固定淋巴结5.0 × 3.0 cm。乳腺超声示:右乳皮肤略水肿增厚,右乳头上方见1.5 × 1.5 × 1.6 cm低回声结节,形态欠规则,边缘毛糙成角,BI-RADS 4c类,右腋下见2~3个肿大淋巴结,大者4.7 × 2.1 cm (图1A)。穿刺病理示:浸润性癌伴淋巴组织内癌转移,ER(+,3%),PR(-),HER2(0),Ki-67(+,30%)。否认家族遗传倾向性疾病,其余全身检查未见明显异常。患者于5月18日始接受TE方案新辅助化疗(多西紫杉醇75 mg/m2 + 表柔比星75 mg/m2),6周期后肿块较前缩小,右乳水肿、皮肤增厚明显减轻,疗效评估PR (图1B)。术前再次完善颅脑、胸腹部CT,未见远处转移征象,遂于12月9日全麻下行右侧乳腺癌改良根治术。术后病理示:经新辅助化疗后,于根切乳腺外上象限见浸润性小叶癌(II级,范围1.1 * 0.8 cm),MP分级:I级(G1),RCB分级(III级),腋窝淋巴结转移(5/15),ER(-),PR(-),HER2(0),Ki-67(+,30%),E-Cadherin(-),脉管癌栓(-) (图2A)。

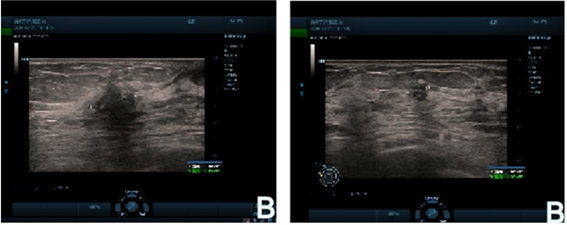
Figure 1. Ultrasonic signs of breast lumps and lymph nodes before (A) and after (B) neoadjuvant chemotherapy
图1. 新辅助化疗前(A)、后(B)乳房肿块及淋巴结超声征象

Figure 2. (A) H-E ×200 Tumor (B) H-E ×100 heterotypic cells with large hyperchromatic nuclei in the smear (C) CKpan(+) ×100
图2. (A) H-E ×200肿瘤;(B) H-E ×100涂片内见核大深染的异型细胞;(C) CKpan(+) ×100
2020年12月11日术后第2天,患者自诉间歇性头痛、头晕,于夜间出现恶心呕吐,予以对症治疗,追问病史,自诉头痛已持续1月余,近日加重。完善颅脑MRI平扫及增强扫描:左侧上颌骨(累及上颌窦前内侧壁)见不规则团块状稍高信号影,范围约28 mm × 39 mm × 42 mm,局部骨质破坏,边界不清楚,皮下软组织受累,考虑恶性肿瘤(图3)。脊椎MRI未见颅外转移征象。患者于12月15日出现持续性全头部胀痛,恶心呕吐,后出现一过性意识丧失,伴肢体抽搐及尿失禁,予以降颅压、抗癫痫治疗缓解症状。左侧上颌窦发炎红肿,行抗生素治疗3日稍好转。因高度怀疑乳腺癌脑膜转移遂行腰椎穿刺术,脑脊液压力390 mmH2O。脑脊液生化示:脑脊液蛋白629.7 mg/L,葡萄糖2.10 mmol/L,氯114.3 mmol/L,免疫球蛋白G 51.20 mg/L。脑脊液培养示:无细菌生长。(脑脊液)涂片及细胞蜡块内发现少许异型细胞,形态学符合乳腺来源恶性肿瘤细胞。CKpan(+) (图2B,图2C)。综上,该患者乳腺癌脑膜转移诊断明确,伴上颌骨转移可能。随后数日病情进行性加重,多学科会诊考虑患者一般情况无法耐受风险较高的鞘内化疗,放疗效果欠佳,上颌骨占位不除外骨转移,但患者一般情况无法耐受全麻活检明确病理性质,且结合病史活检对后续治疗意义不大。暂行降颅压、营养支持等对症治疗,患者家属选择放弃有创治疗及放化疗,返回当地医院行对症治疗。

Figure 3. Cranial MR-DWI and enhanced MR scanning
图3. 颅脑MR平扫 + DWI成像、MR增强扫描
3. 讨论
脑膜转移瘤(meningeal metastases)是乳腺癌晚期的严重并发症,发生率约为5%,是恶性肿瘤细胞经由血液、淋巴途径侵犯脑膜和(或)蛛网膜下腔的脑脊液所致。乳腺癌因其全球范围的高发病率成为常见的引起脑膜转移的实体肿瘤之一 [1]。文献报道,脑膜转移瘤在浸润性小叶癌以及恶性程度最高的三阴性乳腺癌(TNBC)患者中更常见 [2]。本例患者初治时雌激素受体低表达,新辅助化疗后转为TNBC,与非TNBC相比复发转移率高,更易发生脑转移,预后较差。脑膜转移瘤严重威胁晚期乳腺癌患者的预后和生存质量,确诊后的中位生存期不足4月 [3]。及早通过临床症状、颅脑MRI、脑脊液细胞学检查诊断并进行放化疗干预有助于延缓病情恶化、改善生存 [4]。文献显示,绝大多数乳腺癌脑膜转移患者表现为神经系统症状和体征,本例报道的患者头痛、恶心呕吐、癫痫发作、意识丧失等均为典型表现。早期脑膜转移以慢性不典型的中重度头痛为主要症状,常被临床表现更明显的化疗副作用等掩盖,在加重期诊断时已较难控制,导致诊治的延误。因此临床面对不典型的神经系统症状时,除给予必要的对症支持治疗,还应完善相关系统检查以及早排除颅脑转移可能。
脑脊液细胞学是诊断脑膜转移瘤的金标准,特异性高达95% [5]。T1加权成像(T1WI)作为检测脑膜转移最敏感的MRI序列在临床诊断中发挥着重要价值,其典型表现是脑脊液内及沿脑、脊髓等呈线性、斑块样的强化 [6]。脑脊液细胞学阳性患者中有75%~90%颅脑MRI表现异常,类似于本报道病例,少数患者因脑膜转移病灶强化程度较弱未被检出,从而导致影像学的假阴性表现 [7]。这提示我们需要将两种检查手段结合以提高脑膜转移的检出率。晚期乳腺癌患者出现颅内压增高明显,病情进展迅速时,即使颅脑MRI未提示特异性脑膜转移征象,也考虑不除外乳腺癌脑膜转移可能性,应及早行脑脊液细胞学检查明确病因。
目前尚缺乏脑膜转移治疗的相关指南,多数文献为临床回顾性分析或个案报道,仍需要更多大样本的临床试验对这些治疗方式的有效性进行证实。常用治疗包括全身化疗、局部放疗、鞘内化疗、靶向治疗、内分泌治疗等,治疗以患者可耐受为前提,尽可能改善患者生存质量,延长生存期 [8]。但多数脑膜转移患者治疗效果不佳,很大程度仍依赖临床医生通过辅助检查早期发现脑膜转移的证据来改善患者的生存结局。
有关乳腺癌新辅助化疗后发生脑膜转移的文献报道较少,有研究者在小鼠乳腺癌模型中发现,新辅助化疗广泛使用的两类细胞毒性药物,紫杉醇类和蒽环类,在降低乳腺癌分期的同时可引起肿瘤转移。化疗可诱导原发肿瘤释放的细胞外囊泡,进而促进侵袭性癌细胞远处播散和生长 [9]。但肿瘤来源的外泌体在人类乳腺癌转移进程中的作用尚未得到全面证实 [10]。有文献报道新辅助化疗在缩小原发灶的同时增加肿瘤转移微环境的活性,一定程度上减少了乳腺癌患者的临床获益 [11]。当然,新辅助化疗作为局部进展期乳腺癌的标准治疗方案仍具有不可替代的临床意义,我们需要做的是针对其副作用机制进行深入研究,寻找逆转肿瘤恶性进展的关键靶点,实现对化疗过程中转移性进展的早期预测及干预。总之,希望本例报道能得到临床医师的广泛关注,总结乳腺癌脑膜转移的早期征象及有效干预方法,更全面认识新辅助化疗的临床意义和不确定性,不断完善乳腺癌血液早检技术,为临床决策的制定提供参考。
同意书
本病例报道已获得病人家属的知情同意。