1. 引言
铬是地壳中含量分布较广的金属元素之一,是一种重要且广泛使用的基础材料,用于金属电镀、合金制造、皮革鞣制、木材防腐和陶瓷制造等 [1]。铬在工业上的广泛应用,导致铬渣以及含铬废水经雨水的淋溶和渗滤作用进入土壤,受到严重的铬污染 [2]。铬污染对生态系统中的各种生物的生长都会造成威胁,六价铬是公认的铬残留物中的主要有害物质,与三价铬相比,六价铬的氧化迁移能力更强、生物毒性更大 [3] [4]。高浓度的六价铬影响植物的生长和发育,以至于植物变黄甚至死亡 [5]。微生物胞内的某些结构如酶的活性中心会受到铬的破坏,或者微生物胞内富集至一定浓度的铬,从而对微生物造成毒害。同时,六价铬又是致突变物质,可造成DNA断裂,引起染色体变异 [6]。因此,Cr(VI)一进入体内就会对器官和DNA造成不可逆的损害,这凸显了制定有效的铬去除策略的迫切需要。
生物强化修复铬污染的土壤是指向土壤中投加从自然界中筛选富集出的优势耐受种群或通过基因工程构造的高效降解菌种,利用其新陈代谢活动将六价铬转化为三价铬,达到降低土壤毒性的目的,有原位修复和异位修复两种操作类型。与物理化学修复技术相比,生物修复技术具有成本低、处理效果好、无二次污染等优势 [7] [8]。特别是细菌和真菌可以高效、低能耗地去除环境中有毒的六价铬,微生物的吸附、还原和积累是降低Cr(VI)生物毒性的主要途径 [9] [10]。已鉴定并报道了多种具有Cr(VI)去除能力的细菌和真菌,如硫酸盐还原菌(SRB) [11]、无色杆菌属(Achromobacter) [12]、芽孢杆菌属(Bacillus) [13]、希瓦氏菌属(Escherichia) [14]、大肠杆菌(Escherichia coli) [15] 和假单胞菌属(Pseudomonas) [16]。不同的细菌具有不同的Cr(VI)去除机制 [17]。例如,Valerie Desjardin [18] 等人分离出可去除Cr(VI)的链霉菌,并将其在培养基中与含铬土壤共同培养,发现当土样中的Cr(VI)含量达1.8 mg/g时,30天后Cr(VI)可被完全去除。Jeyasingh [19] 等人分离并富集出对铬有较好还原效果的菌株,并在好氧和厌氧条件下评价其还原能力,培养20天后六价铬的还原率达100%。Srivastava和Thakur [20] 等人从皮革废水中分离出对铬有较高去除率的黑霉菌等。
微生物修复技术在修复过程中不仅可以保持土壤原本的结构和理化性质,还能够最大限度地降低六价铬的浓度且处理成本较低,但是利用微生物去除土壤中的重金属污染物有诸多优点,在实际应用上仍存在一定的问题,各种微生物还原六价铬的方式和速率都不相同,并会受到温度、pH值等环境因素的影响。因此需要选择合适的微生物进行有针对性地高效修复且保证修复期间环境因素的适宜。实验室中筛选出的菌株能否在自然环境中发挥作用,是生物强化修复技术成功的关键。本实验选取从胜利油田污染土壤筛选出的微嗜酸寡养单胞菌(Stenotrophomonas acidaminiphila) 4-1,开展菌株4-1去除土壤中Cr(VI)的潜力的研究,以及单因素优化的工艺条件,并采用响应面优化法确定了菌株4-1对土壤中六价铬去除的最优条件及最大去除率,为铬Cr(VI)污染土壤修复应用提供了工艺参数调控基础,为后续微生物实际场地的修复技术的优化提供理论依据。
2. 材料与方法
2.1. 材料与设备
2.1.1. 试剂
重铬酸钾、氯化钠、葡萄糖、硫酸、磷酸、胰蛋白胨、硝酸、碳酸钠、氯化镁、磷酸氢二钾、磷酸二氢钾(均由国药集团化学试剂有限公司生产);无水乙醇(天津市汇杭化工科技有限公司);丙酮(成都市科隆化学品有限公司);氢氧化钠(麦克林试剂公司);二苯碳酰二肼(天津市致远化学试剂有限公司);酵母粉(上海源叶生物科技有限公司)所有试剂均为分析纯。
2.1.2. 仪器设备
AL104型电子天平:梅特勒–托利多仪器(上海)有限公司;721型可见分光光度计:上海舜宇恒平科学仪器有限公司;DHG-9053J型精密恒温鼓风干燥箱:上海三发科学仪器有限公司;SHZ-82型恒温振荡器:常州智博瑞仪器制造有限公司;SPX型生化培养箱:宁波市科技园区新江南仪器有限公司;D3024R型高速冷冻微量离心机:大龙兴创实验仪器有限公司;YXQ-LS-18SI型手提式压力蒸汽灭菌器:上海市申按医疗器械厂;HC-3018型高速离心机:安徽中科中佳科学仪器有限公司。
2.2. 实验方法
2.2.1. 供试菌株
供试菌株为从铬污染的土壤中分离得出的一株六价铬抗性菌,经鉴定为微嗜酸寡养单胞菌(Stenotrophomonas acidaminiphila)编号为4-1,其分类地位是变形菌门、丙型变形菌纲、黄胞单菌目、黄胞单菌科、寡养单胞菌属,该菌于2019年1月8日保藏于中国典型培养物保藏中心(地址:中国湖北省武汉大学),保藏号为:CCTCC M 2019031。
2.2.2. 培养基
LB (Luria-Bertani)液体培养基及LB (Luria-Bertani)固体培养基的配置方法参照参考文献 [21],121℃灭菌20分钟。
2.2.3. 菌株活化与培养
在LB固体培养基上对菌株4-1进行活化。挑取单菌落到LB液体培养基中,然后在恒温摇床中30℃、160 r/min过夜培养,待生长至对数期后作为种子液用于接种。
2.2.4. 供试土壤
采样方法:在1 m2内采用五点取样法,采样时先铲去地表植物、枯叶和2 cm左右的表层土后,挖取土壤,采样深度为7~10 cm。除杂、风干、过10目筛后装袋,室温下干燥保存,备后续实验使用。
2.2.5. 影响因素
进行单因素试验,调节土壤中的初始六价铬浓度、土壤含水率、菌液接种量和葡萄糖浓度四种主要的影响因素。
2.3. 分析方法
1) 土壤理化性质测定方法
土壤理化性质(土壤含水率、pH值、有机质、速效磷、本底铬)由国际统一标准方法测定。
2) 土壤中六价铬的测定
土壤中六价铬的测定参照《土壤和沉积物 六价铬的测定 碱溶液提取——火焰原子吸收分光光度法(HJ1082-2019)》。
3) Cr(VI)去除率的分析计算方法
调节25 g的土样中Cr(VI)的浓度分别为0 mg∙g−1、0.2 mg∙g−1、0.3 mg∙g−1、0.7 mg∙g−1、1.0 mg∙g−1、3.0 mg∙g−1、10.0 mg∙g−1,菌4-1接种量为3 mL。所有实验均在30℃的恒温振荡器中培养7天。之后样品用碱溶液提取——火焰原子吸收分光光度法测定吸光度。用测定的标准曲线(R2 = 0.9993)计算Cr(VI)去除率。因此,Cr(VI)去除效率的百分比为 [22]:
Cr(VI)去除率 =
(1)
其中C1和C2分别为生物去除实验中的Cr(VI)对照浓度和最终浓度。
3. 结果与讨论
3.1. 模拟铬污染土壤理化性质
实验所采用的模拟铬污染土壤的基本理化性质见表1。该土壤呈弱酸性,有机质含量为9.3%,速效磷含量为13.89 mg∙Kg−1,土壤中的重金属本底铬含量约为3.135~3.334 μg∙g−1。在模拟铬污染实验中,将会向该土壤中添加一定量的重铬酸钾溶液以调节所需的不同土壤Cr(VI)浓度。
由国标方法测定的土壤理化性质结果如下表1:

Table 1. Physical and chemical properties of soil
表1. 土壤理化性质
3.2. 不同初始六价铬浓度对菌株4-1去除六价铬能力的影响
由图1可见,随着六价铬浓度的增加,菌株4-1的去除效果呈现逐渐降低的趋势,说明该菌发挥其作用是有一定初始浓度范围,在六价铬浓度为0.2~1.0 mg∙g−1时去除效果均可达40.0%以上。六价铬浓度过高会导致4-1菌株失活或失效。目前铬渣污染表层土六价铬浓度最高可达10 mg∙g−1 [23],依据该实验发现,应对铬渣污染浓度过高表土进行稀释等预处理降低其六价铬浓度后再用4-1菌进行修复。
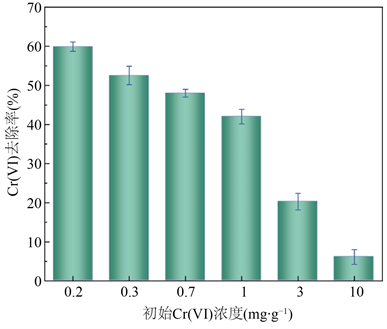
Figure 1. Effects of different initial Cr(VI) concentrations on removal of hexavalent chromium by strain 4-1
图1. 不同初始Cr(VI)浓度对菌株4-1去除六价铬的影响
3.3. 不同菌液接种量对菌株4-1去除六价铬能力的影响
向土壤中的某一区域投加外源菌株后,菌株虽然不一定能够一直生存在土壤中,但是仍然会对土壤中的优势种群造成一定的影响 [24],从而对整个微生物的群落结构产生影响。虽然外源微生物在一定情况下会调控土著微生物的群落多样性,从而使土壤的肥力提高,但是也有可能会使土壤中的生态环境失衡。因此,研究了不同的细菌投加量对修复效果的影响。从图2中可以看出,随着细菌接种量由1 mL增加到4 mL,实验组中的铬(VI)去除率也随之增大,其中,菌株投加量在4.0 mL时,铬(VI)去除率最高为47.15%。而进一步增大接种量,该菌对Cr(VI)的去除能力有下降的趋势,这可能是由于大量接种导致对营养物质的需求增加、菌群个体对营养物质的利用减少以及整体新陈代谢减慢所致。同时,如果接种量太大,由于剩余的细菌继续繁殖,后续的处理会变得很麻烦。因而选取最佳接种量为4 mL。
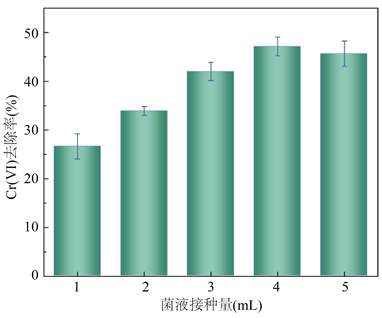
Figure 2. Effects of different inoculum amounts on removal of hexavalent chromium by strain 4-1
图2. 不同菌液接种量对菌株4-1去除六价铬的影响
3.4. 不同土壤含水率对菌株4-1去除六价铬的影响
在微生物修复的过程中,会受到诸多环境因素如含水率等的影响。土壤中的水分可以用来维持土壤中微生物的活性,含水率会影响微生物对养分的利用率以及其生理活动 [25]。不同含水率对菌株4-1修复铬(VI)污染土壤的影响如图3所示,从图中可以看出,含水率对修复效果的影响很大。含水率从0%增加到15%时,六价铬去除率急剧增加,此时六价铬去除率最高,为47.15%。继续增加土壤含水率,去除率不再呈上升的趋势,而是缓慢下降。说明过高的含水率会对菌株4-1的生命活动有轻微的抑制作用,使修复效果呈现下降趋势。

Figure 3. Effects of different soil moisture content on removal of hexavalent chromium by strain 4-1
图3. 不同土壤含水率对菌株4-1去除六价铬的影响
3.5. 不同葡萄糖投加量对菌株4-1去除六价铬能力的影响
据报道,电子供体有利于微生物去除Cr(VI) [26]。为了探究不同电子供体对菌株4-1去除Cr(VI)能力的影响,我们在液体LB培养基中分别添加了葡萄糖、蔗糖和乳酸钠。在菌株4-1在水体环境去除Cr(VI)的研究中发现,葡萄糖电子供体的添加对菌株4-1去除六价铬有很大的促进作用。为研究葡萄糖电子供体在土壤中对六价铬的影响,以葡萄糖作为影响因素加以分析。由图4可知,添加葡萄糖电子供体对Cr(VI)的去除率均高于空白对照组,且随着葡萄糖浓度的增加,去除率有明显提高,葡萄糖添加量从3%提高到5%时,六价铬的去除率从47.15%提高到75.34%,但当继续增大葡萄糖添加量时,去除率有下降的趋势。结果表明添加葡萄糖电子供体有利于菌株4-1对土壤中Cr(VI)的去除。
3.6. 土壤环境因子响应面优化
为探讨各种因素对Cr(VI)去除率的交互作用,根据上述实验结果,对四个影响因素(初始六价铬浓度、菌液接种量、含水率和葡萄糖添加量)进行主成分分析(PCA)。使用SPSS 22.0软件进行。然后对四个主要因素的贡献率的比率进行加权求和,得到一个综合系数如下 [27]:
(2)
其中VE1和VE2分别代表因子1和因子2解释的方差。

Figure 4. Effects of different glucose dosing amounts on removal of hexavalent chromium by strain 4-1
图4. 不同葡萄糖投加量对菌株4-1去除六价铬的影响
在分析确定影响最大的因素后,利用Design Expert 8.0软件构建Cr(VI)去除率响应面模型,分析模型参数的显着性和相关性 [28]。为探索分离微嗜酸寡养单胞菌去除Cr(VI)的最佳条件,根据初步实验选择三个因素,然后使用Design-Expert 8.0软件设计实验组。所有实验一式三份进行。
在进行Kaiser-Meyer-Olkin (KMO)检验时,发现数据的KMO值为0.537,大于标准的0.500,表明该数据适合进行因子分析。表2(a)总结了因子贡献率结果。前两个因子的特征值分别为1.321和1.003,均大于1,前两个因子的特征值之和占总特征值的58.110%。因此,前两个因素被提取为主要因素。使用SPSS [表2(b)]获得因子1和因子2的分数。然后使用等式(2)获得综合因子。四个因素的得分表现出以下顺序:含水率 > 接种量 > 葡萄糖浓度 > Cr(VI)浓度。因此,选择了土壤含水率(A)、菌液接种量(B)和葡萄糖浓度(C)三个因素,实验设计的变量水平见表3。
在方差分析(ANOVA;表4)中,F值表示不同组中因子均方与同一组中因子均方的比值。模型的F值和P值分别为134.24和<0.0001,表明回归模型高度显着(P < 0.01)。失拟项的F值和P值分别为0.3424和0.7974,均不显着,表明该模型可用于优化土壤中六价铬的去除。通过方差分析,各因素对六价铬去除率的影响顺序为:接种量 > 葡萄糖浓度 > 含水率。

Table 2. Factor analysis of Cr (VI) removal rate: (a) total variance explained; (b) score and ranking
表2. Cr(VI)去除率的因素分析:(a) 总方差解释;(b) 得分和排名

Table 3. Levels of variables for experimental design
表3. 实验设计的变量水平

Table 4. ANOVA for response surface quadratic model
表4. 响应面二次模型的方差分析
如图5所示,Cr(VI)去除率受菌液接种量、葡萄糖浓度和土壤含水率的显着影响。以菌液接种量为例,Cr(VI)去除率随着菌液接种量的增加先上升后降低。使用Design Expert,确定在土壤含水率为28.6%、菌液接种量为4.53 mL以及葡萄糖添加量为5.97%时,可预计最佳Cr(VI)去除率为85.0%。
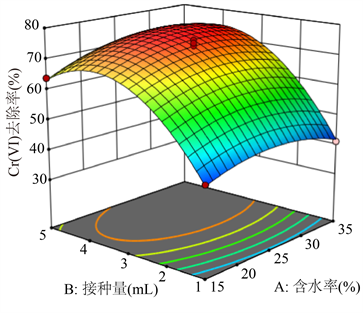
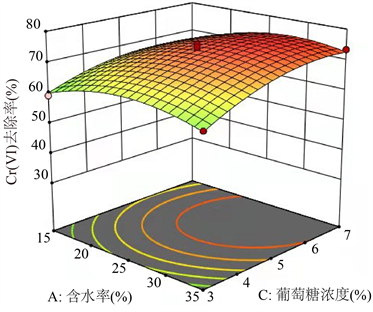
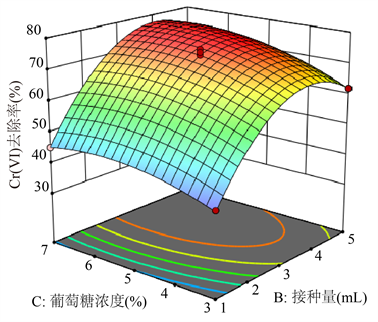
Figure 5. Response surface map of soil moisture content, bacterial solution inoculum and glucose concentration on the removal rate of hexavalent chromium in soil
图5. 土壤含水率、菌液接种量和葡萄糖浓度对土壤中六价铬去除率的响应面图
4. 结论
微嗜酸寡养单胞菌(Stenotrophomonas acidaminiphila) 4-1在模拟的受Cr(VI)污染的土壤中表现了卓越去除效率。通过对初始六价铬浓度、土壤含水率、菌液接种量和葡萄糖浓度进行单因素实验可知,四种影响因子对菌株4-1去除土壤中六价铬能力均有一定程度的影响。并利用主成分分析,对影响土壤中六价铬去除的四种因子进行排序,可知各因素对六价铬去除率的影响顺序为:含水率 > 接种量 > 葡萄糖浓度 > Cr(VI)浓度。根据响应曲面优化结果可知,在土壤含水率为28.6%、菌液接种量为4.53 mL以及葡萄糖添加量为5.97%时,最佳Cr(VI)去除率为85.0%。研究结果表明,微嗜酸寡养单胞菌4-1可作为生物修复铬污染土壤的高活性候选菌株。
基金项目
作者感谢山东省自然科学基金(ZR2019BD035);石油污染控制国家重点实验室开放课题(批准号:PPC2017020),中国石油安全与环境技术研究院;山东科技大学科研基金引进人才项目(批准号:2016RCJJ016)。
参考文献
NOTES
*通讯作者。