1. 引言
细菌感染是一个危害公共健康的严重问题,需要用抗生素治疗。然而,随着抗生素的滥用,细菌对它们的抵抗力逐渐增强,大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌等细菌已被证明具有抗生素耐药性 [1]。因此,科研工作者在研制开发新型有效的抗菌剂方面投入了大量的努力 [2] [3] [4]。
众所周知,纳米银对革兰氏阴性菌和革兰氏阳性菌都有很好的抗菌作用 [4] [5] [6]。然而,没有表面功能化或进行稳定性修饰的纳米银颗粒是热力学不稳定的结构,很容易聚集而导致失去活性 [7]。利用固体材料做基质稳定纳米粒子,以保护纳米银颗粒免于聚集已被证明是最常见和有效的策略之一 [8] [9]。在已报道的固体材料中,金属–有机框架(Metal-organic Frameworks, MOFs)由于其多孔结构,较大的比表面积,高的稳定性和可调节的结构而成为有潜力的纳米材料载体 [10]。ZIF-8是一种生物相容性好的MOFs材料,具有独特的孔结构,可以方便地进行药物的装载和控释,在生物医学领域得到广泛的关注 [11]。ZIF-8中的Zn2+是对人体健康有益的金属元素,构建ZIF-8的有机配体2-甲基咪唑也是很好的抑菌剂 [12]。此外,ZIF-8在中性条件下稳定,在强酸性环境下降解迅速,在弱酸性环境下缓慢降解。鉴于伤口感染部位的弱酸性环境,选择ZIF-8作载体,可以响应感染部位的pH值缓慢释放纳米银颗粒,实现在生物体内pH值响应性释放。透明质酸(HA)是一种天然的酸性多糖,具有良好的促进伤口愈合的功能 [13],此外,细菌能够分泌可以降解天然透明质酸的透明质酸裂解酶 [1]。在本研究中,我们合成了ZIF-8,负载纳米银颗粒,表面包覆透明质酸,组成复合纳米体系,研究其对革兰氏阳性菌耐甲氧西林金黄色葡萄球菌(MRSA)和革兰氏阴性菌耐万古霉素肠球菌(VRE)的杀伤效果,为新型抗菌剂的研究开发奠定基础。
2. 实验部分
2.1. 材料与仪器
材料:无水甲醇、无水乙醇、氯化钠、氢氧化钠,以上分析纯试剂购自天津市广成化学试剂有限公司;2-甲基咪唑、硝酸银、Zn(NO3)2∙6H2O、硼氢化钠、透明质酸(来自鸡冠),胰蛋白胨、酵母浸粉、琼脂,以上试剂购自阿拉丁试剂有限公司。实验用菌株:耐甲氧西林金黄色葡萄球菌(ATCC33591);耐万古霉素肠球菌(ATCC51575)购自中国普通微生物菌种保藏管理中心。
仪器:智能恒温培养振荡箱HNYC-21202C天津欧诺仪器股份有限公司;高压灭菌锅YXQ-75S11上海博讯实业有限公司医疗设备厂;超净台SW-CJ-2F苏州安泰空气技术有限公司;紫外分光光度仪UV755B上海佑科仪器仪表有限公司;高分辨场发射扫描电镜SU8010日本Hitachi;X射线衍射仪(XRD) D8 Advance达芬奇布鲁克;比表面及孔径分析测试仪ASAP2460麦克默瑞提克(上海)仪器有限公司;透射电子显微镜JEM-2100F日本电子。
2.2. AgNPs@ZIF-8@HA复合纳米粒子的构建
2.2.1. ZIF-8的合成
取0.33 g 2-甲基咪唑溶于7 ml甲醇,超声溶解备用,再取0.15 g ZnNO3∙6H2O溶于7 ml甲醇中。在磁力搅拌下,将2-甲基咪唑溶液缓慢滴加到ZnNO3溶液中,滴加完毕后常温搅拌24 h,反应完成后,离心收集固体,用适量甲醇洗涤三次,然后将所得沉淀在40℃的真空干燥箱中干燥6 h [14]。扫描电子显微镜(Scanning electron microscope, SEM)进行表面形貌观察,X-射线粉末衍射(X-ray power diffraction, PXRD)进行结构分析,低温氮气吸附实验考察合成的ZIF-8的比表面积和孔径分布。
2.2.2. AgNPs@ZIF-8的合成
取55 mg AgNO3,加入几滴去离子水使其溶解,而后加入8 ml甲醇,混匀后加入500 mg ZIF-8,常温搅拌2 h。取90 mg NaBH4溶于2.4 ml去离子水中备用,将制备好的NaBH4水溶液和搅拌好的ZIF-8、AgNO3混合溶液分别冰浴15分钟预冷。冰浴后,向ZIF-8、AgNO3混合溶液中缓慢滴加NaBH4水溶液,搅拌完毕后离心收集固体,用适量甲醇洗涤固体三次,然后将所得沉淀在40℃的真空干燥箱中干燥6 h,得到AgNPs@ZIF-8 [15],整个实验过程注意避光。扫描电子显微镜(SEM)进行表面形貌观察,X-射线粉末衍射(PXRD)进行结构分析,透射电子显微镜(Transmission electron microscope, TEM)观察材料中银纳米颗粒的负载情况。
2.2.3. AgNPs@ZIF-8@HA的合成
取60 mg AgNPs@ZIF-8,加入5 ml去离子水搅拌,静置1 h使其自然老化,另取11 mg透明质酸溶解于5.5 ml去离子水中。将透明质酸水溶液滴加到AgNPs@ZIF-8混合体系中,在暗处静置30 min使其自然老化,离心收集固体。将所得沉淀冷冻干燥,得到AgNPs@ZIF-8@HA,傅里叶红外光谱(Fourier transfer-infrared spectrometry, FTIR)对产物结构进行表征。
2.3. 抗菌实验
2.3.1. 细菌培养
取保藏的耐甲氧西林金黄色葡萄球菌和耐万古霉素肠球菌接种至LB培养基进行摇床培养,每天接种一次,连续接种7天后使其活化。取处于对数生长期的细菌培养液,8000 rpm,离心12 min,弃去上清,使用PBS冲洗细菌沉淀,冲洗完毕后再进行离心,共冲洗三次。将上述得到的细菌沉淀重新以PBS分散,使用紫外分光光度计测定菌液在600 nm处的吸光值,通过多次实验找出合适的吸光度值(以空白对照的菌密度合适为标准),将具有合适吸光度值的菌液转移至小瓶中备用。
2.3.2. 最低抑菌浓度(MIC)测定
采用微量肉汤稀释法进行MIC的测定。将AgNPs@ZIF-8@HA配制成512 μg/ml的储备母液备用。向无菌96孔板的第一孔加入100 μl抗菌药物,并向第二孔至第十孔加入50 μl培养基,从第一孔吸取50 μl药物溶液于第二孔充分混匀。再从第二孔吸取50 μl混合液于第三孔中,依次类推至第十孔,弃去吸取的50 μl混合液。此时各孔药物浓度依次为,512、256、128、64、32、16、8、4、2、1 μg/ml。每个药物浓度平行做三个孔。随后在一到十孔分别加入50 μl之前配好的菌液,使每孔最终药物浓度256、128、64、32、16、8、4、2、1、0.5 μg/ml,以不加药的细菌溶液作为对照,制备好的96孔板放进37℃培养箱中,培养18 h,取出,目视观察法读取结果。先观察对照孔细菌生长是否正常,与有细菌生长的孔相邻的没有出现细菌浑浊的孔对应的药物浓度为此抗菌药物对细菌的MIC值。
2.3.3. 平板计数
根据微量肉汤稀释法测出的MIC,设置96孔板中AgNPs@ZIF-8@HA的终浓度为20、40、60、80、160、1000、2000 μg/ml,将96孔板在37℃恒温摇床培养箱中培养18 h后,进行平板涂布实验。具体如下:将每个孔中的培养液稀释100倍,取50 μl倒入LB琼脂培养基中,进行涂布。涂布完成后倒置,置于37℃柜式恒温培养箱中培养18~24 h,观察平板上的单菌落数,根据实验组和对照组的实验结果作图,得到药物浓度与细菌存活率的关系图。
3. 结果与讨论
3.1. 材料结构表征
3.1.1. 扫描电镜
如图1(a)和图1(b)分别表示纳米粒子ZIF-8和AgNPs@ZIF-8的SEM图。从图中可以看出,ZIF-8的形貌是十二面体晶体结构。图1(b)中ZIF-8晶体中分布着大量的纳米银颗粒,AgNPs@ZIF-8的形貌与ZIF-8一致,原位还原反应负载银纳米颗粒,并没有改变ZIF-8的形貌。

Figure 1. SEM images of ZIF-8 (a) and AgNPs@ZIF-8 (b)
图1. ZIF-8 (a)和AgNPs@ZIF-8 (b)的SEM图
3.1.2. 透射电镜
如图2,AgNPs@ZIF-8的透射电子显微镜图(TEM)中ZIF-8晶体孔道及表面分布着衬度较深的粒径在几纳米到十几纳米的银颗粒,证实了银米颗粒成功负载到ZIF-8的孔道中。

Figure 2. TEM image of AgNPs@ZIF-8
图2. AgNPs@ZIF-8的TEM图
3.1.3. X-射线粉末衍射(PXRD)
如图3的X-射线粉末衍射图(PXRD)可以看出,合成的ZIF-8具有与模拟ZIF-8相同的特征峰位置,即2θ = 7.4˚,10.45˚,12.78˚,14.71˚,这也与文献报道的ZIF-8的PXRD数据相同 [16],说明合成ZIF-8结构正确,纯度较高。AgNPs@ZIF-8的PXRD图谱也具有模拟ZIF-8的特征峰位置,说明负载纳米银颗粒的过程并没有改变ZIF-8的结构。同时AgNPs@ZIF-8的PXRD图谱也具备纳米银的特征吸收峰,即在2θ = 38.2˚ (111),44.4˚ (200),64.7˚ (220),77.9˚ (310),这与文献报道纳米银的PXRD特征峰完全吻合 [17],说明了纳米银颗粒的成功负载。
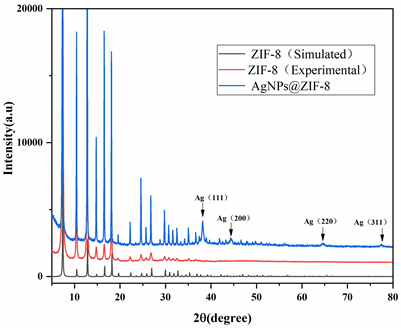
Figure 3. Powder X-ray diffraction patterns of ZIF-8 and AgNPs@ZIF-8
图3. ZIF-8和AgNPs@ZIF-8的粉末X射线衍射图
3.1.4. 吸附实验
为了证实ZIF-8的孔道结构,我们进行了低温氮气吸附实验,如图4(a)所示,根据曲线走向可知ZIF-8为I型吸附材料,根据BHJ算法,ZIF-8的吸附量约为137.6183 cm3/g,此外根据吸附实验的报告结果得知ZIF-8的BET表面积为343.3683 m2/g、Langmuir表面积为565.6491 m2/g。如图4(b)所示,ZIF-8晶体材料中存在着孔道结构,其孔道直径在3~4 Å。

Figure 4. The N2 adsorption isotherms (a) and the pore-size distributions (b) for ZIF-8
图4. ZIF-8的N2吸附等温线(a)和孔道大小分布(b)图
3.1.5. 红外光谱(IR)
透明质酸是一种高分子聚合物,是由单位D-葡萄糖醛酸及N-乙酰葡萄糖胺组成的高级多糖,特征官能团有羟基,羧基,酰胺。图5 AgNPs@ZIF-8@HA的红外光谱中,波长为3350 cm−1处有一宽峰,对应羟基吸收峰,波长为1590 cm−1处的吸收峰,对应酰胺中羰基吸收峰,波长为1410 cm−1处的中强峰,对应酰胺中C-N键的吸收峰。这证明了透明质酸已经成功包覆在AgNPs@ZIF-8纳米粒子的外围。

Figure 5. Infrared spectrum of AgNPs@ZIF-8@HA
图5. AgNPs@ZIF-8@HA的红外光谱图
3.2. 抗菌实验
根据微量肉汤稀释法的测定结果,AgNPs@ZIF-8@HA对耐甲氧西林金黄色葡萄球菌的MIC为80 μg/ml,AgNPs@ZIF-8@HA对耐万古霉素肠球菌的MIC为20 μg/ml。
如图6(a)所示为AgNPs@ZIF-8@HA对耐甲氧西林金黄色葡萄球菌的杀伤效果,图6(b)为AgNPs@ZIF-8@HA对耐万古霉素肠球菌的杀伤效果。AgNPs@ZIF-8@HA对革兰氏阳性耐药菌和革兰氏阴性耐药菌都有很好的杀伤效果,AgNPs@ZIF-8@HA对耐万古霉素肠球菌(VRE)更敏感。

Figure 6. Antibacterial performance of AgNPs@ZIF-8@HA against MRSA (a) and VRE (b)
图6. AgNPs@ZIF-8@HA对MRSA (a)和VRE (b)的抗菌效果图
4. 结果与讨论
本论文合成了基于金属–有机框架ZIF-8的复合纳米材料AgNPs@ZIF-8@HA。利用扫描电子显微镜(SEM)和X-射线粉末衍射(PXRD)确证了ZIF-8的结构,利用低温氮气吸附实验证实了ZIF-8中存在孔道结构,并具有较大的比表面积。ZIF-8的孔道结构和较大的比表面积使其成为固定纳米银颗粒的良好载体,可以将纳米银颗粒负载到其孔道结构中,也可以利用纳米材料的表面吸附作用将纳米银颗粒吸附到其表面。透射电子显微镜(TEM)和X-射线粉末衍射(PXRD)分析证明纳米银颗粒的成功负载,从AgNPs@ZIF-8的SEM图中,可以看到吸附在ZIF-8表面的纳米银颗粒,从TEM中可以看到,部分纳米银颗粒负载到ZIF-8的孔道中。傅里叶变换红外光谱(FTIR)证明了透明质酸的成功负载。微量肉汤稀释法和“平板涂布观察”研究AgNPs@ZIF-8@HA对革兰氏阳性耐药菌耐甲氧西林金黄色葡萄球菌和革兰氏阴性耐药菌耐万古霉素肠球菌(VRE)的体外抗菌活性。结果表明,AgNPs@ZIF-8@HA对两种耐药菌都有很好的杀伤效果,且AgNPs@ZIF-8@HA对耐万古霉素肠球菌更敏感。
杀菌剂的杀菌机理很重要,本文中合成的AgNPs@ZIF-8@HA的杀菌机理推测如下:1) 细菌生长分泌透明质酸裂解酶降解了AgNPs@ZIF-8@HA表面的透明质酸,使大量的AgNPs@ZIF-8富集在细菌的表面。2) 细菌周围的弱酸性环境使ZIF-8缓慢降解,释放出负载的纳米银颗粒。3) 释放出的纳米银颗粒被氧化为有杀菌活性的Ag+。要证明这个推测的机理,需要进一步测定AgNPs@ZIF-8@HA与细菌在孵育过程中溶液中Ag+的浓度变化。本论文的研究工作为新型耐药菌杀菌剂的研究奠定了基础,AgNPs@ZIF-8@HA对两种耐药菌感染小鼠的体内实验正在进行中。
基金项目
山东省省级大学生创新创业训练项目(S202010451057)。
NOTES
*通讯作者。