1. 引言
《国家中长期教育改革和发展规划纲要(2010~2020年)》提出,要把提高教学质量作为教育改革发展的核心任务,提升学生的学习能力、实践能力和创新能力,培养高素质应用型卓越技术人才 [1] 。
化学是一门以实验为基础的科学。随着科学技术和实验教学的不断发展,化学实验课程的教学任务已不仅仅局限于让学生进行化学基础知识和理论的单纯验证,而更应该让学生通过实践重现知识的创造过程,培养其科学思维、创新意识和创新能力 [2] [3] [4] 。将科研项目向本科综合化学实验进行转移和固化,是促进科教融合,培养学生科学素养和科研创新能力的重要途径 [5] 。
该模式可丰富实验教学内容 [6] ,拓宽学生的知识面,帮助学生了解科学前沿热点,树立基本科研意识,激发科研兴趣,培养综合素质和创新能力 [7] 。此外,依靠科研成果来设计综合性实验,有利于整合教学和科研资源,形成科研教学协同支持、共促发展的良好局面,对专业实验教学体系的构建和完善有重要意义 [8] 。
电化学是本科物理化学基础知识中很重要的一部分,但该部分内容理论性强,较为抽象,学生的课堂学习兴趣不高 [9] 。本综合实验首先制备得到MnS-氮硫掺杂碳复合纳米材料,并用于锂离子电池,进行电化学性能的研究。该设计将无机纳米材料与物化电化学相结合,通过材料制备及表征、锂离子电池组装及性能测试、数据分析及结果讨论等环节,加深学生对电化学基础知识的理解,掌握现代电化学分析方法,锻炼学生的实验操作技能、综合分析及科研创新能力,实现自主化、创造性发展人才的培养目标,符合新工科人才的培养要求 [10] 。同时,以社会需求为导向,对接粤西地区新能源材料产业,着力培养基础扎实、素质过硬、竞争力强的复合型专业人才。
2. 实验目的
1) 培养学生文献检索,实验操作,结果分析、报告撰写等方面的综合实验能力。
2) 了解MnS/氮硫共掺杂碳复合材料的研究进展及制备方法。
3) 了解X射线粉末衍射仪、光电子能谱仪、扫描电镜等大型仪器的原理及操作。
4) 学习锂离子扣式电池的组装、电化学性能测试及评价标准。
3. 实验原理
硫化锰作为一种半导体材料,以较大比容量、低成本,环境友好、储量丰富等优点,成为极具竞争力的锂离子基质材料。但由于反复充放电过程中不可避免的体积变化和严重的颗粒聚集,导致材料易粉碎,循环稳定性差等问题,阻碍了MnS在锂离子电池中的实际应用。
六亚甲基四胺(HMTA)是一种典型的N-给体配体,呈四面体分子结构,顶点有四个氮原子,能够接受各种配位模式,形成金属-HMTA配位框架 [11] 的拓扑结构。利用HMTA制备氮掺杂碳材料,可以调整碳的电子结构,提高其导电性和化学活性,从而提高电化学性能 [12] [13] 。
实验采用Mn(II)离子与HMTA反应,形成二维Mn-HMTA配位骨架。经高温煅烧和硫化,进一步转变为含氮和硫掺杂的二维碳基质材料,同时Mn (II)离子被原位硫化为MnS纳米颗粒,并锚定在碳片上,最终形成MnS-NSC复合材料。该方法可将MnS纳米颗粒分散固定于氮硫共掺杂碳片上,从而有效地抑制颗粒的聚集和体积膨胀,提高电子导电率,增强材料的电化学储锂性能。MnS-NSC复合材料的制备流程如图1所示。
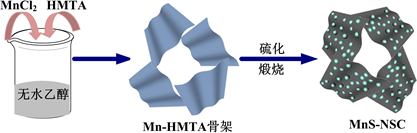
Figure 1. Scheme of sythetical strategy of the as-prepared MnS-NSC
图1. MnS-NSC制备工艺流程图
4. 实验仪器与试剂
4.1. 实验仪器
X射线粉末衍射仪(XRD, Rigaku Smartlab SE)、比表面积测定仪(BET,Micromeritics Gemini VII 2390,美国Microtrac)、热重分析仪(TGA, Thermo Plus EVO TG-DTA,德国PerkinElmer)、扫描电子显微镜(SEM,Quanta 3D FEG,美国Fei)、X射线光电子能谱仪(XPS, Quantera IIPHI Quantera II,美国Thermo)、冷冻干燥机(FD-1A-50,北京博医康)、管式炉(SK-G06123K,天津中环)、电化学工作站(CHI 660D,上海辰华)、充放电仪(CT-2001A,LAND)。
4.2. 实验试剂
氯化锰、六亚甲基四胺、硫脲、无水乙醇(以上均为分析纯,阿拉丁)、聚丙烯隔膜(Celgard 2400)、1 mol·L−1六氟磷酸锂(LiPF6)与碳酸乙烯酯/碳酸二乙酯的(EC/DMC)混合溶液(电池级,苏州多多化学科技有限公司)、导电炭黑(super P)、聚丙烯酸粘结剂(AR,沪试)。
5. 实验安排
该综合实验总学时为16学时,以20人左右小班模式开展,2~3人为一个小组。具体学时安排如下:
1) 实验开始前的集中讲解(包含研究背景、材料制备及电化学测试过程及注意事项、实验报告撰写要求) 2学时;
2) MnS-NSC复合材料的制备过程4学时;
3) 大型表征仪器的原理、操作介绍及材料的表征4学时;
4) 电极材料制备、手套箱使用及锂离子电池组装2学时;
5) 电化学性能测试4学时。
背景调研和报告的撰写要求学生在课后自行完成。
6. 实验部分
6.1. MnS-NSC复合材料的制备
将6 mmol氯化锰溶于50 mL无水乙醇中,得到溶液A。将6 mmol六亚甲基四胺溶于100 mL无水乙醇中,得到溶液B。在不断搅拌下,将溶液A逐滴加至溶液B中,逐渐析出白色胶体Mn-HMTA配位骨架。继续搅拌6 h后,用无水乙醇洗涤三次,离心分离得到Mn-HMTA配位框架。将真空干燥后的Mn-HMTA和硫脲分别置于管式炉内的瓷舟中,Mn-HMTA位于硫脲的下游,氩气气氛下600℃煅烧、硫化2 h,得到最终产物MnS-NSC。为进行对比,同时将氯化锰和硫脲于600℃下烧结2 h,得到纯MnS样品。
6.2. 锂离子电池性能测试
6.2.1. 工作电极的制备
以MnS或MnS-NSC为电活性材料,聚丙烯酸为粘结剂,碳黑为导电剂,按70:15:15的质量比在蒸馏水中进行分散,不断搅拌,得到混合均匀的浆体。将浆体均匀涂布在泡沫铜上,真空干燥后得到活性物质MnS涂载量为1.2 mg·cm−2的工作电极。
6.2.2. 电池的组装
采用CR2025型扣式电池进行电化学测试,电池的组装在充满氩气的手套箱中进行:以制备的含MnS/MnS-NSC样品的电极片为工作电极,金属Li片为对电极,1 M LiPF6的EC:DEC混合溶液(体积比为1:1)为电解液,聚丙烯薄膜Celgard 2400为隔膜,按照顺序依次进行电池的组装。
6.2.3. 电化学测试
利用蓝电电池测试系统(CT-2001A)进行充放电测试,充放电截止电压分别为3.0 V和0.005 V。利用辰华电化学工作站,在0.0 V~3.0 V扫描范围内,以不同的扫描速度,进行循环伏安(CV)测试。利用Zennium电化学工作站测试电池的阻抗,频率范围200 kHz~0.01 Hz,幅值5.0 mV。
7. 实验结果与讨论
7.1. 结构与形貌
图2为MnS和MnS-NSC的X射线粉末衍射图。两样品衍射峰相似,均对应于标准卡片(JCPDS 06-0518),样品纯度高,无明显杂质峰。与MnS样品相比,MnS-NSC衍射峰强度变弱,可能是由于碳材料抑制了金属硫化物的晶体生长。
图3为MnS-NSC的X射线光电子能谱图。图3(a)中Mn的2p谱由三个峰组成。Mn-2p3/2和Mn-2p1/2峰分别位于641.5 eV和653.3 eV处,645.3 eV处峰表明存在C-S-Mn键。图3(b)中S-2p谱由位于160.6、161.7、163.3、164.4和167.9 eV处的五个峰组成,前4个峰分别对应于Mn-S、S-2p3/2、S-2p1/2和C-S-C/-C=S-键,表明MnS的存在和硫掺杂进碳骨架中。167.9 eV处峰可能与被氧化的硫有关。图3(c)中C-1s谱由位于284.1、284.6、285.2和286.2 eV处的四个峰组成,分别代表C-C、C-N、C-S和C=O键的结合能,表明氮和硫已掺杂至碳晶格中。图3(d)中N-1s谱由398.0、398.7和4001 eV三个峰拟合而成,分别对应吡啶-N、吡咯-N和石墨-N。石墨-N可提高导电性,吡啶-N和吡咯-N可为Li+的插入/脱嵌提供更多的活性位点,从而提高电化学性能。
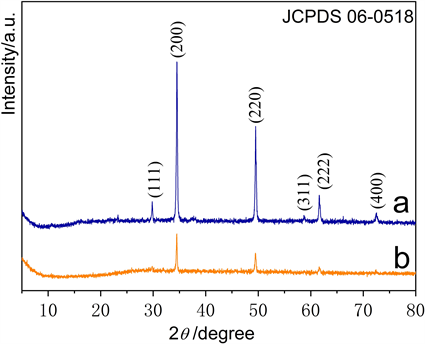
Figure 2. XRD diagram of (a) Pure MnS; (b) MnS-NSC
图2. XRD图谱;(a) MnS;(b) MnS-NSC
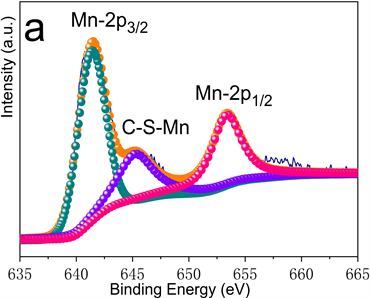
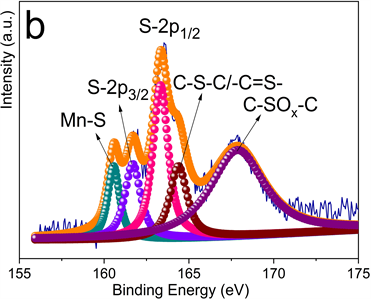
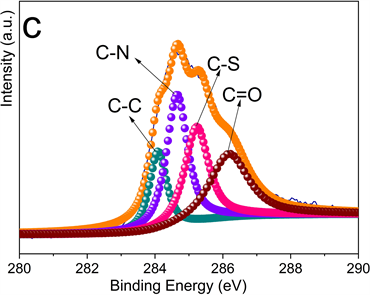
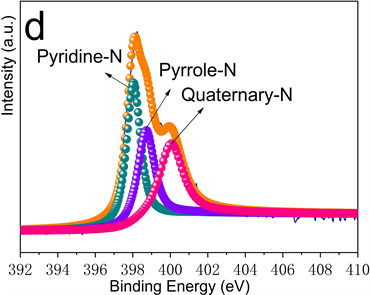
Figure 3. High-resolution XPS diagram of MnS-NSC (a) Mn-2p; (b) S-2p; (c) C-1s; (d) N-1s
图3. MnS-NSC高分辨XPS图谱(a) Mn-2p;(b) S-2p;(c) C-1s;(d) N-1s

Figure 4. SEM images of (a) pure MnS; (b) Mn-HMTA precursor; (c)~(e) MnS-NSC; Primary element mapping images of MnS-NSC: (f) C; (g) N; (h) Mn; (i) S. The scale bar is 2 µm
图4. SEM谱图(a) MnS;(b) Mn-HMTA前驱物;(c)~(e) MnS-NSC;MnS-NSC元素分布图;(f) C;(g) N;(h) Mn;(i) S,比例尺:2 µm
图4(a)和图4(b)是MnS和Mn-HMTA前驱物的SEM图。图4(a)中MnS样品为不规则颗粒,呈聚集分布。图4(b)中Mn-HMTA前驱物呈二维片状结构。经退火和硫化后,得到MnS-NSC复合材料,二维片状结构基本不变,如图4(c)。图4(d)和图4(e)中MnS颗粒嵌在碳薄片上,尺寸约40 nm。图4(f)~(i)元素分布图进一步证实MnS与氮、硫掺杂碳结合良好,MnS-NSC复合材料中各元素C (浅蓝色)、N (黄色)、Mn (红色)、S (绿色)呈均匀分布。
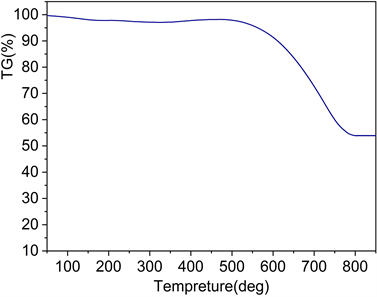
Figure 5. Thermogravimetric profile of MnS-NSC
图5. MnS-NSC热重曲线图
图5为MnS-NSC的热重曲线。由于水的汽化,样品在200℃以下时有少量失重。500℃~800℃出现明显的质量损失,主要归因为MnS氧化生成Mn2O3和碳完全氧化。



Figure 6. Isothermal nitrogen adsorption (orange)/desorption (blue) curves of (a) MnS and (b) MnS-NSC; (c) Size distribution of mesopores
图6. 氮气吸附/脱附等温线 (a) MnS;(b) MnS-NSC;(c) MnS-NSC孔径分布图
图6(a)和图6(b)是MnS和MnS-NSC复合材料的氮气吸附/脱附等温线。图6(a)中MnS呈II型等温线,未发现明显的滞后环,表明纯MnS的孔隙结构较少。图6(b)中MnS-NSC呈IV型等温线,在相对压力(P/P0) 0.6~1.0范围内出现明显滞后环,表明材料具有介孔结构。这是由MnS-NSC制备过程中,碳材料中配位骨架的裂解生成介孔引起。采用BET法求得MnS和MnS-NSC的比表面积分别为4.83和32.09 m2·g−1。图6(c)是MnS-NSC孔径分布图,主要孔径集中在2.55和3.85 nm。与MnS相比,MnS-NSC具有大的比表面积和丰富的介孔结构,可为Li+存储提供更多活性位点,有利于缓解体积变化,促进电解液渗透,从而提高电化学性能。
7.2. 电化学性能测试
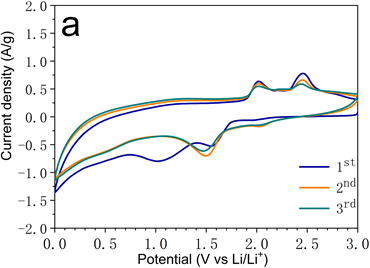
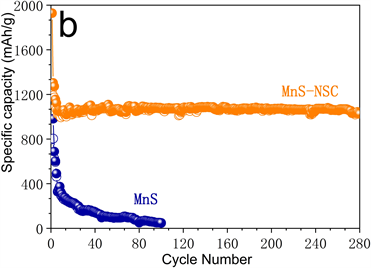
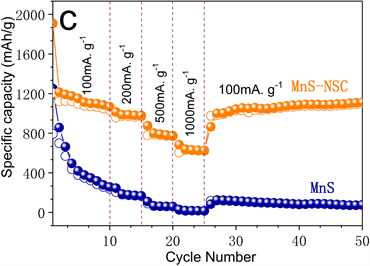
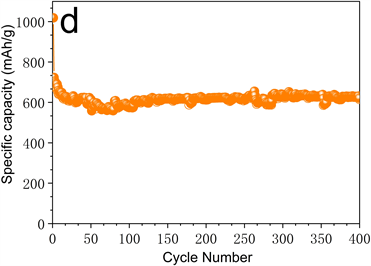
Figure 7. (a) The first three cycles of cyclic voltammetry under a sweeping rate of 0.5 mV·s−1; (b) Durable cycling measurement at 100 mA·g−1; (c) High-rate performance test; (d) Durable cycling test at 1000 mA·g−1 of MnS-NSC electrode
图7. (a) 0.5 mV·s−1扫描速率下MnS-NSC电极循环伏安曲线;(b) 100 mA·g−1下长时间充放电循环测试;(c) 倍率性能测试;(d) 1000 mA·g−1下MnS-NSC循环耐久性测试
采用循环伏安法考察MnS-NSC电极的电化学储锂过程。图7(a)中第一次阴极扫描在1.02 V和1.55 V有两个还原峰。1.55 V处还原峰与Li+嵌入MnS生成LixMnS有关,1.02 V处还原峰与LixMnS分解生成Mn和Li2S以及电解液分解形成固态电解质界面膜有关。第一次阳极扫描在2.02和2.45 V处有两个氧化峰。2.02 V氧化峰与Mn与Li2S生成LixMnS有关,2.45 V氧化峰与LixMnS生成Li+和MnS有关。几乎相同的CV曲线表明过程具有良好的可逆性。
图7(b)为长时间充放电循环测试。初始循环中MnS-NSC电极放电容量可达1928.7和1238.2 mAh·g−1,首次库仑效率(CE)约64.2%。随循环次数增加,CE值迅速上升到95%以上,无明显容量衰减。经过280次循环后,放电容量仍达1025.1 mAh·g−1。MnS电极循环性能较差,经100次循环后,MnS电极容量仅为46.6 mAh·g−1,容量下降严重。
图7(c) MnS和MnS-NSC电极倍率性能结果显示,当电流密度为200、500、1000 mA·g−1时,MnS-NSC
电极的充电容量分别为967.6、777.2和621.7 mAh·g−1。当电流密度恢复到100 mA·g−1时,可逆容量可恢复到较高水平。同等条件下,MnS充电容量较低。
图7(d)循环耐久性实验表明,1000 mA·g−1下经历400个循环后,MnS-NSC电极仍可达到615.0 mAh·g−1的放电容量,循环耐久性良好。
通过研究电极反应动力学,可进一步研究MnS-NSC的储锂性能。图8(a)和图8(b)为历经20次循环后不同扫速下的CV曲线。
(1)
公式(1)可用来描述峰值电流(i)和扫描速率(v)之间的关系。其中,logi与logv呈线性相关,b是直线的斜率,b的数值取决于各种电化学过程。对于扩散控制的电化学过程,b值约0.5。当表面电容行为起主导作用时,b值约1.0。由直线的斜率计算MnS和MnS-NSC电极的b值分别接近0.5和1.0,表明其电化学过程分别受扩散过程控制和电容行为控制。
(2)
公式(2)可用于计算电容行为贡献的比例。在固定电位下,k1和k2为固定值,k1v的值代表由电容行为控制的电化学过程引起的电流。图8(e)和图8(f)的柱状图列出了在不同扫描速率下,MnS和MnS-NSC的电容行为所引起的电流贡献率。MnS-NSC电极由于具有开放的平面结构,丰富的中孔和更大的比表面积,因而表现出更高的电容贡献比例。

Figure 9. (a) Circuit model and electrochemical impedance spectra of MnS and MnS-NSC; (b) Calculation of σ from the line correlating Zreal vs ω−1/2
图9. (a) MnS和MnS-NSC等效电路模型和电化学阻抗谱;(b) 通过Zreal与ω−1/2线性关系计算σ
实验通过电化学交流阻抗谱图进一步揭示MnS-NSC的反应动力学过程。图9(a)是MnS和MnS-NSC的电化学交流阻抗谱(奈奎斯特图)和等效电路模型。在等效电路模型中,元件Re代表电池的内阻,Rf和Rct分别代表固态电解质界面膜(SEI)电阻和电荷转移电阻。CPE1和CPE2分别代表SEI膜的恒相位角。通过电路模拟,MnS-NSC的Rf和Rct值分别为30.13和37.59 Ω,小于MnS电极的Rf = 47.86 Ω,Rct = 153.05 Ω。这是由于复合材料中MnS与导电碳网络的紧密接触极大地提高了复合材料的导电性,加速了电极反应中电子的传递,减小了阻抗。奈奎斯特图低频范围有一条斜线,表示扩散阻抗(Ws阻抗),斜率越大意味着离子扩散速度越快。可以看出MnS-NSC斜率明显大于MnS,表明MnS-NSC具有较快的离子迁移速度。
扩散系数(DLi+)可评价锂离子在电极中扩散速度,与系数σ有关。DLi+与系数σ的平方(σ2)呈反比。将Zreal对ω−1/2做图可得一直线,由直线斜率可以得到σ。其中ω为交流电流的频率,Zreal为阻抗的实部,经计算得到MnS和MnS-NSC电极的σ值,如图9(b)所示。据此计算,MnS-NSC电极扩散系数DLi+约为MnS电极的2.82倍,具有更快的离子扩散速度。
8. 教学难点与重点
相较于毕业论文设计等大型实验,综合实验容易存在学时较短,时间相对不足,实验安排过于紧凑,使实验不断被压缩、不成体系的情况。本课程设计已尽可能保留相对完整的实验体系,涵盖样品制备、测试表征、电池组装及电化学性能测试过程,体系完整,整体性强。此外,电极的制备及组装过程需要多次反复练习,失败率较高。因此,在实验的前期准备及实验进行中,要有针对性地对学生加强引导,使学生提前对各环节的操作要点及注意事项进行思考、归纳,以及应如何操作能最大程度地降低实验失败的概率。在为学生进行示范演示时,可让学生录制相关操作视频,以备复习巩固。同时,每组学生应根据本组的实际情况,合理安排分工,使实验效率、成功率更高。此外,结合实验结果,可引导学生进一步思考影响锂离子电池性能和大规模使用的因素有哪些,以及除了锰基材料,还有哪些常见的材料可用作锂离子电池负极材料。
9. 教学成效
自该课题被作为综合实验引入教学中后,取得了不错的成效。由于实验设计组装的锂离子电池与日常生活贴近,学生的学习兴趣浓厚,态度积极。此外,在进行锂离子电池组装演示操作以及利用仪器进行表征、测试时,由于学生此前较少接触,求知欲强,能积极主动进行实验的预习及准备工作,学习自觉性、主动性大大提升。同时,由于是小组实验,学生集思广益,合理安排组内分工,取长补短,团队意识和协作能力也得到提升。目前,已有数位学生通过综合实验,进而后续进行毕业论文设计相关课题,同时在老师指导下参与大创项目及竞赛,并在SCI上发表相关论文数篇,培养了学生的科研、创新及综合能力。该课题以生活中随处可见的锂电池为研究对象,使科学研究与日常更为贴近。应用于教学中时,让学生对科研的应用有具体的实感,更容易产生兴趣和共鸣。此外,通过该综合实验的开展,学生可对新能源领域有基本的了解,对以后的择业、就业也具有一定的帮助。
10. 结论
该综合化学实验以锰基配合物为模板和前驱体,通过简单的煅烧、硫化过程合成了二维MnS-NSC复合材料。该复合材料由紧密负载在氮、硫共掺杂碳片上的MnS纳米颗粒组成,具有稳定的二维导电结构和大比表面积。以MnS-NSC电极为锂离子电池负极,展现出高可逆容量、循环持久性和高倍率性能。本实验从电化学基本概念、原理出发,在实验操作中进一步加深对本专业知识的理解。从前期查阅文献,中期材料合成、结构表征及性能测试和后期结果分析、数据处理和报告撰写等多个环节,对学生的自主学习能力、独立科研能力、创新思维能力进行培养,提升科学素养,培养学生的综合能力。
基金项目
广东省高校重点学科项目(2019-GDXK-0024)。