1. 引言
魔芋为天南星科多年生的块茎草本植物 [1] [2] ,广泛分布于陕西、甘肃、四川、云南、贵州、宁夏至江南等地 [3] 。魔芋多糖是魔芋最重要的活性成分,含量高达55%~80% [4] ,具有减肥、抗病毒、降低血糖 [5] 、降血压 [6] [7] 等功效,可以治疗习惯性便秘,防治肠癌、食道癌 [8] 。但血液的高甘油三脂对高血糖有明显抑制作用 [9] ,在食品工业领域、生物医学领域具有广泛的应用前景 [10] 。
目前常用的多糖提取的方法包括微波辅助提取法、水提醇沉法、超临界流体萃取法、索氏抽提法、酶辅助提取法、酸提取法、碱提取法、超声波辅助提取法等 [11] [12] [13] [14] [15] 。其中,超声波辅助提取法具有安全性好、操作简便、提取率高、节省时间、能耗低等优点 [16] [17] [18] 。因此,本研究以魔芋为原料,通过超声波辅助提取魔芋中多糖,将料液比、超声功率、温度、超声处理时间作为4个考察因素,然后利用正交试验优化魔芋多糖的提取工艺,在此条件下得到最适宜的提取工艺条件,为魔芋多糖的开发利用提供理论依据。
2. 实验部分
2.1. 仪器与试剂
DK-98-IIA型电热恒温水浴锅(天津市泰斯特仪器有限公司);SHB-III型循环水式多用真空泵(郑州长城科工贸有限公司);FA1104型电子天平(上海精科);T6新世纪型紫外可见分光光度计(北京谱析通用仪器有限责任公司);KQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司)。
魔芋粉由丹凤县凯农魔芋精粉有限公司提供。苯酚、浓硫酸、D-无水葡萄糖均为分析纯。
2.2. 实验方法
2.2.1. 魔芋多糖的提取
通过超声波辅助水提法提取魔芋总多糖,把魔芋粉放入水中搅拌均匀,引入超声波辅助提取,经过超声后所得到的溶液进行抽滤除杂,然后将所得的水溶液进行浓缩,浓缩到原体积的1/2,将浓缩液放到100 mL的容量瓶中定容,即得到魔芋总多糖的提取液 [19] 。
2.2.2. 葡萄糖标准曲线的绘制
精密称取105℃下干燥至恒重的葡萄糖对照品10 mg置于100 mL容量瓶中,用蒸馏水定容至容量瓶刻度处,得到葡萄糖对照品溶液(0.1 mg/mL)。各精密移取0、0.1、0.2、0.4、0.6、0.8、1.0 mL葡萄糖对照品溶液到25 mL具塞试管中,随后添加蒸馏水,使其每个试管都补足至2 mL,加1 mL 5%苯酚溶液,将其在旋涡混合器上混匀,小心加入10 mL浓硫酸,在旋涡混合器上小心混匀,然后放入水浴锅中,在沸水中停留2 min,随后拿出来冷却到室温,用紫外分光光度计在490 nm处测吸光度,并制备空白对照。绘制葡萄糖标准曲线,以葡萄糖浓度为横坐标,吸光度值为纵坐标。
2.2.3. 魔芋多糖提取率的计算
(1)
式中:C——魔芋总多糖的质量浓度,mg/mL;N——稀释倍数;V——魔芋总多糖提取液定容的体积,mL;M——魔芋干粉的质量,g。
2.2.4. 单因素试验
采用超声波辅助提取魔芋多糖的工艺方法,以料液比(1:200、1:250、1:300、1:350、1:400 g/mL)、超声温度(30℃、35℃、40℃、45℃、50℃)、超声时间(1、1.5、2、2.5、3、3.5 h)、超声功率(20 W、40 W、60 W、80 W、100 W)作为单因素,把魔芋多糖提取率作为评价指标,进行魔芋多糖提取的单因素试验。
2.3. 方法学考察
2.3.1. 精密度试验
精密移取1 mL葡萄糖对照品溶液到25 mL具塞试管中,随后添加蒸馏水,将所移取的葡萄糖对照品溶液补充到2 mL,并加1 mL 5%苯酚溶液,振摇,随后加入10 mL浓硫酸,振摇,缓慢冷却至室温,于490 nm处测吸光度,同时制备空白对照。平行测定6次,计算其RSD值。
2.3.2. 稳定性试验
精密称取魔芋粉末1 g,按照最佳工艺提取,得到魔芋多糖的待测液,用移液管移取2 mL于50 mL容量瓶中加蒸馏水定容,然后吸取容量瓶溶液2 mL,将其放到25 mL具塞试管中,并加入1 mL 5%苯酚溶液、浓硫酸10 mL,摇匀,静置冷却至室温。空白溶液为2 mL蒸馏水、1 mL 5%苯酚溶液与10 mL浓硫酸的混合溶液,显色完成后立即测定吸光值,并分别在0、30、60、90、120、150 min测定吸光度,计算其RSD值。
2.3.3. 重复性试验
精密取称魔芋干燥粉末1 g,6份,精密称定,按照最佳工艺提取,得到魔芋多糖的待测液,用移液管各移取魔芋多糖的待测液2 mL于6个50 mL容量瓶中加蒸馏水定容,然后分别吸取容量瓶溶液2 mL,放到25 mL具塞试管中,各加入1 mL 5%苯酚溶液、浓硫酸10 mL,摇匀,静置冷却至室温。空白溶液为2 mL蒸馏水、1 mL 5%苯酚溶液与10 mL浓硫酸的混合溶液,显色完成后立即测定吸光值,计算其RSD值。
2.3.4. 加样回收率
精密称取已知含量的魔芋干燥粉末1 g,共6份,按照最佳工艺提取,得到魔芋粉多糖待测液,取该待测液1 mL于具塞试管中,再加入0.1 mg/mL葡萄糖标准液1 mL,加入5%苯酚溶液1 mL、浓硫酸10 mL,摇匀,静置冷却至室温。空白溶液为2 mL蒸馏水、1 mL 5%苯酚溶液与10 mL浓硫酸的混合溶液,显色完成后立即测定吸光值,计算平均加样回收率和RSD值。
3. 结果与讨论
3.1. 葡萄糖标准曲线
线性回归方程为:y = 4.7593x − 0.0007,R2 = 0.9998,式中:x为葡萄糖的浓度,mg/mL;y为吸光度,A;如图1所示。
结果表明,葡萄糖在线性范围在0~0.12 (mg/mL)的浓度内与吸光度有良好的线性关系。
3.2. 单因素试验结果
3.2.1. 料液比对总多糖提取效果的影响
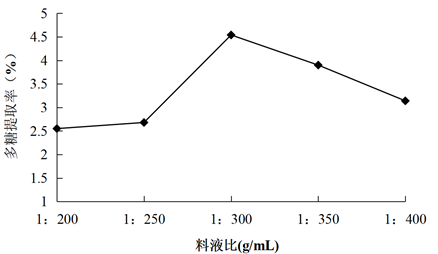
Figure 2. Effect of material liquid ratio on the extraction rate of total polysaccharides from konjac
图2. 料液比对魔芋总多糖提取率的影响
由图2中可知,料液比在1:200 (g/mL)~1:400 (g/mL)之间,随着料液比的增加,魔芋多糖的提取率也在增加,但料液比在1:300 (g/mL)时,魔芋多糖提取率最高,随后魔芋多糖的提取率呈下降趋势。其原因是随着料液比的增大,溶剂用量也会随之增加,魔芋多糖的浸出率也会增大,但当溶剂用量增加到一定值时,溶剂把超声波辐射大量吸收,从而溶剂溶解杂质也增多,以至于不能完全作用于样品。因此,选取料液比1:250、1:300、1:350 (g/mL)进行正交试验。
3.2.2. 提取温度对总多糖提取效果的影响
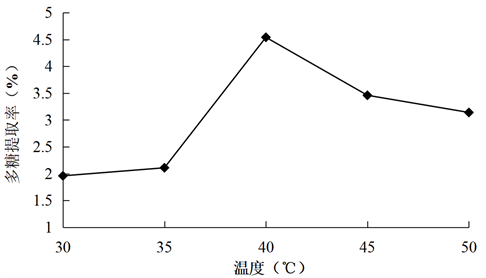
Figure 3. Effect of temperature on the extraction rate of total polysaccharides from konjac
图3. 温度对魔芋总多糖提取率的影响
由图3所示,随着温度的增大,魔芋多糖的提取率在逐渐增大,温度为40℃时,魔芋多糖提取率达到最大值。但当超过40℃时,随着温度的持续升高,魔芋多糖提取率也随之下降,其主要原因是随着温度的升高,分子的运动速度加快,魔芋多糖会很容易从细胞中转移到溶质中,但是温度过高,会把一部分多糖化合物很容易的氧化破坏,以至于产生杂质,不利于后期的分离。所以,选取35℃、40℃、45℃进行正交试验。
3.2.3. 超声处理时间对总多糖提取效果的影响
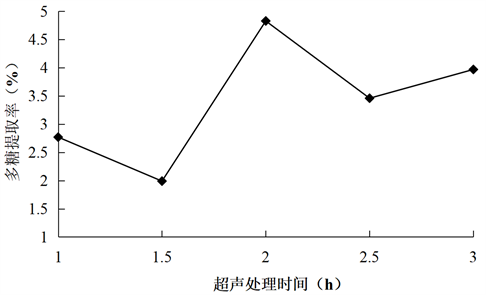
Figure 4. Effect of ultrasound treatment time on the extraction rate of total polysaccharides from konjac
图4. 超声处理时间对魔芋总多糖提取率的影响
由图4可知,随着超声处理时间的增长,魔芋多糖提取率在2 h的时候达到最大值,但超声处理时间超过2 h时,魔芋多糖的提取率明显下降,可能是因为时间过长,破坏了魔芋多糖的结构。所以,选取1.5 h、2 h、2.5 h进行正交试验。
3.2.4. 超声功率对总多糖提取效果的影响
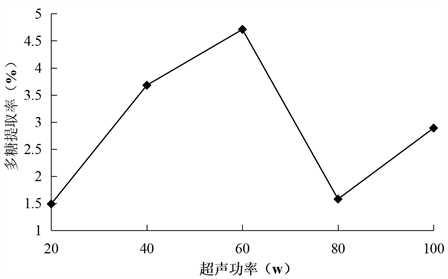
Figure 5. Effect of ultrasound power on the extraction rate of total polysaccharides from konjac
图5. 超声功率对魔芋总多糖提取率的影响
由图5可知,随着超声功率的增加,魔芋总多糖的提取率先升高后下降,在60 W的时候达到最大值,当超声功率继续增加时,魔芋多糖提取率出现下降的趋势。其主要原因是魔芋细胞的破壁程度逐渐增加,使魔芋中多糖溶出增多而使提取率升高,但当超声功率超过60 W的时候,由于超声功率的持续增大,超声波的破碎效应也在逐渐增大,会使魔芋中大量的杂质浸出,从而导致多糖的提取率下降。所以,选40 W、60 W、80 W进行正交试验。
3.3. 正交试验
选择料液比(A)、温度(B)、超声时间(C)、超声功率(D)作为正交试验的4个因素,每个因素设计考察3个水平,研究其对魔芋中多糖提取率的影响,设计L9(34)正交试验因素水平表,试验中魔芋多糖因素水平选取见表1,试验设计结果如表2所示。

Table 1. Orthogonal design factor level table
表1. 正交设计因素水平表

Table 2. Results of orthogonal experiment
表2. 正交试验结果
通过表1和表2中的魔芋多糖正交试验结果可知,各因素对魔芋多糖提取率影响的主次顺序为:A > D > B > C,最佳的提取工艺参数是A3B3C2D2,魔芋多糖提取率最佳条件是料液比1:350 (g/mL),温度45℃,超声时间2 h,超声功率60 W。
3.4. 验证试验
为验证正交试验结果,料液比1:350 (g/mL),温度45℃,超声时间为2 h,超声功率为60 W。精密称取1 g魔芋粉在魔芋多糖提取适宜工艺条件下进行试验,重复测3次,试验结果如表3所示。

Table 3. Results of confirmatory tests
表3. 验证性试验结果
由表3可知,魔芋多糖提取率求其平均值为4.79%,RSD值为0.77%,表示该超声辅助提取魔芋多糖的工艺参数准确可靠,结果重现性较好。
3.5. 方法学考察
由表4可知:精密度试验:RSD = 1.22% (n = 6),说明仪器的精密度良好。
稳定性试验:RSD = 1.78% (n = 6),说明魔芋多糖样品溶液中的多糖在150 min内稳定性良好。
重复性试验:RSD = 1.62% (n = 6),说明该方法重复性良好。
加样回收试验:魔芋多糖的平均加样回收率为97.7%,RSD = 1.55% (n = 6)。

Table 4. Results of methodological evaluation
表4. 方法学考察结果
4. 结论
本实验对魔芋总多糖提取工艺进行了优化,优化的提取工艺参数为料液比1:350 (g/mL),温度45℃,超声时间为2 h,超声功率为60 W。在此条件下,魔芋多糖提取率为4.57%,且在方法学考察中,其RSD值均在合格范围内,表明采用超声波辅助提取工艺简单、稳定可行,为魔芋多糖生产工艺和质量控制提供了科学依据。
基金项目
陕西省大学生创新创业训练计划项目(S202011396086);丹凤县凯农魔芋精粉有限公司专项科研基金项目(2018HXKY013);商洛市科技计划项目(2022-Z-0001);商洛学院科研基金项目(19SCX05)。