1. 引言
包含有杂原子的多齿配体能够很好的与金属原子配位,近年来在配位化学中凸显出其非常好的配位能力,引起了人们广大的兴趣 [1] [2] [3] [4] [5] ,其不同的活性配位点、空间结构及其电子效应能很好的控制化合物的几何构型,催化活性和化合物的选择性,并且通过小粒径、相对低密度、多配位点结构等优点的新型高分子磁性材料,可以用在电子元器件的微波吸收隐身、电磁干扰的电磁屏蔽和关键信息存储等领域,具有这些优点的新型高分子基磁性材料的研究已经成为研究者重视的创新领域 [6] [7] [8] ,这种高分子材料的研究是当代科学研究中最具挑战性的前沿领域之一。
通常来看,分子设计和分子合成是高分子磁性材料研究领域中重要的课题与重要的研究成果。通常应用最多的如:氮族元素和氧族元素P,O和N,S形成的二齿配体,这些多配位的配体可以与金属原子可以形成稳定的共轭环 [9] 。尤其是以氮、氧杂原子作为配位点与缺电子的金属原子通过配位而成键居多,逐渐增多这类配体金属有机化合物的合成 [10] 。它作为一种新颖的有机配合体横空出世。配位体化学结构式如下图1所示。

Figure 1. Ligand chemical structural formula
图1. 配体化学结构式
含吡啶类官能团配体化合物在金属有机化学的研究越来越多,主要由于其在化学工业,特别是精细化工的重要原料,更重要应用于医药制品、农药等许多领域。随着含吡啶基配体的合成,关于这类配体的金属有机化合物的研究和应用也越来越多,这些含吡啶基的N,O-二齿金属配合物在电磁特性方面有很大的应用,研究最多的是N,O-二齿金属配合物,而含吡啶基的N,O-多齿金属配合物的研究很少。
如今,这样的研究工作主要包括两方面:1) 制备和设计一类新的与金属配位的有机配体,可以研究新有机配体与金属配位的配位方式;2) 已合成的有机配体我们可以通过调节分子结构中的配位点,提高它与金属的配位能力,从而得到常温下稳定的分子基配位聚合物,所以,在设计新的分子基磁性体系时,一定要增强分子间的相互作用,这样可以使具有多配位点的有机配体轻松满足这一要求,常温下制备出稳定的分子基磁性材料就成为设计和合成出与金属配位的有机配体 [11] 。吡啶环具有独特的分子结构,我们可以在此基础上对其结构进行进一步修饰,与铁、镍、铜、锌、钴等二价离子形成多种配位数和配位方式的分子结构,这些二价金属能与含N、O的配体形成牢固的配位数 [12] 。
有机分子中含有吡啶环官能团在电子配对效应方面有着特殊的有机化合物,所以在有机配位化学物的合成中起着重要的作用 [13] [14] [15] ,下图2是它为重要的成键结构。
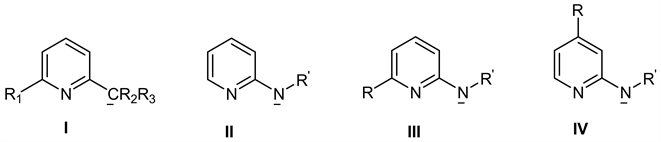
Figure 2. Substituted pyridine ligands I, II, III and IV
图2. 取代吡啶配体I、II、III和IV
氮族元素和氧族元素中P,O、N,S、N,P、N,O等形成的二齿配体,这些配体与金属原子可以形成稳定的共轭环 [16] [17] 。尤其是以氮、氧杂原子作为配位点与缺电子的过渡金属原子通过配位键而成键居多,关于此类有机配体的有机金属化合物的合成也逐渐增多 [18] [19] 。是一种能提供多配位点的高分子新配合体。
基于以上研究背景,前期合成的N,O-二齿配体化合物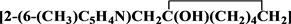 为初始原料,以四氢呋喃作溶剂,在低温条件下与ZnEt2反应,得到了其对应的金属锌N,O-二齿配合物
为初始原料,以四氢呋喃作溶剂,在低温条件下与ZnEt2反应,得到了其对应的金属锌N,O-二齿配合物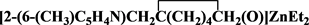 ,并对其结构进行了表征。
,并对其结构进行了表征。
通过对此配合物的设计合成,在此基础上进一步设计和开发出新型的高分子基磁性材料具有较大的理论意义。
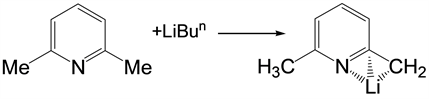
Figure 3. Monolithiation of substituted pyridines
图3. 取代吡啶的单锂化
在上述图3中得到的活性锂配位化合物是一种很好的无机配体转移试剂,本文通过吡啶环配体单锂化后与环己酮反应合成中间配合物,该配合物可同ZnEt2化合物进行电子对的配位,合成了应用较更广泛的高分子基配位聚合物。
2. 实验部分
2.1. 试剂与仪器
将合成出来的N,O-二齿配体化合物 与ZnEt2反应,得到了其对应的金属锌N,O-二齿配合物
与ZnEt2反应,得到了其对应的金属锌N,O-二齿配合物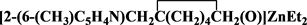 。在这些反应过程中,我们用乙醚和正己烷做溶剂,溶解性都不好,改用四氢呋喃作溶剂,在四氢呋喃中反应得到了无色的清液,然后过滤清液,浓缩,将滤液放置低温培养单晶,在这个反应中得到了期望中的产物。得到的锌配合物为白色晶体。该结构通过1HNMR、13C-NMR测定和元素分析得到确证。
。在这些反应过程中,我们用乙醚和正己烷做溶剂,溶解性都不好,改用四氢呋喃作溶剂,在四氢呋喃中反应得到了无色的清液,然后过滤清液,浓缩,将滤液放置低温培养单晶,在这个反应中得到了期望中的产物。得到的锌配合物为白色晶体。该结构通过1HNMR、13C-NMR测定和元素分析得到确证。
2.2. 合成路线设计
在前面的背景之下,我们选用2,6-二甲基吡啶为初始有机原料,按照1:1的比例同正丁基锂去氢,中间体再与环己酮在一定的条件下合成含有N元素和O元素的二齿配体化合物,合成的二齿配体化合物在低温条件下同ZnEt2进行配位,合成了应用更广泛的金属配合物 [20] 。结构如图4。
2.3. 实验步骤
将N,O-二齿配体化合物(0.466 g, 2.3 mmol)搅拌溶解在30 mL的有机溶剂四氢呋喃中,在搅拌状态下再将ZnEt2 (4.8 mL, 1 mol/L)的正己烷溶液在−78℃下慢慢滴入,溶液中逐渐出现白色沉淀,恢复到室温后,变成无色清液,继续搅拌反应2 h,反应完成后过滤混合物,用两种混合溶剂(四氢呋喃和正己烷)进行结晶,放置在零下10℃~15℃的冰柜中,数天后得到无色透明晶体2f (1.25 g, 84%)。1H NMR (300 Hz, 298 K, C6D6): δ(ppm) 0.35~0.46 [q, 2H, ZnCH2CH3], 1.36~1.43 (t, 3H, ZnCH2CH3), 1.30~1.64 (m, 10H, (CH2)5), 2.78 (S, 3H, NC5H3-CH3), 6.64~6.70 (t, 2H, NC5H3), 7.09~7.14 (t, 1H, NC5H3), 3.08 (s, 2H, NC5H3-CH2); 13C NMR (C6D6): δ(ppm) 3.14 (ZnCH2CH3), 14.14 (ZnCH2CH3), 24.93~72.80 (CH2)5, 122.14, 122.97, 138.15, 158.15, 160.25 (NC5H3), 26.88 (NC5H3-CH3), 47.44 (NC5H3-CH2)。
2.4. 化合物1H NMR和13C NMR结构图谱分析
在该化合物的1H NMR (图5)中与锌原子相连的CH2表现为四重峰,出现在0.35 ppm~0.46 ppm处,与锌原子相连的乙基上的CH3表现为三重峰,出现在1.47 ppm~1.53 ppm,环己基上的氢原子裂分的峰形比较繁杂,出现在1.30 ppm~1.64 ppm之间,吡啶环甲基上的氢为单峰,出现在2.78 ppm,吡啶环上2号位亚甲基上的氢原子为单峰,出现在3.08 ppm,吡啶环上的氢分别裂分为三重峰分别在6.64 ppm~6.70 ppm,7.09 ppm~7.14 ppm。
在该化合物的13C NMR (图6)与锌原子相连的乙基碳分别出现在3.14 ppm和14.14 ppm,环己基上的碳出现在24.93 ppm~72.80 ppm处出现三个峰,与吡啶环相连的甲基碳出现在26.88 ppm处,吡啶环上2号位亚甲基上碳原子出现在47.44 ppm处,吡啶环上的碳原子分别出现在122.14,122.97,138.15,158.15和160.25处,通过13C NMR (图6)进一步证明了该化合物同课题组起初设计的预期结构相吻合。
3. 结果和讨论
如式1所示,利用正丁基锂的强碱性将2,6-二甲基吡啶去氢后,用四氢呋喃做溶剂,在液氮冷却下与环己酮加成得到含N,O-二齿配体化合物,温度控制在−78℃下慢慢滴入,溶液中逐渐出现白色沉淀,恢复到室温后,变成无色清液。在上述反应过程要注意控制反应物的滴加速度,此外在整个反应过程中需要控制反应过程的低温环境,这样有助于避免锂盐中介体的团聚,通过对低温环境中合成的含吡啶基N,O-二齿配体锌配合物的1H NMR和13C NMR图谱进行分析,这同课题组起初设计的预期结构相吻合。
参考文献
NOTES
*通讯作者。