1. 引言
山药是薯蓣科植物薯蓣的干燥根茎,具有健脾、补肺、固肾等功效 [1] 。山药中含有脂肪酸、蛋白质、氨基酸、多糖等多种成分。其中,多糖是目前公认的山药中的主要活性成分之一。已有研究表明,山药多糖具有抗衰老 [2] 、免疫调节 [3] [4] [5] 、抗氧化 [6] [7] 、抗疲劳 [8] 、降血糖 [9] 、降血压 [10] 、抗肿瘤 [11] 等作用。然而,目前对山药多糖的提取研究主要集中于传统提取方法,且对几种提取方法的对比研究较少。
本实验以山药为原料,采用热水回流、超声波辅助、热水–酶联合以及超声波–酶联合四种方法提取山药多糖,探讨不同提取方法对山药多糖提取率及抗氧化活性的影响,为山药多糖的后续开发利用奠定基础。
2. 材料与方法
2.1. 材料与试剂
山药(铁棍山药)购于黑龙江省哈尔滨市药材市场。纤维素酶购于上海蓝季科技发展有限公司。
95%乙醇、氯仿、正丁醇、苯酚、硫酸、葡萄糖、磷酸氢二钠、磷酸二氢钠、1,10-菲啰啉、硫酸亚铁、没食子酸等均为国产分析纯。
2.2. 仪器与设备
HH-Z数显恒温水浴锅常州丹瑞实验仪器设备有限公司金坛市双捷实验仪器厂;SHZ-D (III)循环水式真空泵巩义市予华仪器有限责任公司;RE-52AA旋转蒸发器上海亚荣生化仪器厂;KQ-100VDB型双频数控超声波清洗器昆山市超声仪器有限公司;FD-1A-50冷冻干燥机北京博医康实验仪器有限公司;T6新世纪紫外可见分光光度计北京普析通用仪器有限责任公司。
2.3. 方法
2.3.1. 不同方法提取山药多糖
将山药置烘箱中60℃干燥并粉碎,过60目筛。95%乙醇60℃回流提取三次,每次五小时进行脱脂,抽滤后将药品粉末烘干(60℃),即得预处理药材,置于干燥器中备用。
取脱脂山药粉末15 g,按照料液比1:20于一定温度下提取2 h,平行提取三次。离心(4000 rpm, 20 min)得提取液,按Sevge法 [12] 脱蛋白三次。提取液透析24小时(3500 Da)后,加四倍体积95%乙醇沉淀,4℃过夜,离心得沉淀,冷冻干燥得山药多糖样品。四种提取方法均按上述流程提取样品,具体条件见表1。
2.3.2. 山药多糖含量测定
以葡萄糖为标准品,按苯酚–硫酸法 [12] 建立标准曲线并测定2.3.1中各方法提取样品。
2.3.3. 提取后山药组织显微结构测定
在扫描电镜下观察不同提取方法对山药组织细胞细胞壁的破坏效果。
2.3.4. 多糖抗氧化活性测定
1) 多糖对羟基自由基的清除力
在离心管中依次加入5 × 10−3 mol/L邻二氮菲溶液1.0 ml,7.5 × 10−3 mol/L硫酸亚铁溶液0.5 ml,1.0 ml PBS,加入不同浓度(0.1、0.2、0.3、0.4、0.5 mg/ml)多糖提取液1.0 ml、0.1%过氧化氢0.5 ml,用蒸馏水定容到刻度,37℃水浴1 h,于510 nm波长处测定吸光度,并按下式计算清除率。
A1:样品的吸光度,A2:用水代替样品的吸光度,A3:用水代替样品和H2O2的吸光度
2) 多糖对超氧阴离子的清除力
取不同浓度的多糖提取液1 ml,加入50 mM Tris-HCL缓冲液5.0 ml、7 × 10−3 mol/L邻苯三酚0.2 ml,加入蒸馏水定容至刻度,25℃水浴30 min,于325 nm波长处测定吸光度。以水代替样品和邻苯三酚为空白溶液,并按下式计算清除率。
A0:用水代替样品的吸光度,A1:样品的吸光度
3) 多糖对DPPH的清除力
取不同浓度的多糖提取液3.0 ml与1.0 ml 0.1 mM DPPH溶液均匀混合,37℃暗处理30 min,于517 nm波长处测定吸光度。以水代替样品和DPPH为空白溶液。
A0:用水代替样品的吸光度,A1:样品的吸光度,A2:用水代替DPPH的吸光度

Table 1. Extraction conditions of different extraction methods
表1. 不同提取方法提取条件
3. 结果与分析
3.1. 不同提取方法提取效果的比较
关于山药多糖的提取已有报道,如孙锋等 [13] 在山药粗多糖的提取工艺研究中,利用水提法工艺浸提鲜山药中的多糖,以料液比、提取温度、时间和乙醇体积分数为自变量,进行单因素实验。最终确定较优的工艺为料液比1:9,温度50℃,时间2.5 h,乙醇体积分数75%,在此工艺条件下,鲜山药粗多糖得率为0.2449%。本实验中按苯酚-硫酸法建立标准曲线如下:Y = 7.7333C + 0.8923 (r2 = 0.9999)。以此方法测定各多糖样品并由标准曲线计算其提取率。热水回流法多糖的提取率为0.4650%;超声波辅助法多糖的提取率为0.8507%;热水–酶联合法多糖的提取率为0.4432%;超声波–酶联合法多糖的提取率为1.9290%。由以上结果可以看出,上述四种提取方法所得山药多糖提取率均高于文献报道 [13] ,超声波–酶联合法对多糖的提取率最高。此方法可最大程度的获取山药多糖,这将为后续此多糖开发、利用奠定极其重要的基础。
3.2. 提取后组织电镜扫描图
由山药组织微观结构的电镜扫描图(图1)可以看出,样品经酶处理并提取后,其组织的破坏程度相较于未经酶处理的提取法更加明显,组织中的空隙也更大。
另一方面,超声波辅助法较之热水回流法的组织破坏程度要大。这些结果与提取率测定所得的提取效果完全一致,从另一方面对提取效果的优劣进行了更为直观的说明。
3.3. 多糖各样品抗氧化活性的测定
由图2(a)可以看出,不同提取方法获得的多糖样品对羟基自由基均具有较好的清除能力。同时可以看到,各样品对羟基自由基的清除能力差异不大。当浓度达到0.4 mg/ml后,清除能力上升不再明显。图2(b)显示各样品对超氧阴离子的清除能力差异具有较大差异。

Figure 1. SEM scanning structures of Rhizoma dioscoreae after different extraction methods ((a) hot water reflux extraction; (b) ultrasonic assisted extraction; (c) hot water-enzyme combined extraction; (d) ultrasonic-enzyme combined extraction)
图1. 不同方法提取后的山药组织电镜扫描结构((a) 热水回流提取;(b) 超声波辅助提取;(c) 热水–酶联合提取;(d) 超声波–酶联合提取)
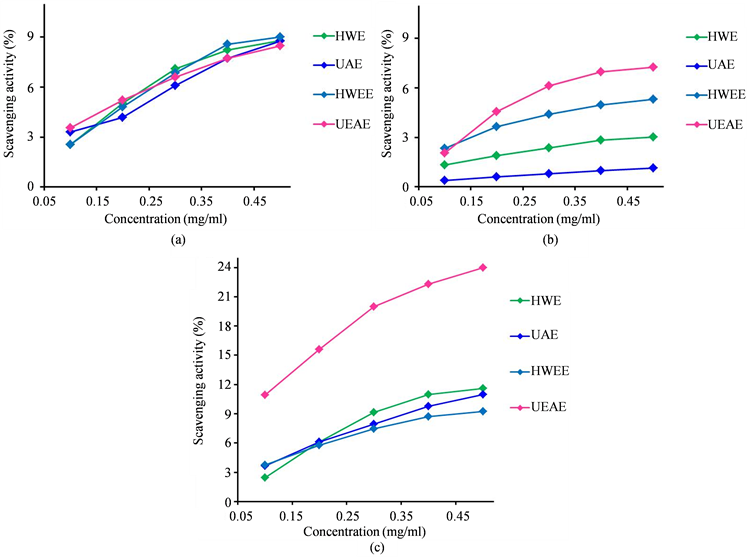
Figure 2. Antioxidant activities of polysaccharides by different extraction methods ((a) hydroxyl radical scavenging rate; (b) superoxide anion scavenging rate; (c) DPPH scavenging rate)
图2. 不同提取方法获得多糖样品的抗氧化活性((a) 羟基自由基清除率;(b) 超氧阴离子清除率;(c) DPPH清除率)
图2(c)中,除超声–酶联合提取法获得的多糖外,其他三种方法体现的对DPPH的清除能力差异不大。图2(b)和图2(c)均表明,超声–酶联合提取法获得多糖的抗氧化活性明显高于其他三种提取方法获得的多糖样品。另一方面,各图均可看出样品的抗氧化能力体现了很好的量效关系。
4. 结论
本研究采用了四种不同的提取方法对山药多糖的提取效果和抗氧化活性进行了研究。实验结果表明,四种提取方法的提取效果差异明显且具有明显的抗氧化活性差异。其中提取率由高到低的顺序为:热水–酶联合 < 热水回流 < 超声波辅助 < 超声波–酶联合。超声酶提取法不仅表现出良好提取效率,而且样品的抗氧活性也较强。这将为后续药物的开发奠定极其重要的基础。
基金项目
黑龙江省自然科学基金(QC2014C095);
黑龙江省卫生和计划生育委员会科研课题(2014-434);
哈尔滨医科大学创新科学研究资助项目(2016JCZX60);
黑龙江省大学生创新创业训练项目(201610226039);
国家级大学生创新创业训练项目(201710226005)。
致谢
本研究得到了哈尔滨医科大学“大学生创新创业教育实训中心”的大力支持,在此表示感谢。