1. 引言
苯丙氨酸解氨酶(Phenylalanine ammonia-lyase, PAL, EC 4.3.1.24)催化苯丙氨酸非氧化性脱氨生成反式肉桂酸,是一个连接初级代谢和次级代谢的酶。1961年,Koukol J和Conn E E首次在大麦中发现PAL,并进行了分离纯化 [1] 。随后,关于PAL的研究迅速展开,目前已经在水稻、大豆等多种高等植物及藻类、真菌、细菌中发现PAL的存在,且已经对美国南瓜 [2] 、枸杞 [3] 、梨 [4] 等多种植物的PAL基因进行了分子克隆及序列分析 [5] 。
研究发现,PAL是一种由4个亚基构成的寡聚酶,不同来源的PAL分子量略有差异,但一般在270~330 KDa之间。不同植物的PAL氨基酸组成不同,如玉米、马铃薯两种植物PAL中的酸性氨基酸含量高于水稻,而中性氨基酸含量则低于水稻 [5] 。不同来源的PAL最适pH不同,通常为8.0~9.5,如菜豆PAL最适pH为8.8~9.2,甘薯PAL最适pH为8.5~9.5,水稻PAL最适pH为9.2 [6] 。不同物种PAL基因家族成员的数量有明显差异,如拟南芥含有4个PAL基因、大豆含有7个PAL基因 [7] 。
PAL对植物生理代谢具有重要意义,参与植物的木质化、色素合成、根瘤形成等生理过程 [8] ;对植物抗逆境也有重要作用,与植物抗病性密切相关。小麦是三大农作物之一,在人类的日常生活中发挥重要作用,对其进行科学研究具有重要意义。本实验中首先挖掘了小麦PAL基因的序列,随后进行了小麦PAL的提取、纯化、活性测定 [9] ,最后进行了SDS-PAGE电泳,希望为小麦PAL的研究提供新的数据支持。
2. 材料与方法
2.1. 数据库及软件
使用在线BLAST服务在植物基因组学资源数据库(Phytozome v12.1.5, https://phytozome.jgi.doe.gov)和裸子植物基因组资源数据库(ConGenIE, http://congenie.org)中搜索不同物种的PAL基因序列。使用MUSCLE多序列比对在线服务网站(https://www.ebi.ac.uk/Tools/msa/muscle)和BioEdit v7.0.5.3软件(http://www.mbio.ncsu.edu/bioedit/bioedit.html)对搜索得到的PAL序列进行多序列比对,然后使用Model Generator v0.85软件计算多序列比对后PAL序列的最佳氨基酸替代模型,最后使用PhyML v 3.1软件(http://www.atgc-montpellier.fr/phyml)构建最大似然法(Maximum Likelihood, ML)系统进化树。在PLEXdb网站(http://www.plexdb.org)的数据库中搜索小麦PAL基因的表达模式数据,并使用HemI v1.0.3.7软件(http://hemi.biocuckoo.org)绘制基因表达模式热图。
2.2. 植物材料
普通小麦,浸种12 h,光照时间12 h/day,20℃培养8天。
2.3. 仪器及试剂
2.3.1. 主要仪器
光照培养箱、水浴锅、紫外检测仪、紫外分光光度计、层析柱、电泳仪。
2.3.2. 主要试剂
酶提取液:0.1 mol/L Tris-H2SO4缓冲液(pH 8.3),1 mmol/L EDTA-Na2,5%甘油,7 mmol/Lβ-巯基乙醇;
洗脱液A:50 mmol/L Tris-H2SO4缓冲液(pH 8.3),1 mmol/L EDTA-Na2,5%甘油,2% β-巯基乙醇;
洗脱液B:50 mmol/L Tris-H2SO4缓冲液(pH 8.3),1 mmol/L EDTA-Na2,5%甘油,2% β-巯基乙醇;0.6 mol/L NaCl;
透析液:50 mmol/L Tris-H2SO4缓冲液(pH 8.3),1 mmol/L EDTA-Na2,50%甘油,2%β-巯基乙醇。
2.4. 实验方法
2.4.1. 小麦PAL蛋白的粗提取
称取10 g小麦幼叶,剪碎,加入20 mL酶提取液在冰上低温研磨;过滤,4℃冷冻离心30 min,取上清并量取该粗提取液体积(样品1)。
2.4.2. 小麦PAL蛋白的分级沉淀
按所得体积称量2份(NH4)2SO4,分别使粗提取液达到40%、70%饱和度;将第一份(NH4)2SO4加入粗提液中缓慢搅拌,全部溶解后再持续搅拌10 min,静置20 min,4℃冷冻离心15 min,取上清;再将第二份(NH4)2SO4按同样方式加入,离心后取沉淀;用5 mL酶提取液溶解沉淀(样品2)。
2.4.3. 小麦PAL蛋白的分子筛层析及透析
用0.02 M磷酸盐缓冲液处理Sephadex G-25凝胶柱料,装柱并连接到检测系统,用0.02 M磷酸盐缓冲液和洗脱液A进行平衡并校正系统示数,上样后用洗脱液A洗脱,收集洗脱液。再用200,000 MD的透析袋和甘油浓度50%的透析液进行透析,至终体积约5 mL (样品4)。
2.4.4. 小麦PAL蛋白的阴离子交换层析及透析
参照《高级生物化学实验》( [10] , p.84)的处理方法对DEAE-葡聚糖柱料进行预处理,装柱后连接到检测系统,用洗脱液A进行平衡及校正系统读数,上样,用洗脱液A洗杂,当检测仪示数稳定后加入洗脱液B进行洗脱,收集洗脱液。最后用相同的透析袋和透析液进行透析,至终体积约5 mL。
2.4.5. PAL蛋白的浓度及活性测定
使用考马斯亮蓝染色法测定蛋白质浓度,用表1方法进行PAL蛋白的活性测定。

Table 1. Sample protein activity determination method
表1. 样品活性测定方法
2.4.6. PAL蛋白的SDS-PAGE电泳
SDS-PAGE凝胶制备配方如下:
浓缩胶:30%Acrylamide 0.63 mL,1.5%AP0.25 mL,浓缩胶缓冲液1.25 mL,ddH2O 2.87 mL,TEMED 20 ul;
分离胶:30% Acrylamide 4.0 mL,1.5%AP 0.5 mL,浓缩胶缓冲液1.25 mL,ddH2O 4.25 mL,TEMED 40 ul。
3. 结果与分析
3.1. PAL基因家族的基因搜索及系统进化分析
我们以已经发表的4条拟南芥(Arabidopsis thaliana) PAL基因序列为模板,在Phytozome数据库中搜索得到6个物种的71条PAL基因序列,其中小麦(Triticum aestivum) 26条、玉米(Zea mays) 10条、水稻(Oryza sativa) 9条、毛果杨(Populus trichocarpa) 5条、江南卷柏(Selaginella moellendorffii) 9条、小立碗藓(Physcomitrella patens) 12条;同时在ConGenIE数据库中搜索得到2个裸子植物的16条PAL基因序列,包括挪威云杉(Picea abies) 5条、火炬松(Pinus taeda) 11条。使用MUSCLE软件对这91条PAL基因序列进行多序列比对,使用BioEdit软件对比对后的序列进行手动调整和校正,然后使用Model Generator软件计算出最适氨基酸替换模型为JTT + G + F。最后使用PhyML软件对这91个基因构建最大似然法系统进化树(图1)。进化树显示小麦PAL基因发生了明显的基因扩张,预示着PAL基因可能对小麦的生长和发育等具有重要的作用和意义。
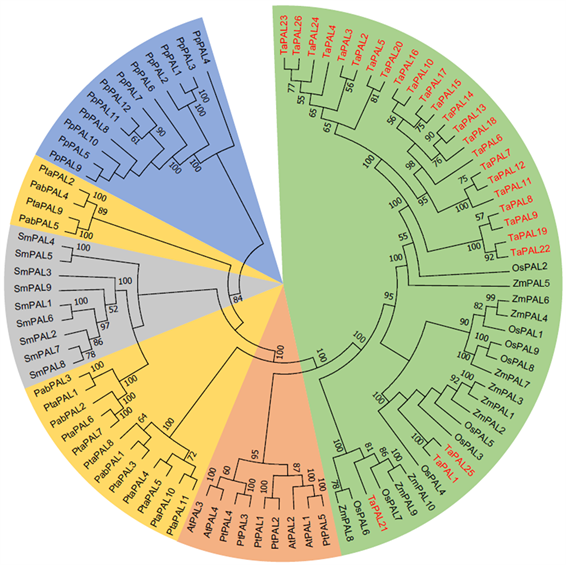
Figure 1. Phylogenetic tree of 91 PAL genes
图1. PAL基因系统进化树
3.2. 小麦PAL基因家族的表达模式分析
基于PLEXdb网站的数据,我们搜索得到小麦PAL基因的基因表达数据,使用HemI软件绘制基因表达模式热图(图2)。结果显示,70%以上的小麦PAL基因在幼嫩组织中的表达量均高于成熟组织。其中,TaPAL1、5、7、11、12这5个基因在各组织部位中的表达量较低,而TaPAL21、25这两个基因在各个组织中均有较高的表达量。
3.3. 小麦PAL基因的提取及活性测定
将小麦幼苗按2.4所述方法进行PAL蛋白的粗提取,取1mL留样(样品1)进行蛋白浓度及活性测定;盐析后得到5 mL的粗提液,留样(样品2),再用Sephadex G-25凝胶为柱料的分子筛进行脱盐处理,所得层析图谱如图3所示。查阅文献可知,小麦PAL的分子量约为280 kDa [9] ,进行分子筛时会因分子量较大而先被洗脱,因此判断层析图谱的第一个峰为目标蛋白的洗脱峰(预实验中对2个洗脱峰进行测活,峰1具有PAL蛋白酶活性)。
将洗脱液透析浓缩后得到6 mL的蛋白粗提液,取1 mL留样(样品3)。剩余粗提液用DEAE-葡聚糖凝胶进行阴离子交换层析,得到图4所示层析图谱。从图上可以看出,46 min开始出现洗脱峰,且分为2个小峰,将这前后两个峰分别进行收集,透析浓缩后分别留样(样品4、5)。
3.4. 小麦PAL基因的SDS-PAGE电泳
本次SDS-PAGE电泳结果如图5所示,查阅文献资料得知,小麦PAL是由4个相同亚基构成的蛋白,单一亚基的分子量大小约70 kDa [5] 。商品PAL来自于粘红酵母,单一亚基的分子量大小约78 kDa。图中的样品1~3不能清晰的看到PAL蛋白条带,但是经过高度浓缩的样品4中出现了清晰的PAL蛋白条

Figure 2. Heat map of wheat PAL genes expression pattern
图2. 小麦PAL基因的表达模式热图

Figure 3. Molecular mapping of wheat PAL protein extraction
图3. 小麦PAL蛋白提取的分子筛图谱

Figure 4. Anion exchange chromatography of wheat PAL protein extraction
图4. 小麦PAL蛋白提取的阴离子交换层析图谱
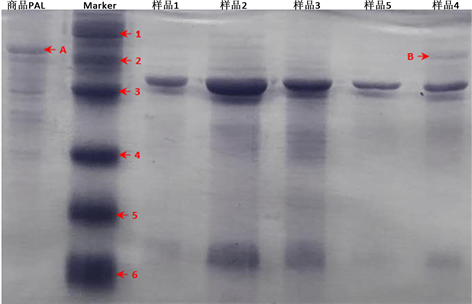 注:1. 分子量97.4 kDa;2. 分子量66.2 kDa;3. 分子量43.0 kDa;4. 分子量31.0 kDa;5. 分子量22.0 kDa;6. 分子量14.4 kDa;A. 商品PAL蛋白的位置,大小约78 kDa;B. 样品4中PAL蛋白的位置,大小约70 kDa
注:1. 分子量97.4 kDa;2. 分子量66.2 kDa;3. 分子量43.0 kDa;4. 分子量31.0 kDa;5. 分子量22.0 kDa;6. 分子量14.4 kDa;A. 商品PAL蛋白的位置,大小约78 kDa;B. 样品4中PAL蛋白的位置,大小约70 kDa
Figure 5. Wheat PAL protein SDS-PAGE electrophoresis results
图5. 小麦PAL蛋白SDS-PAGE电泳结果

Table 2. Wheat PAL protein extraction results
表2. 小麦PAL蛋白提取结果
注:① 提纯倍数 = 每次纯化后比活力(U/mg)/第一次比活力(U/mg);② 回收率 = 提纯后总活力(U)/提纯前总活力(U)。
带,其大小与文献所述相吻合,而同样经过高度浓缩的样品5中却不能清楚看到PAL蛋白条带。
3.5. 小麦PAL蛋白的活性分析
参照《高级生物化学实验》( [10] , p.37)所列方法制作蛋白标准曲线,再按2.4.5方法分别测定样品1~5的蛋白浓度及活性,计算并填写表2。
从表2中可以看出,样品1~4的比活力、提纯倍数都呈现逐渐递增的趋势,总蛋白、回收率则出现了递减的趋势,说明PAL蛋白经过粗提、盐析、分子筛、阴离子交换之后确实得到了纯化,且随着纯化步骤的进行,不断有杂蛋白被分离出去,最后获得了纯度较高的小麦PAL蛋白。而样品5虽然有PAL蛋白的活性,但是比活力和纯化倍数都较低,推测该样品中有较大比例的杂蛋白存在,而PAL蛋白含量较少。
本研究以9种陆地植物的91个PAL基因为对象进行系统进化分析,发现小麦PAL基因的数量远多于其他物种,预示着该基因家族在小麦中可能经历了基因扩张事件;随后对小麦PAL基因进行表达模式的分析,发现幼嫩组织中具有较高的表达量;最后进行了小麦嫩叶组织中的PAL蛋白提取实验,结合亲和层析、SDS-PAGE电泳及PAL活性测定等实验的结果可知,此次实验提取到的样品4为纯度较高的小麦PAL蛋白。
4. 讨论
本研究利用Phytozome、ConGenIE和PLEXdb数据库,MUSCLE、BioEdit、ModelGenerator、PhyML和HemI等软件完成了小麦PAL基因家族的挖掘、进化树的构建、表达模式数据的收集及热图的绘制,对苔藓植物、石松类植物、裸子植物和被子植物9个代表物种的PAL基因的系统发生关系进行了初步的计算。实验提取部分包含粗提、盐析、分子筛、阴离子交换、SDS-PAGE电泳等几个主要步骤,通过PAL蛋白的活性测定、SDS电泳的实验结果证明了小麦PAL蛋白的成功提取。在预实验中,直接使用样品4、5进行SDS电泳,并未得到正确的目的条带,随后对样品4、5分别进行高度浓缩,至终体积约100 ul,并再次电泳,最后得到了图5所示电泳图。从SDS-PAGE电泳图中可以看到,样品1~5中都含有一种分子量大小在46 kDa左右的蛋白,经过几种纯化方式都没有被除去,可能是一种性质与PAL蛋白相似的组成型蛋白,在后期的研究中,可以针对这种蛋白再展开研究,进一步确定其具体情况。
其他学者的研究结果表明,PAL是一种诱导型蛋白,低温、机械损伤、病原菌感染、毒素处理等多种因素都能诱导PAL表达,赤霉素等植物激素的刺激亦能导致PAL活性的上升,进而影响植物的生理和生化功能。在后续的研究中,可以采用激素诱导表达的方式探究不同植物激素浓度对PAL表达量及活性的影响,从而为优化植物生长提供理论支持。
基金项目
国家自然科学基金“杨树赤霉素代谢途径的解析及相关基因家族的功能分化机制研究”。