1. 引言
黄酮类化合物是一类重要的天然有机化合物,是植物在长期自然选择过程中产生的一类次生代谢产物 [1] 。它广泛存在于高等植物及羊齿植物的根、茎、叶、花、果实等中 [2] 。不仅数量种类繁多,而且结构类型复杂多样。黄酮类化合物因其独特的化学结构而对哺乳动物和其它类型的细胞具有许多重要的生理、生化作用 [3] 。一方面,它具有很强的药理作用。大量研究表明,黄酮类化合物可广泛影响心血管系统、神经系统和消化系统 [4] [5] 。另一方面,黄酮类化合物具有高度的化学反应性。黄酮作为一种天然抗氧化剂,对自由基有一定的清除能力 [6] 。李淑珍等发现黄酮作为一种天然的抗氧化剂对自由基有较强的清除能力 [7] 。人体内自由基过多,常常会引起动脉粥样、心脑血管疾病、糖尿病、中枢神经系统障碍等一系列疾病 [8] 。且超氧阴离子
与羟基OH−结合后的产物会导致细胞DNA被破坏,从而破坏人体机能 [9] 。目前治疗相关疾病的抗氧化药物大部分是人工合成,它对人体或多或少会造成一定的危害。杨楠等发现黄酮类化合物是一类天然产物,在自然界中普遍存在,具有生理活性广泛,毒副作用低的特点 [10] 。黄酮是一种低成本的天然抗氧化剂,符合现在医学治疗理念。
沙芥,十字花科植物沙芥属 [11] 。目前沙芥的开发利用已初步实现产业化,系列产品包括软包装成品沙芥、沙芥罐头、沙芥汁等,且其药用产品的研发仍在继续 [12] 。沙芥体内富含黄酮类化合物 [13] 。
本研究通过对沙芥叶片总黄酮的抗氧化进行探究,希望能够为今后抗氧化药物的研发与自由基相关疾病的防治提供依据。
2. 材料与方法
2.1. 实验材料与试剂
本实验所用材料为沙芥叶叶片,采自陕西省榆林市榆阳区新开沟野生沙芥(由延安大学生命科学学院植物学实验室鉴定)。用清水将采集到的叶片清洗干净,待叶片体内水分阴干,将其粉碎,选择80目筛,塑封并于4℃进行保存,待用。
芦丁标准品、BHT (中国药品生物制品检定所);无水乙醇、三氯化铁、硫酸亚铁、过氧化氢、1,1-二苯基苦基苯肼(DPPH)、水杨酸、磷酸二氢钠、磷酸氢二钠、铁氰化钾、三氯乙酸均为分析纯,由国药集团化学试剂公司提供。
2.2. 实验仪器
电子天平(自赛多利斯天平公司制造)、循环水式真空泵(型号:SHZ-D,子华仪器公司制造)、旋转蒸发仪(型号:RE-52B,亚荣生化仪器厂制造)、数显恒温水浴锅(型号:HH-6B,国华电器公司制造)、台式高速离心机(TG16-WS型,湘仪离心机仪器公司制造)、紫外可见分光光度计(型号:UV-2550,岛津企业管理公司制造)、植物粉碎机(FZ102微型,中兴有限责任公司制造)、数控超声波清洗器(KQ-300DE型,超声仪器有限公司制造)。
2.3. 实验方法
2.3.1. 沙芥叶总黄酮的制备
1) 粗提物的制备
粉碎沙芥叶片,经80目筛,使用石油醚溶液脱脂处理,在以下条件下超声处理42 min:乙醇(80%),料液比(1:26 ml∙g−1),超声(300 W),水浴(70℃);重复3次,通过旋蒸将乙醇除去,于干燥、冷冻环境中,制成粉末,保持到−20℃超低温冰箱内,待用。
2) 纯化物的制备
让粗提物样本在流速为2 mL/min、pH为5的条件下进行回流;再用浓度为80%的乙醇洗脱,洗脱速度为2.0 mL/min,洗脱体积达到4 BV,将洗脱液经旋蒸浓缩后冷冻干燥成粉末备用。
2.3.2. 铁离子还原能力的测定 [14] [15] [16] [17]
1) 测定原理:自由基可与抗氧化物质提供的电子反应稳定的络合物,在700 nm下有最大吸收峰,吸光值的大小反应了还原力的大小,从而间接反应了抗氧化性的强弱 [18] [19] 。
2) 取BHT,样品,分别稀释为浓度是0.05 mg/L、0.1 mg/L、0.2 mg/L、0.4 mg/L、0.6 mg/L、0.8 mg/L的溶液,在1.0 mL不同浓度的液体中加1 mL铁氰化钾(1%)和1.0 mL磷酸盐缓冲液(0.2 mol/L, PBS pH 6.6),充分混和,放置到水浴锅(50℃)内处理20 min,取出快速冷却后再加入1.0 mL 10%三氯乙酸,于4℃下转速为3000 r/min的离心机中处理10 min,取2.0 mL上清液,加2 mL三氯化铁(0.02%),充分混和,放置10 min,于波长为700 nm时对其吸光值(OD值)进行测定,阳性对照组选用BHT,如果测得OD越大表明该物质具有越强的还原力。
2.3.3. 羟自由基(∙OH)清除活性的测定 [20] [21]
1) 测定原理:羟自由基的氧化性很强,能够很好的和抗氧化物质反应,其作用机理为H2O2与Fe2+发生反应产生OH自由基后进一步与水杨酸反应后生成有色物质 [22] [23] ,在510 nm下测吸光值,抗氧化物质能够抑制或减弱OH自由基从而使有色物质的颜色变浅,使得吸光值减弱。
2) 实验步骤:
将样品与对照品BHT梯度稀释成0.5 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL、2.5 mg/mL,分别取1 mL溶液,分别加1.0 mL邻二氮菲(7.5 mmol/L),2.0 ml PBS缓冲液(0.2 mol/L, pH = 7.4),混合充分后,再加入1.0 mL 7.5 mmol/L硫酸亚铁溶液,每加一管立即混匀,最后加入1.0 mL 0.1% H2O2溶液,通过加蒸馏水将溶液定容到10 mL。恒温(37℃)水浴处理1 h,于510 nm的波长时对其吸光值(OD值)进行测定。空白组中通过蒸馏水替代样品液;损伤组通过蒸馏水替代H2O2、样液,阳性对照为BHT,参比液选择蒸馏水,清除率公式如式(2)所示。
式(2)
其中:AX表示样品组OD;A0表示损伤组OD;A1表示空白组OD。
2.3.4. 超氧阴离子(
)清除能力测 [18] [19] [22] [24]
1) 测定原理:最常使用的是邻苯三酚自氧化法,反应过程为邻苯三酚在碱性条件下自氧化产生
和有色物质,有色物质在322 nm有最大吸收峰,同时
可以进一步促进自氧化,当抗氧化物质存在时能清除
从而抑制自氧化反应。根据322 mn处的吸光值可以测得
清除率。
2) 实验步骤:
取4.5 mL Tris-HCl缓冲液(pH = 8.2, 0.05 mol/L)加到试管内,再加蒸馏水2.0 mL,水浴(25℃)预热处理20 min,再向其中加浓度不同的各样液(0.5, 1.0, 2.0, 3.0, 4.0 mg/mL) 0.2 mL,再加入25 mmol/L的邻苯三酚0.4 mL,混勻后,于水浴(25℃)内处理6 min,迅速加入2滴HC1 (8 mmol/L)将反应终止,于波长为320 nm处对其吸光值(OD值)进行测定,空白组中通过蒸馏水替代样品液,阳性对照为BHT。自由基活力的计算式为式:
式(3)
式中:A1:加邻苯三酚和加抗氧化提取物,
A2:不加苯三酚但加抗氧化提取物,
A3:加邻苯三酚但不加抗氧化提取物。
2.3.5. DPPH自由基清除能力的测定 [23] [25] [26]
1) 测定原理:1,1-二苯基苦基苯肼(DPPH)能够在有机溶剂中以自由基的形式存在。DPPH自由基含有三个苯基,其中一个氮具有一对电子从而形成自由基,因为其包含了3个共振苯环,使其具有十分稳定的结构。观察DPPH自由基为紫色,在517 nm下有最大吸收值。当溶剂中加入抗氧化物质时,抗氧化物质可以提供电子或者是氢原子与自由基结合后形成淡黄色的稳定物质,因此在517 nm处吸收值也随之降低,并且抗氧化剂的强弱与吸光值的减小程度呈线性关系。
2) 实验步骤
将样液配成0.005,0.01,0.03,0.06,0.09,0.12 mg/mL不同浓度的溶液,取样品2 mL,加1 mL DPPH (0.08 mg/mL),充分混合,于常温条件下,放置30 min,取上清,阳性对照为BHT,于517 nm处对其吸光值Ax进行测定。2 mL不同浓度样品溶液与1 mL乙醇混合后于517 nm测吸光值A2,然后对乙醇混合液2 mL和DPPH 1 mL混合液的吸光值A1进行测定,由公式5对抑制率进行计算。
式(4)
式中:Ax表示样品溶液2 mL + DPPH 1 mL;A2表示样品溶液2 mL + 乙醇1mL;A1表示乙醇2 mL + DPPH 1 mL。
3. 结果分析
3.1. 铁离子还原力的测定
由图1可以看出,黄酮的浓度在0.05 mg/mL到1.5 mg/mL,无论是粗提物、纯化物还是BHT的还原能力都随着浓度的升高而加强。但沙芥叶片粗提物与纯化物的还原力差异显著,表现为纯化物的还原力强于粗提物,且两者的还原力都强于BHT。在沙芥叶片总黄酮的浓度 < 1.5 mg/mL时,原力的大小顺序为:纯化物>粗提物> BHT。当沙芥叶片总黄酮的浓度> 1.5 mg/mL时,纯化物的还原能力有所下降,出现了低于粗提物的趋势,还原力的大小顺序为:纯化物> BHT >粗提物。
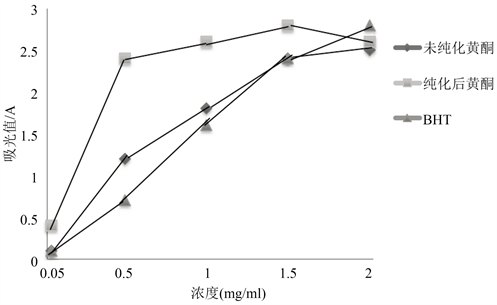
Figure 1. The reducing power on ferricing
图1. 为还原能力的测定
3.2. 对羟自由基(·OH)清除作用的测定
沙芥叶片总黄酮羟对自由基的清除作用如图2所示。对羟自由基(∙OH)清除作用随着黄酮浓度的增大而逐渐增强并具有明显的量效关系。但在高浓度时,清除效果增加较平缓,最大清除率为39.69%。当浓度为0.5 mg/mL时纯化物与阳性对照BHT清除作用相当,当黄酮浓度大于1.2 mg/mL时,情况出现了变化,黄酮纯化物的清除能力明显大于BHT,还原能力大小顺序为:纯化物>粗提物> BHT。
3.3. 对超氧阴离子(
∙)清除作用的测定
对超氧阴离子清除作用测定结果如图3所示。三者对超氧阴离子清除作用在0.5~4 mg/mL的浓度范围内呈良好的线性关系。结果表明纯化物与粗提物对超氧阴离子也有一定的清除作用,最大清除率为19.75%,当溶度为1.0 mg/mL时,三者具有相当的清除能力。当浓度是2.0 mg/mL时,纯化物与BHT的清除效果相差微小比粗提物稍好些。当溶度大于2.0 mg/mL时,清除自由基作用强弱为:纯化物> BHT >粗提物。
3.4. 对DPPH自由基清除作用的测定
DPPH自由基清除作用结果如图4所示。可以发现三者均能较好的清除DPPH,并且随着浓度的增加,清除能力也增加。由图可知在任何情况下纯化物的清除作用都强于BHT、粗提物。当溶度在0.005~0.06 mg/mL之间时,与BHT相比,粗提物具有更好的清除效果。若浓度在0.06 mg/mL以上,与粗提物相比,BHT具有更好的清除效果,可能是随着粗提物浓度的增大,粗提液中的其他成分对自由基的清除起到了一定的抑制作用。
4. 讨论
黄酮类化合物广泛存在于植物体中,是天然的抗氧化物质来源。本文通过预试验确定了沙芥中含有黄酮类化合物,并且得知沙芥叶片中的黄酮类化合物明显高于沙芥的其他器官。由于不同的物质抗氧化活性的机制有所不同 [27] ,因此物质的抗氧化性需要通过多种方法来评判,使用任何一种单一的方法来评判是不够全面不够客观的。本研究不仅通过总抗氧化活性、清除超氧阴离子(
∙)、羟自由基(∙OH−)和DPPH自由基的能力这四种化学方法,并以BTH与粗提物作为对照组,比较全面的考察了沙芥叶黄酮的抗氧化

Figure 2. The ∙OH scavenging capacity of MTS
图2. 羟自由基(∙OH)的清除能力

Figure 3. The
∙ scavenging capacity of MTS
图3. 超氧阴离子(
∙)的清除能力
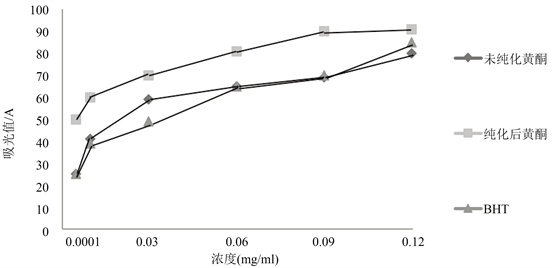
Figure 4. The DPPH· scavenging capacity of MTS
图4. PPH自由基(DPPH·)的清除能力
活性和清除能力。沙芥叶片总黄酮的粗提物和纯化物都具有较强的还原能力,对羟自由基(∙OH−)、超氧阴离子(
)和DPPH自由基均具有较强的清除作用。当浓度在一定范围内时,随着浓度的上升,纯化物与粗提物的清除效果增强,特别是对于DPPH自由基的清除能力有大幅度的上升。
由实验得出沙芥叶片总黄酮的纯化物在四种抗氧化体系中的总体效果均优于粗提物;整体抗氧化能力大小顺序为:纯化物> BHT >粗提物。这充分说明了沙芥叶片总黄酮经AB-8大孔吸附树脂纯化后,随着纯度变高,其抗氧化能力变强;且纯化物对各种自由基的清除力较阳性对照BHT的区别较为显著。因此,沙芥叶片总黄酮的纯化物的抗氧化能力优于粗提物,今后能够作为一类优质的天然抗氧化剂使用,并为防治自由基相关疾病与黄酮资源的开发利用做出依据,在食品工业中也具有广泛的开发利用前景。
基金项目
陕西省高水平大学建设专项资金生态学(2012SXTS03);延安市科学科技惠民项目(2014HM-04);陕西省大学生创新创业训练计划项目(1546)资助。
NOTES
*通讯作者。