1. 引言
光甘草定是甘草黄酮的一种 [1] ,是世界上最昂贵的天然祛斑美白成分,也是世界上公认的最安全的祛斑美白成分。黑色素是一种生物色素,人类皮肤的颜色主要取决于黑色素的含量与分布 [2] 。酪氨酸酶是黑色素生成过程中的关键限速酶。研究表明,通过抑制机体中酪氨酸酶的活性,能显著减少黑色素的生成,从而达到淡斑美白的效果 [3] 。光甘草定能显著抑制酪氨酸酶活性,Yokota T.等通过研究发现,光甘草定在0.1到1.0 μg/mL浓度范围内,对小鼠B16黑色素瘤细胞中的酪氨酸酶有抑制作用,并通过实验证明这种抑制作用是由于降低了酪氨酸酶T1和T3的活性实现的 [4] 。郑秋生等过体外和体内模型研究光甘草定对小鼠黑色素瘤细胞增殖的抑制作用及其分子机制,并发现其诱导细胞凋亡的机制可能与调控糖酵解相关基因的表达有关 [5] 。另有报道,陈文等以单酚酶和二酚酶为底物,测定光甘草定对酪氨酸酶活性的影响及体外抗氧化作用。他们认为光甘草定通过抑制酪氨酸酶和清除自由基来达到美白肌肤的作用 [6] 。
光甘草定美白的功效虽然很早就被发现,但在国内外研究中,结合计算机辅助药物设计软件来探讨光甘草定对酪氨酸酶抑制活性机制的研究却很少。因此,本实验中,首先利用Discovery studio 3.5软件与人酪氨酸酶(PDB:5m8t)进行模拟对接,发现潜在作用结合模式。并利用本公司分离得到的光甘草定评价其对人黑色素瘤细胞及酪氨酸酶的抑制作用,从而对其美白效果和安全性进行综合性的评价,为进一步的开发和应用提供参考。
2. 材料和仪器
2.1. 主要药品与试剂
光甘草定(江苏耐雀生物工程技术有限公司,纯度为:40%,90%);人黑色素瘤细胞A375 (南京大学友情提供);PRMI 1640培养基(GIBCO公司);胰蛋白酶(Sigma公司);胎牛血清(杭州四季青生物工程材料有限公司);人酪氨酸酶ELISA酶联免疫试剂盒(Bio-Swamp公司);噻唑蓝MTT (江苏晶美生物科技有限公司);二甲基亚砜(阿拉丁试剂公司)。
2.2. 主要仪器
Spectra Max190全波长酶标仪,Thermo3131二氧化碳培养箱;奥林巴斯GX51倒置显微镜;上海智诚ZHJH1112B超净工作台。
3. 实验方法
3.1. 计算机辅助药物设计
本研究选用的计算机模拟软件为DS 3.5 (Discovery Studio 3.5, Accelrys, Inc., San Diego, CA)。用画图软件ChemBioDraw画出光甘草定的结构,保存其为cdx格式文件,利用ChemBio 3D中的MMFF94力场对小分子的三维构象和能量进行优化,保存为mol格式文件。从蛋白数据库(简称PDB)下载人酪氨酸酶蛋白(PDB: 5m8t; https://www.rcsb.org),进行去水加氢操作,准备蛋白分子。设置对接区域的中心坐标为120.892,277.987,217.11 (X,Y,Z),区域半径为12Å。使用DS3.5软件中的CDOCKER板块 [7] ,CDOCKER是一个基于CHARMm的半柔性分子对接工具,进行小分子与蛋白活性中心进行对接。具体操作步骤如下:
1) 采用高温分子动力学与不同的随机种子产生一系列配套构象。
2) 通过配体指向到受体活性位点的指定位置并进行一系列的随机旋转,产生随机构象。直至获得所需数目的低能量构象。
3) 对每个最终构象,它们的CHARMm 能量以及单独的相互作用能力被计算出来,根据能量值对构象进行排序和保留。定义整个靶点蛋白结构域为受体,根据原配体的结合位置选择位点球体所在的位置,除去原配体并将需要结合的配体填充进去,以此来进行分子对接的过程。根据分子对接的得分情况进行排序,保留每个配体前十位的分子对接构象,具有最大的负 CDocker 能量的构象被选为最佳构象。
3.2. 细胞培养
人黑色素瘤细胞培养于1640培养液中,放置于37℃、5%二氧化碳培养箱,待细胞长满培养瓶底后在无菌的环境下先倒掉原培养液,再用PBS缓冲液冲洗几次,最后用配制好的胰蛋白酶消化。待消化好弃去胰酶液体,加入少许新鲜培养液终止消化,轻轻吹打,使得细胞处于单个分散的状态。收集细胞离心,弃去上层液体,再加入一定量的培养液,轻轻吹打使细胞呈单个分散状,并使用细胞计数板计数。用培养基将细胞调整至适当浓度,接种于细胞板放入培养箱培养 [8] [9] ,每一次实验应采用同一传代细胞。
3.3. 药物处理
光甘草定和Vc首先用DMSO助溶,然后用蒸馏水稀释,要保证DMSO的最终加入浓度低于0.1%。现配现用,待测药物浓度和Vc浓度分别为:12.50,25.00,50.00,100,150,200 μM。
3.4. MTT法检测黑色素瘤细胞A357的增值
在96孔细胞板每孔中分别加入90 µL含有人黑色素瘤细胞的培养液,待细胞稳定生长并占每孔底部面积80%左右时加入待测药液。每个待测药物的浓度设3个平行,三次重复实验。实验组分为:空白对照组(90 µL培养液)、阴性对照组(90 µL含细胞的培养液)、阳性对照组(90 µL含细胞的培养液和10 µL不同浓度的Vc溶液)待测药物实验组(90 µL含细胞的培养液和10 µL不同浓度的光甘草定)。将加药后的细胞板放置二氧化碳培养箱(温度为37℃,CO2浓度为5%)进行培养。培养24 h后,向待测96孔板每孔各加入配好的MTT液10 μL,轻轻振荡混匀,继续在特定条件的培养箱中进行培养4 h。随后弃去96孔板上清液,每孔再加入150 μL的DMSO,充分震荡数分钟,于酶标仪570 nm波长处测定各孔的光吸收(OD值) [10] 。根据所测的各孔OD值使用SPSS软件 [11] 计算待测药物的IC50 (IC50为半数抑制浓度)。
3.5. 人黑色素瘤细胞中酪氨酸酶活性测定
实验具体操作步骤参照人酪氨酸酶ELISA酶联免疫分析试剂盒使用说明书。
4. 实验结果
4.1. 光甘草定与酪氨酸酶计算模拟对接结果
我们利用DS3.5软件进行了光甘草定与人酪氨酸酶活性位点的模拟对接,其理论活性值很高,CDOCKER_INTERACTION_ENERGY值为−32.6878。然后我们用软件计算了光甘草定的ADMET活性。良好的药物小分子,无论是应用于食品、药品还是化妆品领域,不仅需要具有较高的功效,并且还需要有良好的药代动力学特征。从图1中我们可以看出,光甘草定的点位于所有圆圈的内部,说明它具有良好的药代动力学特征。图2为光甘草定与酪氨酸酶相互作用的二维平面图,图3为光甘草定与酪氨酸酶相互作用的三维立体图。从图中可以看出,光甘草定分子非常完美的嵌合进入酪氨酸酶的活性穴槽空腔中,光甘草定含有双羟基的苯环与酪氨酸酶的氨基酸残基HIS 38及HIS377形成了两个π-cation键,另外一个苯环与氨基酸残基Phe 362形成了一个π-π相互作用力。π键是最常见也是最重要的分子间相互作用力,对稳定生物大分子的构型十分重要,在生物分子中有着重要的意义和作用。通过计算模拟结果及结合模型图我们可以推断,光甘草定美白的作用机制可能是通过与酪氨酸酶活性位点组氨酸与苯丙氨酸相互作用从而抑制酪氨酸酶产生的。

Figure 1. ADMET properties predicted for Glycyrrhizin
图1. 光甘草定AEMET预测图
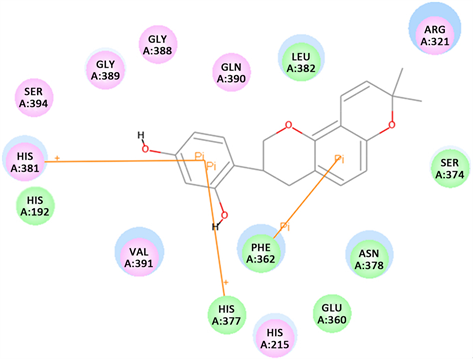
Figure 2. 2D molecular docking model of Glycyrrhizin with Tyrosinase
图2. 光甘草定与酪氨酸酶相互作用的二维平面图

Figure 3. 3D interaction map of Glycyrrhizin with Tyrosinase
图3. 光甘草定与酪氨酸酶相互作用的三维立体图
4.2. 光甘草定对黑色素瘤细胞A357的增殖抑制活性
实验通过MTT法测定光甘草定对A357细胞的增值抑制作用,实验结果如表1所示。从表1我们可以看出,细胞抑制率跟光甘草定的纯度有很大关系,IC50值分别为126 μM和66 μM。

Table 1. In vitro inhibitory activities against human A357 cell lines.
表1. 光甘草定对A357细胞的增值抑制实验
4.3. 光甘草定对酪氨酸酶的增殖抑制活性
实验通过ELISA酶联免疫试剂盒测定光甘草定对人酪氨酸酶的增值抑制作用,实验结果如表2所示。从表2我们可以看出,酶抑制率同样跟光甘草定的纯度有很大关系,IC50值分别为263 μM和155 μM。

Table 2. In vitro inhibitory activities against Tyrosinase.
表2. 光甘草定对酪氨酸酶的增值抑制实验
5. 讨论与结论
光甘草定是从天然产物草本植物中提取的具有较好美白作用的生物活性成分,本论文从计算机模拟、细胞增殖抑制实验及酪氨酸酶活性抑制实验三方面探索光甘草定的美白机理。计算机辅助药物设计软件结果显示,光甘草定结构中的苯环与酪氨酸酶的氨基酸残基HIS和PHE形成π-cation键及π-π键,光甘草定分子因此可以完美地嵌合进入酪氨酸酶的活性穴槽空腔中发挥抑制作用。此外,纯度为90%的光甘草定在细胞水平对黑色素瘤细胞的抑制活性大约是Vc的2倍,IC50为66 μM。而在酶水平,纯度为90%的光甘草定对酪氨酸酶的抑制活性跟Vc几乎一致,IC50为155 μM。这表明,光甘草定中除主要成分外,有可能其他成分之间存在协同作用,对黑色素瘤细胞有很好的抑制活性,而其他成分的作用靶标不是酪氨酸酶。所有成分协同作用,有效地抑制黑色素的生成。
光甘草定对皮肤刺激性或过敏性反应极少,应用相对安全可靠,其理化性质稳定,皮肤吸收能力强,用量少,光甘草定作为化妆品美白添加剂具有一定的应用前景,是一种有市场潜力的酪氨酸酶抑制剂。
基金项目
本论文在江苏省自然科学基金青年基金项目(BK20160570)支持下完成。