1. 引言
金属有机框架(Metal organic frameworks, MOFs)是由有机桥连配体通过配位键将无机金属离子或离子簇和有机配体连接在一起形成的具有延展性的网状新型有机材料 [1] ,MOFs的结构示意图如图1所示。由于MOFs具有超高比表面积、可调节孔径、晶体结构易修饰、易化学功能化、生物可降解性和良好的生物相容性 [2] [3] [4] 等优点,故可作为良好的药物载体。UiO-66-NH2是由金属离子Zr与氨基对苯二甲酸通过配位作用 [5] 结合成的具有多孔性的正八面体结构的MOFs材料 [6] ,热稳定性高,可有效防止结构坍塌,在水、N,N-二甲基甲酰胺、丙酮、苯等溶剂中可以维持晶型结构稳定性,还具有很强的耐碱性和一定的耐酸性 [7] 。
Figure 1. The structural representation of MOFs (image from Baidu Pictures)
图1. MOFs的结构示意图(图片来源百度图片)
甘草次酸(GA)是从传统中药材甘草中提取分离出的一种活性甘草酸苷元,临床研究表明在肝细胞膜上镶嵌着许多GA特异性受体,GA可与GA受体特异性结合,以实现肝靶向性。目前,将GA作为靶向基团修饰药物载体已成为治疗肝癌的研究热点。本研究首先合成制备出金属有机框架载体UiO-66-NH2,然后在UiO-66-NH2结构上修饰GA,可以获得具有良好肝靶向性的药物载体UiO-66-NH2-GA,UiO-66-NH2-GA作为装载肝癌药物的载体可以显著提高肝癌药物的治疗效果,提高用药安全性。
本研究选择5-FU作为模型药物对UiO-66-NH2-GA的载药能力进行表征。
本研究使用红外光谱法(IR)和差式扫描量热法(DSC)对UiO-66-NH2-GA载药能力进行相关表征。使用X射线衍射法(XRD)及扫描电镜(SEM)对UiO-66-NH2、UiO-66-NH2-GA和5-FU@UiO-66-NH2-GA的晶型结构进行表征 [8] 。最后采用MTT法对肝癌细胞HepG2测试5-FU@UiO-66-NH2-GA的体外抗肿瘤活性。
2. 实验材料
Shimadzu FTIR-8400S红外光谱仪(日本岛津公司),梅特勒-托利多Stare系统DSC1热分析仪(北京恒久科学仪器有限公司),Bruker D8 Advance X射线衍射仪(北京圣嘉宸科贸有限公司),JEM-2100型高分辨透射电子显微镜(日本电子株式会社),Tecan酶标仪(北京普天新桥技术有限公司),UV-2550紫外分光光度仪(日本岛津分析仪器有限公司),Thermo恒温培养箱(上海科辰实验设备有限公司),Agilent 1200高效液相色谱仪(日本岛津分析仪器有限公司)。
氨基对苯二甲酸(含量质量分数 ≥ 98%,天津市永大化学试剂有限公司),N,N-二甲基甲酰胺(DMF) (色谱纯,天津市永大化学试剂有限公司),四氯化锆(ZrCl4) (含量质量分数 ≥ 99.9%,天津市瑞金特化学品有限公司),5-FU (含量质量分数 ≥ 99.9%,阿拉丁试剂上海有限公司),甘草次酸(含量质量分数 ≥ 98%,阿拉丁试剂上海有限公司),人肝癌细胞HepG2 (辽宁大学药学院提供),MTT (含量质量分数 ≥ 99%,阿拉丁试剂上海有限公司)。
3. 实验方法
3.1. UiO-66-NH2的合成
利用一锅法 [9] 合成制备UiO-66-NH2,制备工艺如下:称取1.0 g ZrCl4与0.75氨基对苯二甲酸,置于50 mL圆底烧瓶中,加入29 mL乙酸与67 mL N,N-二甲基甲酰胺(DMF),最后加入5 mL去离子水充分混匀。将圆底烧瓶置于100℃油浴中反应15 min,得淡黄色混悬液,冷却至室温,转移至50 mL离心管中离心(5000 r/min, 15 min)。然后用无水乙醇洗涤、超声(40 Hz, 5 min)、离心(5000 r/min, 15 min),洗涤过程重复三次。离心后将产物置于60℃鼓风干燥箱中进行干燥,得UiO-66-NH2,计算产率为87%。
3.2. UiO-66-NH2-GA的合成
称取UiO-66-NH2 185 mg,GA 270 mg和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl) 85.5 mg,置于50 mL圆底烧瓶中,加入25 mL DMF,室温搅拌反应24 h (用封口膜将圆底烧瓶口封住,防止DMF挥发),超声除杂,离心(5000 r/min, 15 min)得产物,将产物置于冻干机冻干10 h,获得UiO-66-NH2-GA,合成路线如图2所示。
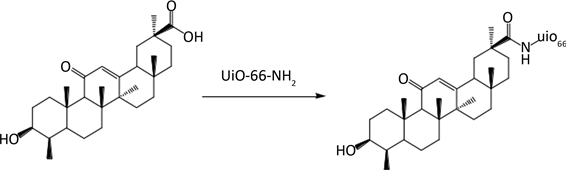
Figure 2. The synthesis route of UiO-66-NH2-GA
图2. UiO-66-NH2-GA合成路线如图
3.3. 5-FU@UiO-66-NH2-GA的制备
称取0.3 g 5-FU溶于10 mL去离子水,称取UiO-66-NH2-GA 0.1 g溶于10 mL乙醇,将两种溶液充分混匀,超声10 min后剧烈搅拌使其蒸发至2 mL。将混悬液转移至离心管进行离心(10,000 r/min, 5 min),保留上清液,用5 mL甲醇洗涤产物三次以除去在产物表面吸附的5-FU,保留洗涤液。将产物置于冻干机冻干10 h,得到5-FU@UiO-66-NH2-GA。将上清液与洗涤液充分混匀,取适量稀释至适宜浓度进高效液相色谱仪测定未装载的5-FU的量,与5-FU的初始浓度进行比较,计算载药率。
4. 结果与表征
4.1. 5-FU的载药率评价
4.1.1. 检测波长的确定
精密称取0.1 mg 5-FU置于50 mL烧杯中,加入适量甲醇,充分溶解后转移至10 mL容量瓶定容,得到10 mg/L的5-FU甲醇溶液,以甲醇作为空白对照,在200~500 nm扫描波长内对样品进行紫外扫描,得图3,确定5-FU在266 nm处有最大吸收波长,故选择266 nm作为高效液相色谱的检测波长。

Figure 3. The UV-scanning spectrum of 5-FU in methyl alcohol
图3. 5-FU在甲醇中的UV扫描图
4.1.2. 标准曲线的建立
液相色谱条件:
Agilent 1200高效液相色谱仪,配套DAD检测器;
色谱柱:C18反相柱,(4.6 × 250 mm, 5 μm);
柱温:25℃;
检测波长:266 nm;
流动相:甲醇:水 = 10:90;以磷酸调pH为6.2
流速:0.8 mL/min;
进样量:20 µL;
精密称取1 mg 5-FU标准对照品,加入去离子水配制成浓度为0.1 mg/mL的标准储备液,继续稀释成浓度梯度为5,10,20,40,80,160 μg/mL的溶液,每个浓度样品分别进样3针,5-FU在甲醇-水(10:90)流动相中的色谱图如图4所示,计算线性回归方程,得图5。
回归方程:A = 117.53C + 696.18,R = 0.9999;
线性范围:0~160 μg/mL;
保留时间:7.62 min。
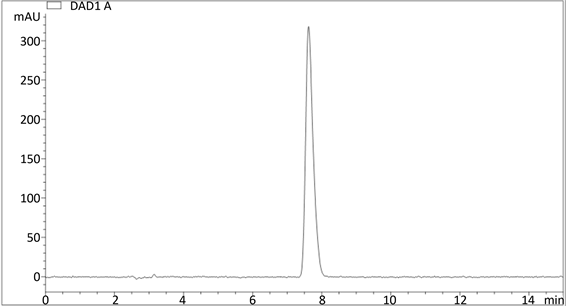
Figure 4. The chromatograph of 5-FU (methanol-water 10:90, v/v)
图4. 5-FU在甲醇-水(10:90)流动相中的色谱图
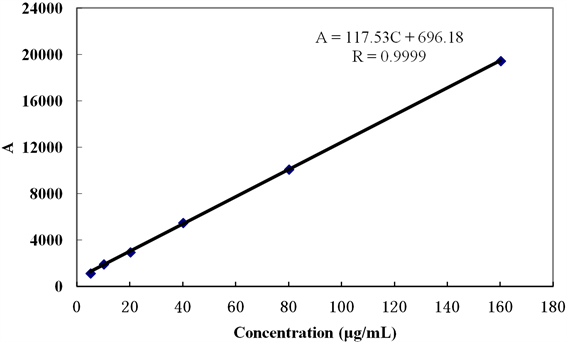
Figure 5. The standard curve map of 5-FU
图5. 5-FU标准曲线图
4.1.3. 载药率的测定
取3.3中制备5-FU@UiO-66-NH2-GA时保留的上清液,进行适度稀释后进高效液相色谱仪检测上清液中的5-FU含量,与载药前加入5-FU的初始量进行比较,结果表明采用浸渍法可以有效实现UiO-66-NH2-GA对5-FU的装载,且载药率高达80.9 %。
4.2. 红外光谱表征
使用红外光谱仪对5-FU、UiO-66-NH2、5-FU@UiO-66-NH2-GA和5-FU与UiO-66-NH2-GA的物理混合物(5-FU&UiO-66-NH2-GA)进行表征。分别称取少量的5-FU、UiO-66-NH2、5-FU@UiO-66-NH2-GA和5-FU&UiO-66-NH2-GA粉末与KBr混匀 [10] ,用玛瑙研钵研磨成粉末后,压制成透明薄片,用红外光谱仪测定,分析特征吸收峰,扫描范围为4000~400 cm−1。
<img src=//html.hanspub.org/file/4-1710184x15_hanspub.png width=850.374984741211 height=706.25 class=100 />
A—5-FU;B—UiO-66-NH2-GA;C—5-FU@UiO-66-NH2-GA;D—5-FU&UiO-66-NH2-GA
图6. 5-FU、UiO-66-NH2-GA、5-FU@UiO-66-NH2-GA和5-FU&UiO-66-NH2-GA (5-FU与UiO-66-NH2-GA的物理混合物)的红外光谱图
如图6所示,其中UiO-66-NH2-GA对应的谱图:3500~3000 cm−1区域宽峰,对应于O-H伸缩振动峰;1650~1570 cm−1对应OCO不对称伸缩振动峰;1440~1380 cm−1对应OCO对称伸缩振动峰;1220~1300 cm−1对应C-N伸缩振动峰。
5-FU对应的谱图:1680~1630 cm−1对应C=O伸缩振动峰;1655~1590 cm−1对应N-H弯曲振动峰,载药后该峰仍存在,可得5-FU已成功载入UiO-66-NH2-GA中。
5-FU@UiO-66-NH2-GA和5-FU&UiO-66-NH2-GA的红外光谱图对比表明,5-FU@UiO-66-NH2-GA和5-FU&UiO-66-NH2-GA的红外谱图明显不同,说明5-FU已经成功载入UiO-66-NH2-GA中,而不是两种物质的简单物理混合。
4.3. DSC表征
采用差示扫描量热法对5-FU、UiO-66-NH2-GA、5-FU@UiO-66-NH2-GA和5-FU&UiO-66-NH2-GA进行分析表征,测验温度范围为25℃~400℃,以10 ℃/min升温速率测定样品的DSC曲线,检验UiO-66-NH2-GA和5-FU@UiO-66-NH2-GA的热稳定性并对比载药是否成功 [11] 。对比图7四条热吸收曲线可知,5-FU@UiO-66-NH2-GA与UiO-66-NH2-GA类似,未出现5-FU的吸收峰。5-FU@UiO-66-NH2-GA和5-FU&UiO-66-NH2-GA的热吸收曲线明显不同,说明5-FU被包载到载体UiO-66-NH2-GA中,而不是两种物质的简单物理混合。
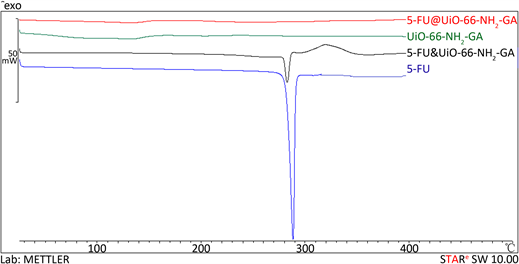
Figure 7. The DSC chromatograms of 5-FU, UiO-66-NH2-GA, 5-FU@UiO-66-NH2-GA and 5-FU&UiO-66-NH2-GA (physical mixture of 5-FU and UiO-66-NH2-GA)
图7. 5-FU、UiO-66-NH2-GA、5-FU@UiO-66-NH2-GA和5-FU&UiO-66-NH2-GA (5-FU与UiO-66-NH2-GA的物理混合物)的DSC图谱
4.4. XRD表征
使用X射线衍射仪来表征5-FU、UiO-66-NH2-GA、5-FU@UiO-66-NH2-GA和5-FU&UiO-66-NH2-GA,称取适量干燥的5-FU、UiO-66-NH2-GA、5-FU@UiO-66-NH2-GA和5-FU&UiO-66-NH2-GA粉末加入到X射线衍射仪中得到相应的衍射曲线,如图8所示,UiO-66-NH2-GA和5-FU@UiO-66-NH2-GA的晶型结构类似,均有高强度的尖锐衍射峰,形态结构稳定。在2θ = 7.46˚、12.09˚、14.21˚、16.85˚、22.38˚、31.32˚处出现特征峰,分别与(111),(022),(113),(004),(115),(121)晶面相对应 [12] 。载药前后UiO-66-NH2-GA的晶型结构未发生改变,说明载药过程不会影响UiO-66-NH2-GA的晶型结构。
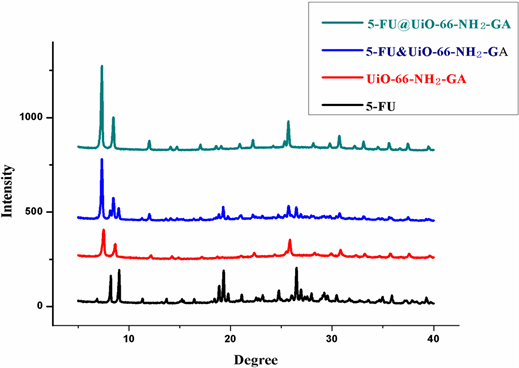
Figure 8. The XRD images of morphology of 5-FU, UiO-66-NH2-GA, 5-FU@UiO-66-NH2-GA and 5-FU& UiO-66-NH2-GA (physical mixture of 5-FU and UiO-66-NH2-GA)
图8. 5-FU、UiO-66-NH2-GA、5-FU@UiO-66-NH2-GA及5-FU&UiO-66-NH2-GA (5-FU与UiO-66-NH2-GA的物理混合物)的XRD图谱
4.5. SEM表征
通过扫描电子显微镜观察5-FU@UiO-66-NH2-GA的表面结构形貌特征 [13] ,如图9所示,5-FU@UiO-66-NH2-GA的晶型结构完整,呈正八面体结构,粒径分布均匀,粒径为200 ± 10 nm。载药后的UiO-66-NH2-GA晶体结构仍然呈良好的正八面体结构,说明载药过程对UiO-66-NH2-GA的晶型结构未产生影响。

Figure 9. The SEM images of morphology of UiO-66-NH2-GA and 5-FU@UiO-66-NH2-GA
图9. UiO-66-NH2-GA与5-FU@UiO-66-NH2-GA的SEM图像
4.6. 5-FU的体外释放研究
使用正向动态透析法 [14] 对5-FU的释放进行测定,分别配制pH = 7.4,pH = 6.5,pH = 5.5的PBS缓冲溶液作为释放介质,精密称取适量5-FU@UiO-66-NH2-GA分散在5 mL的PBS缓冲溶液中,置于透析袋(MWCO: 3500 D)中,将透析袋紧密密封后放入盛有250 mL PBS缓冲溶液的锥形瓶中,在37℃恒温振荡器中震荡(100 r/min)。分别于0.5、1、1.5、2、3、4、6、8、10、12、24、36、48、60、72 h各时间点取2 mL PBS释放介质,及时补充新鲜PBS缓冲溶液。计算各时间点的累积释放率,各时间点的累积释放率(Q)计算公式为:
式中Ct为各时间点测得释放介质中的药物浓度(mg/mL),W为投入药物的总量(mg),V0为释放介质的总体积,V为每次取样的体积。
如图10所示,5-FU@UiO-66-NH2-GA在pH 5.5时表现出较高的累积释放率,对不同pH下的释放曲线进行分析,当pH = 5.5时,5-FU在前12 h释放迅速,约70%,48 h后稳定在84%,48 h基本释放完全;当pH = 6.5时,在前12 h释放迅速,约60%,48 h后稳定在73%,48 h基本释放完全;pH = 7.4时,在前12 h释放迅速,约50%,48 h后稳定在56%,48 h基本释放完全。
4.7. 5-FU@UiO-66-NH2-GA的体外抗肿瘤活性研究
本研究采用MTT法对比考察5-FU@UiO-66-NH2-GA和5-FU的体外抗肿瘤的活性。
MTT溶液的配制:称取0.5 g MTT粉末,溶于100 mL PBS缓冲液中,最终获得浓度为5 mg/L的

Figure 10. The release profile medias of 5-FU@UiO-66-NH2-GA in pH 5.5, 6.5, 7.4
图10. 5-FU@UiO-66-NH2-GA在pH 5.5、pH 6.5和pH 7.4释放介质中的释放曲线图
MTT溶液,超声促进溶解,在超净实验台中用0.22 μm无菌滤膜过滤除去溶液中的细菌,在−20℃冰箱冷冻避光保存。
本研究选用人肝癌细胞HepG2作为MTT检测对象,收集对数期的HepG2细胞,调细胞密度至10万/mL,向96孔板每孔中加入100 μL细胞悬液,置于含5 % CO2,37℃的恒温培养箱中孵育,培养24 h后,加入浓度梯度的5-FU及5-FU@UiO-66-NH2-GA药物,设7个梯度,分别为100、200、400、600、800、1000、1200 μmol/L,设一组空白对照,空白对照组每孔加入100 μL不含胎牛血清的DMEM培养液,设6个复孔,培养24 h,加入20 μL MTT溶液,继续培养4 h,弃去培养液,加入200 μL的DMSO,置振荡器振荡5 min,在酶标仪OD = 490 nm处测量各孔的吸光度。最后计算各组IC50值。MTT试验重复五次,筛选最佳结果,结果如图11所示。
MTT试验结果如下:
5-FU@UiO-66-NH2-GAIC50 = 869 μmol/L
5-FU IC50 = 1095 μmol/L
结果表明5-FU@UiO-66-NH2-GA的IC50值明显小于单独使用5-FU时的IC50值,说明使用UiO-66-NH2-GA材料作为5-FU的药物载体可以明显提高5-FU的抗肿瘤效果。
5. 结果与讨论
本研究选用氨基对苯二甲酸作为有机配体与金属离子Zr通过一锅法构建得到生物相容性良好的、稳定的MOFs材料UiO-66-NH2,采用一锅法合成UiO-66-NH2效率高,操作简便,产量高。在UiO-66-NH2的表面进行化学修饰GA,成功得到UiO-66-NH2-GA。通过浸渍法,将广谱抗癌药物5-FU装载进UiO-66-NH2-GA中,得到5-FU@UiO-66-NH2-GA,载药实验结果表明,5-FU@UiO-66-NH2-GA的载药率为80.9%。红外光谱法对UiO-66-NH2-GA和5-FU@UiO-66-NH2-GA的表征结果表明,5-FU成功包载进UiO-66-NH2-GA中;采用差式扫描量热法对UiO-66-NH2-GA材料的热稳定性的研究结果表明,
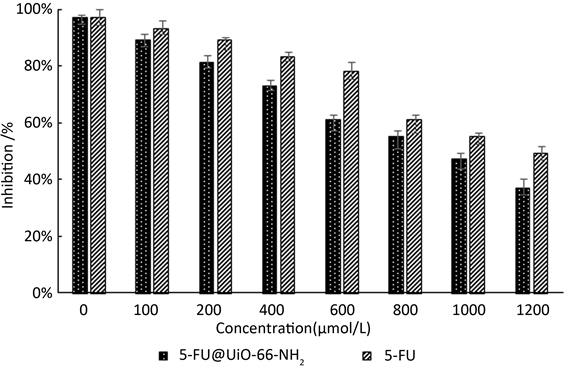
Figure 11. The IC50 of 5-FU@UiO-66-NH2-GA and 5-FU
图11. 5-FU@UiO-66-NH2-GA与5-FU的IC50值
UiO-66-NH2-GA具有较强的热稳定性,在400℃仍保持结构稳定;X射线衍射法的结果表明UiO-66-NH2-GA与UiO-66-NH2的晶型结构类似,均出现高强度的尖锐衍射峰,特征峰明显;扫描电镜结果表明5-FU@UiO-66-NH2-GA的结构完整,呈正八面体结构,粒径为200 nm左右,且载药过程不会影响UiO-66-NH2-GA的晶体结构;药物释放结果表明5-FU@UiO-66-NH2-GA在pH 5.5时表现出较高的累积释放率,由此可见,装载抗癌药物的UiO-66-NH2-GA在肿瘤微环境中更容易将药物释放出来,具有pH响应性;MTT法测试5-FU@UiO-66-NH2-GA对肝癌细胞HepG2的体外抗肿瘤活性的实验结果表明,5-FU@UiO-66-NH2-GA表现出较高的抗肿瘤活性,比单独使用5-FU的效果更好。
本实验成功制备出新型药物载体UiO-66-NH2-GA,为肝癌治疗药物提供一个良好的药物载体,为UiO-66-NH2-GA作为肝靶向性化学治疗药物载体提供了理论基础。
基金项目
辽宁省自然科学基金资助项目(材料联合基金) (项目编号:20180510016)。