1. 引言
在植物组织培养过程中,菌类污染是经常遇到并难以解决的问题之一。污染率过高,会导致生产成本增加,浪费人力、物力和财力。因此如何控制污染,把污染率降低到可以接受的范围是组培工厂化生产亟待解决的问题。
目前,关于植物组织培养污染的研究主要集中在污染的原因及防控措施方面。采用一种或几种抗生素混合溶液对外植体进行预处理可以有效减少一些植物组培污染,但有些种类抗生素不利于试管苗的生长分化 [1] [2] [3] [4] 。J. Fisse等用头孢菌素II和链霉素消除植物外植体中内生菌效果好。在培养基中加入氨中塞肟头孢菌素和头孢菌素可以消除苹果组织培养中革兰氏阳性菌 [5] 。刘静等采用正交设计实验比较了不同植物杀菌剂与抗生素的混合物对植物组培污染的防治研究 [6] 。植物源抑菌剂具有低毒、低残留、对组培苗伤害小等特点,李白等采用不同提取方法获取生姜、洋葱、大蒜和苦瓜提取物,探讨植物提取物对组培生产中污染细菌的抑制作用 [7] 。李晓燕对常用的化学农药、医用抗生素、植物源杀菌剂、消毒剂、防腐剂及植物生长延缓剂缩节胺等39种抑菌剂对植物组织培养过程中的常见菌类进行了体外抑菌能力比较研究,并初步研究了抑菌剂对组培苗生长分化的影响 [8] 。
关于植物组织培养过程中的菌类污染种类的鉴定研究较少。周俊辉等以组培实验室中污染的组培苗为材料,进行污染菌的分离纯化,经纯菌培养镜检得出引起组培苗污染的菌类主要是棒杆菌属、曲霉属、肠杆菌属、地霉属、葡萄球菌属、毛霉属和根霉属。并通过实验得出庆大霉素对细菌的抑制能力较青霉素、四环素强 [9] 。方丽等将浙江省杭州和宁波的植物组培生产车间的污染物进行分离纯化和培养,得出主要的污染细菌为芽孢杆菌属和假单胞菌属,芽枝霉、黑曲霉、青霉和酵母为主要污染真菌。污染物的数量,真菌污染与细菌污染的比例呈现季节性变化,夏季和秋季是污染的高发期 [10] 。
天女木兰(Magnolia sieboldii K. Koch)是集观叶、赏花、赏果于一体的珍稀濒危植物 [11] 。全株含有芳香油,其提取物中含有活性成分,具有一定的药用价值 [12] [13] [14] 。目前,由于生境被破坏及天然更新难,天女木兰种群数量日益减少。通过植物组织培养技术可以获得再生植株,但存在污染严重、褐化现象及生根率低等问题 [15] [16] ,控制污染是根本,因此,本文以天女木兰组培中出现的污染菌为研究对象,采用划线法分离纯化微生物,选用特异引物扩增16S rDNA序列,测序与数据库中已知细菌比对确定天女木兰组培污染菌的种类,根据菌类的特性采取合理的措施以减少天女木兰在组培过程中的污染,同时也为其它植物组培污染问题提供参考。
2. 材料与方法
2.1. 试验材料与处理
试验材料采自吉林农业科技学院种植园。于5月、6月晴天的午后,采集当年萌发的幼嫩或半木质化天女木兰枝条。采集的枝条处理:流水冲洗1 h,洗洁精溶液浸泡20 min,0.1% HgCl2消毒7 min,无菌水冲洗6次。
2.2. 试验方法
2.2.1. 培养基与试剂
1) B5培养基母液的配制
按照B5培养基的配方,分别配制B5大量元素母液(10倍),B5微量元素母液(200倍),B5铁盐母液(200倍)与B5有机物质母液(100倍)。各种化学试剂充分溶解,然后用容量瓶准确定容,最后移入试剂瓶中,贴好标签,放在4℃冰箱中保存待用。
2) 生长调节物质母液的配制
先用少量1 mol/L NaOH溶解生长素IBA,再用温热的蒸馏水定容配成0.5 mg/mL IBA母液;用少量1 mol/L HCL溶解细胞分裂素6-BA,再用温热的蒸馏水定容配成0.5 mg/mL 6-BA母液备用。
3) B5固体培养基的配制
琼脂粉6 g、蔗糖30 g,加水约800 ml,加热溶解。按照大量元素母液、微量元素母液、铁盐母液、有机物质母液和植物生长调节物质母液的顺序分别加入100 mL、5 mL、5 mL、10 mL,再加入6-BA母液2 mL,IBA母液0.6 mL,定容至1000 ml,用1 mol/L NaOH溶液调pH = 5.8。高压蒸汽灭菌后备用。
2.2.2. 接种与培养
将枝条剪成1 cm左右的带芽茎段接种在B5 + 1.0 mg/L6-BA + 0.3 mg/L IBA培养基,放在培养室内培养15 d。培养条件为:培养温度(23 ± 2)℃,光照强度1500 lx,光照时间10~12 h/d。
2.2.3. 污染菌分离纯化
组培瓶中出现污染现象时,对染菌瓶进行编号、拍照并记录各菌落特征,在无菌环境下取污染菌在LB固体培养基上划线分离,在28℃倒置培养1~2 d。取单菌落用YMA固体培养基划线纯化3次,得到纯化菌株。
2.2.4. 污染菌的分离与鉴定
1) 细菌DNA提取
取各菌株单菌落于5 mL LB液体培养基中培养过夜,取菌液200 μL,12,000 r离心2 min,弃上清,沉淀加100 μL 0.2% SDS,涡旋混匀,100℃处理10 min,12,000 r离心5 min,上清中含菌株的基因组DNA。
2) PCR扩增与检测
以提取的细菌基因组DNA为模板,用16S rDNA通用引物进行PCR扩增。上游引物均为BSF8 (5’-AGAGTTTGATCCTGGCTCAG-3’),下游引物1:BSR1541 (5’-AAGCAGGTCATCCAGCCGCA-3’) [17] ,下游引物2:Mlb 16 (5’-GGCTGCTGGCACGTAGTTAG-3’) [18] 。反应体系:30 μL (H2O:12.5 μL,2 × Taq酶:15 μL,引物1.5 μL,模板:1 μL)。PCR反应程序:95℃ 5 min;95℃ 20 s,59℃ 20 s,72℃ 1.5 min,30次循环;72℃ 2 min。用1%的琼脂糖凝胶电泳检测PCR扩增产物。
3) 16S rDNA片段的序列测定
将扩增效果良好的PCR产物委托上海美吉生物技术公司进行DNA序列测定,测序引物为PCR扩增用引物。
4) DNA序列整理及分析
测序结果经MEGA7.0软件去除无用序列后,递交在线NCBI核酸数据库分析,对各菌株进行核酸分类学鉴定。根据与数据库中已知菌株16S rDNA序列同源性确定菌株的种属。用Excel (BiodixcelforExcel2007.xlsx [19] )分析丰富程度、均匀程度、Shannon指数等多样性参数。用MEGA7.0软件进行DNA序列比对,选择NJ树法采用Bootstrap检测(1000次)对天女木兰组培污染菌进行聚类分析。
3. 结果与讨论
3.1. 结果
3.1.1. 天女木兰组培污染菌的分离与鉴定
采用划线分离法,从30瓶天女木兰组培污染样本中分离、纯化出105株菌,采用细菌16S rDNA序列核酸分类法从中鉴定了95株菌,其中引物BSF8-BSR1541鉴定出34株菌,引物BSF8-Mlb16鉴定出61株菌。从污染菌种类上看,天女木兰污染以银耳假单胞菌(29株)、丁香假单胞菌(21株)、柠檬酸菌(15株)为主,其中假单胞菌类约占60%,绝大多数为革兰氏阴性菌(表1)。

Table 1. Identification of bacteria in tissue culture of Magnolia sieboldii
表1. 天女木兰组培污染菌的鉴定
3.1.2. 天女木兰组培污染菌的多样性
天女木兰污染菌的多样性分析结果表明,污染菌优势度较高(Berger-Parker指数(d)),说明污染菌中有明显优势菌群,本文中鉴定的菌株中超过半数为假单胞菌属。污染菌总体丰富度并不太高,Margalef指数(dMa)为1.98,说明天女木兰污染菌来源并不是很多。Simpson指数(λ)值较低为0.18,说明污染菌群中优势菌群数量较多。污染菌整体群落多样性较低,Shannon指数(He')值为1.91,说明污染菌的来源并不复杂,在控制上相对较为容易。群落的均匀程度Pielou指数(Je)值为0.83,说明各菌群分布不均匀,存在某些优势或数量极少的种群(表2)。

Table 2. Diversity analysis of bacteria in tissue culture of Magnolia sieboldii
表2. 天女木兰组培污染菌的多样性分析
应用MEGA7.0软件对天女木兰组培污染菌进行聚类分析,结果见图1。分析显示,天女木兰的95株污染菌,基本上按扩增引物不同分成两枝。比较特殊的是BSF8-BSR1541组的菌株B8-45 (丁香假单胞菌),其序列在进化上与BSF8-Mlb16组更接近(图1)。
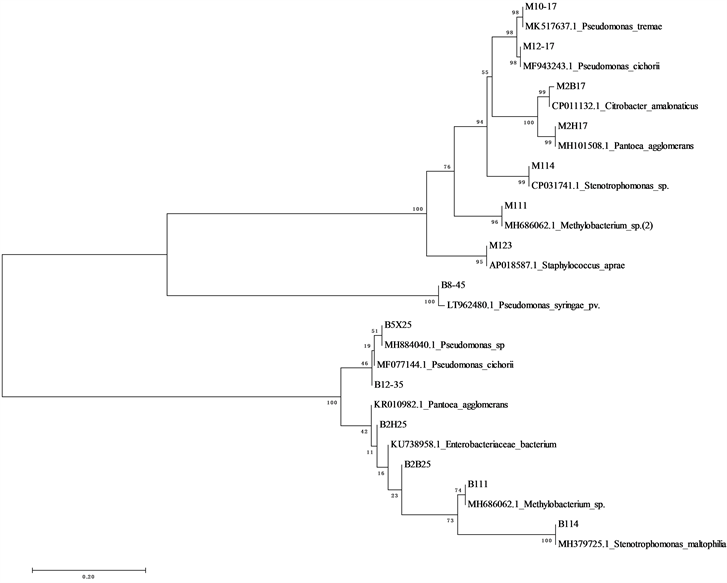
Figure 1. Cluster analysis of bacteria in tissue culture of Magnolia sieboldii
图1. 天女木兰组培污染菌的聚类分析图
3.2. 讨论
从天女木兰茎段外植体组织培养过程中分离纯化了95株污染菌株。多样性分析结果表明,天女木兰组培污染菌多样性较低,且存在明显优势菌群,在种群分布上不平衡,均一性较差,提示天女木兰污染菌种类较少,且主要为少数几类菌,因此,其组培污染菌在控制上难度相对较低。只要采取针对主要污染菌的抑制措施就能大幅度降低其污染机率。
天女木兰组培污染菌绝大多数为革兰氏阴性菌,该类细菌细胞壁中含较多脂类,因此在外植体样本处理时,用乙醇配合消毒剂使用,可能提高消毒剂作用效果,从而降低组培过程中的污染机率。另外,在培养基中可以考虑加入氨基糖苷类、利福霉素类和多黏菌素等对革兰氏阴性菌效果较好的抗生素,可进一步降低染菌机率。
天女木兰组培污染菌中除B8-45外,大多数在进化上较为接近,提示其污染的控制方法也大致相同。在实际中可参考革兰氏阴性菌的抑菌方法,可有效降低天女木兰组培染菌机率。
基金项目
北华大学大学生创新创业训练计划项目(201711923241),吉林省科技发展计划项目(20180201006NY)。
NOTES
*通讯作者。