1. 引言
补体系统大约包括30多种组分,常以无活性的酶原形式广泛存在于人和动物新鲜血清和组织液中。多种微生物、抗体–抗原复合物等物质可通过三条不同的途径激活补体,形成具有活性的产物,发挥趋化作用、调理作用、破坏目标微生物及免疫复合物的清除等生物学功能 [1] 。
近年来,我国水产养殖业发展迅速,随着高密度集约化养殖模式的大面积推广,使得鱼类细菌性疾病暴发较频繁,成为水产养殖面临的重要难题之一 [2] 。嗜水气单胞菌(Aeromonas hydrophila, A.h)是一种很常见的致病菌,可引发细菌性败血症,能感染斑马鱼、银鲫、草鱼、青鱼及中华鳖等绝大多数淡水鱼类,也能感染虾、蟹等水产养殖种类,造成巨大经济损失 [3] 。
本实验以模式动物斑马鱼为研究对象,采用荧光定量PCR技术研究了A.h浸泡处理对斑马鱼体内补体基因表达水平的影响,旨在探讨不同补体系统在鱼类免疫应答中的作用,从而进一步完善关于鱼类免疫机制的认识。
2. 材料和方法
2.1. 嗜水气单胞菌的培养
将A.h菌株接种于TSB固体培养基,28˚C培养24 h后挑取单菌落于TSB液体培养基中,振荡培养15 h后离心收集菌体并将其重悬于灭菌PBS中,梯度稀释后用血球计数板计数。取适量菌悬液加入1 L充分曝气的自来水中制成108 cells/ml 的A.h溶液。
2.2. 斑马鱼的饲养与处理
将花鸟虫鱼市场购买的斑马鱼饲养于玻璃缸内。缸内连续充气,温度控制在26˚C~28˚C左右,每天喂食2次。驯养两周后取15尾健康斑马鱼放入108 cells/ml [4] 的A.h溶液中,0 h (对照)、3 h、6 h、12 h和24 h各取3尾抽提总RNA,检测补体。
2.3. 总RNA的提取及cDNA的制备
将斑马鱼用DEPC水洗三次,除去多余水分后加入液氮迅速研磨,再加入适量TRIZOL并提取总RNA。用琼脂糖凝胶电泳检测RNA质量,若检测结果良好,则加入DNaseI消化后逆转录成cDNA。用跨内含子的β-actin引物对其进行PCR扩增(上下游引物为5’-CTCCGGTATGTGCAAGGC-3’和5’-GCTGGGCTGTTGAAGGTC-3’,扩增片段354 bp) [5] 。扩增结束后对产物进行电泳检测,若仅有特异性目的基因片段,说明无基因组污染,该cDNA可用于定量PCR分析;反之,需对总RNA重新消化并反转录。
2.4. Real-Time PCR分析
7个代表性补体基因的引物序列来自Wang等 [6] ,以β-actin基因作为参考基因 [7] 。各基因引物序列和扩增子长度见表1。
以普通PCR确定cDNA和引物质量后,按照SYBR GREEN Real-time PCR Master Mix说明书用定量PCR仪进行扩增。每个样品设3个平行,运行程序见表2。

Table 1. Primers used in quantitative PCR analysis
表1. 定量PCR分析中所用引物

Table 2. Quantitative PCR running procedure
表2. 定量PCR运行程序
*在每个循环的延伸阶段收集荧光信号。
2.5. 数据分析
定量PCR扩增结束后,根据参照基因和目的基因的Ct值,用相对Ct法(2–∆∆Ct)计算各基因的相对表达量 [8] 。最终结果用对照组C3表达量作参照。
3. 实验结果
3.1. A.h处理对斑马鱼C3表达水平的影响
C3是补体系统的关键成分,同时参与三条补体激活途径。A.h处理斑马鱼后C3的表达量变化见图1。处理6 h以内C3表达水平无显著变化,之后其表达水平迅速升高,在12 h达到峰值(2.807),之后C3表达水平快速降低,但24 h时其表达量(1.682)仍高于对照组。
3.2. A.h处理对斑马鱼Bf表达水平的影响
Bf是补体替代激活途径中的重要成分。由图2可以看出,A.h处理3 h时Bf的表达水平无显著变化,6 h时迅速升高并达到峰值(2.313),随后其表达水平快速降低,24 h时降至与对照组相当的水平。
3.3. A.h处理对斑马鱼C1r/s和C4表达水平的影响
C1r/s和C4都是经典激活途径中的重要补体成分。其中C1是经典激活途径中的起始成分,包括C1r和C1s两个组分;C4是是经典激活途径中第2个被活化的补体成分。对照组C1r/s和C4的表达水平(图3)显著低于C3和Bf。A.h处理后,C1r/s表达水平变化趋势与Bf十分相似,都从6 h开始升高并达到最高值(0.188),但A.h处理12 h后C4表达水平才开始上升并达到最高值(0.113)。之后,二者表达水平逐步降低,24 h时其表达水平仍高于对照组。
3.4. A.h处理对斑马鱼MBL和MASP表达水平的影响
MBL和MASP是凝集素途径的重要成分。从图4可以看出,MBL和MASP的含量相差较大,但二者表达水平(分别为0.351和0.006)均显著低于C3和Bf。A.h处理斑马鱼6 h后MBL表达水平开始升高并在12 h升至最高值(0.611),之后表达水平快速降低,在24 h时略低于对照组。与MBL类似,MASP也从A.h处理6 h后开始上调表达并迅速达到峰值(0.013),之后其表达水平逐渐下降,但24 h时其表达
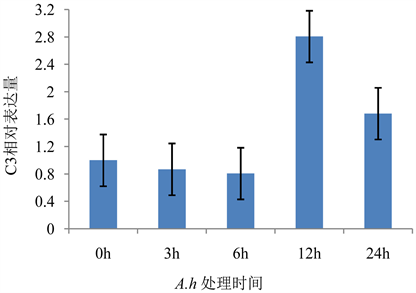
Figure 1. Changes on the expression of C3 in zebrafish during A.h infection
图1. A.h处理对C3表达水平的影响
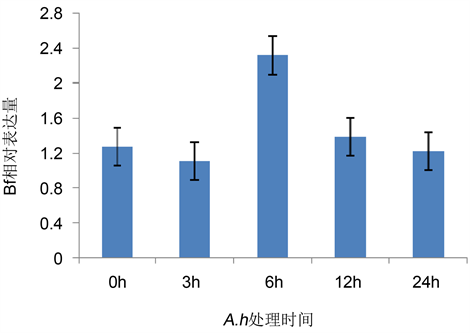
Figure 2. Changes on the expression of Bfin zebrafish during A.h infection
图2. A.h处理对Bf表达水平的影响
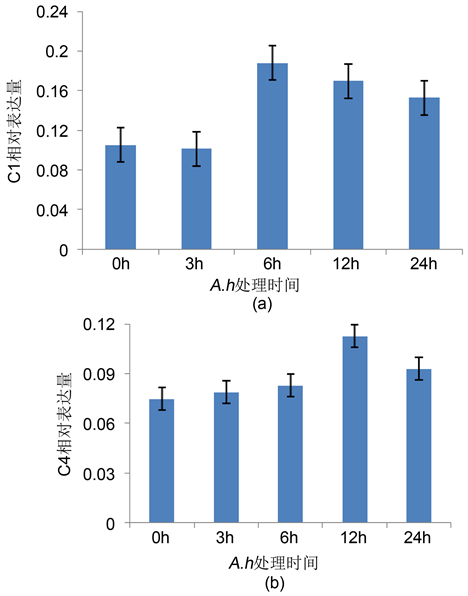
Figure 3. Changes on the expression of C1r/s (a) and C4 (b) in zebrafish during A.h infection
图3. A.h处理对C1r/s (a)和C4 (b)表达水平的影响

Figure 4. Changes on the expression of MBL (a) and MASP (b) in zebrafish during A.h infection
图4. A.h处理对MBL (a)和MASP (b)表达水平的影响
水平仍略高于对照组。
3.5. A.h处理对斑马鱼C6表达水平的影响
C6在终末途径中有重要作用。由图5知,对照组C6表达水平(0.373)与MBL相当,A.h处3 h后C6表达水平开始缓慢升高并在6 h达最高值(0.512),此后逐步降低,24 h时表达水平与对照组持平。
4. 讨论
本试验发现,以A.h处理斑马鱼成体后,C3、MBL和Bf的表达水平都是先降低后升高,之后再降低。其中,C3和MBL在12 h达到最高值,Bf在6 h达到最高值。相比之下,C1、C4、C6和MASP从处理3 h后便开始逐步升高,其中C1、C6和MASP在处理6 h后达到峰值,而C4在处理12 h后达到峰值。另外,除C3和MBL在处理24 h时其表达水平降至低于对照组的水平,其他基因在处理24 h后的表达水平仍高于对照组。由此可知,补体系统可在短时间内对外界的感染做出有效应答,但是不同基因应答模式不同,可能与不同补体成分及补体激活途径在机体免疫中的作用差异有关。
鱼类养殖中容易暴发大规模的传染性疾病而死亡,给水产养殖行业带来巨大的经济损失。另外,一旦鱼病暴发,后期的治疗通常起效甚微。因此,水产养殖中,对于鱼病的防控要重于鱼病的治疗。提高鱼类免疫力是进行病害免疫防治的有效措施之一。因此,水产养殖中应积极探索提高鱼类免疫力的有效措施。
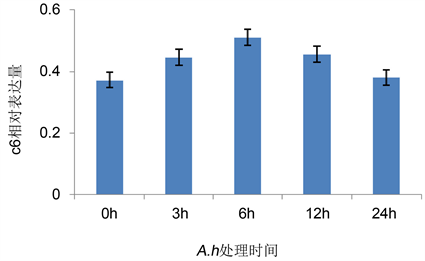
Figure 5. Changes on the expression of C6 in zebrafish during A.h infection
图5. A.h处理对C6表达水平的影响
基金项目
陕西省自然科学基金面上项目(2017JM3017)。