1. 引言
干旱作为植物生长的一个逆性环境,在作物培育和种植中是长期存在的,这与全球淡水资源有限是直接相关的,也是一直以来种植业中的全球性问题。通过提高植物自身的水分利用或者选择抗旱性强的品种来减少产量的损失是较为可行的一种手段。实际生产中的野生植物其实是处于干旱–复水–干旱–复水这样的一个循环过程 [1],但是干旱和复水对植物的影响是一个复杂的过程,二者均可以引起植物生长代谢和生理过程的变化,以试图平衡通过蒸腾作用和根系吸水所损失的水,同时仍保持相对高产,呈现出较强的抗旱性和恢复能力 [2] [3]。
水分胁迫带给植物最严重的影响就是破坏植物代谢平衡 [4] [5],尤其是会导致过量的活性氧自由基,包括过氧化氢、氢氧根离子和羟基自由基等,这些物质会损伤细胞膜。造成叶绿素含量的降低。活性氧的大量产生,会阻碍植物的正常生长发育,植物通过形成完整的防御机制来应对活性氧的损伤,其中抗氧化酶保护机制是植物缓解干旱胁迫的至关重要的生理机制 [6]。SOD、POD、CAT、APX等的共同作用下,可以及时的清除活性氧能,使得植物受到的损害降低。此外,在次生代谢产物中,酚类是植物组织中普遍存在的多功能次生代谢产物,在清除活性氧的过程中起到重要作用 [7]。酚类化合物对非生物胁迫具有显着的降低ROS和避免细胞损伤的潜力 [8]。复水后植物的快速恢复能力,一方面可以迅速减轻旱胁迫带来的损伤,同时以不同程度的补偿效应来减少干旱对植物产量造成的影响,对植物生产具有重要的意义,所以对干旱后植物的恢复能力的机制的研究相当重要。
皂角树又称皂荚树,是中国特有的豆科苏木亚科皂荚属树种之一。其木质坚硬,纹理漂亮,耐腐耐磨,为制作家具的上等良材。其根系发达,冠大荫浓,耐旱节水,耐热耐寒,抗污染性强,宜作庭荫树及绿化种,是不可多得的多功能生态树种。最为人关注的是皂角树的药用价值。皂角荚果和种子化学成分丰富,是医药食品的天然原料;皂角种子也是植物胶的原料之一,具有很高的经济价值。本文首次报道了利用液相色谱–质谱联用技术对PEG-6000模拟干旱胁迫以及复水后皂角幼苗的次级代谢进行研究。研究在不同干旱程度及复水条件下仍能保持恒定和产生差异的化合物,并研究它们之间代谢产物的变化以及综合抗旱能力。为皂角的种植,我们可以开始重新定义豆科落叶乔木这一物种的干旱胁迫模型。
2. 实验方法
2.1. 植物原料
皂角种子采摘于东北林业大学森林植物生态学教育部重点实验室植物园,用2%次氯酸钠消毒0.5 h后用蒸馏水洗净。将种子置于80℃温水中浸泡24 h,播种于蛭石中,置于温室中,每日喷洒蒸馏水,一周后,待幼苗长至7~9 cm时,选择株高、长势一致的健康幼苗移栽到盒子中,用Hoagland’s营养液培养两周,随后进行PEG-6000干旱胁迫实验。以上实验均在温室中进行,温室条件为相对空气湿度50%,26℃/18h~20℃/6h。参考浦婵 [9] 的研究方法,按轻度干旱到重度干旱胁迫设置12%和18%质量分数的PEG-6000进行胁迫。干旱胁迫培养14 d后,对处理幼苗进行拍照取样,进行测定。将质量分数18% PEG-6000处理的幼苗进行复水,14 d后,取样测定。
2.2. 叶绿素含量测定
光合色素的含量参考Jiang等方法测定 [10],稍作修改:精确称取0.2 g新鲜杜仲叶片,加入80%预冷的丙酮,研磨成匀浆于6000 rpm下离心15 min,抽取上清液测定其在665、649和480 nm波长下的吸光值,实验全过程保持在黑暗环境。
计算公式为:
2.3. 丙二醛含量测定
通过测量丙二醛(MDA)的浓度水平来评估脂质过氧化的程度。MDA测定利用TBA比色法 [11]。MDA的测量首先将叶子在5% (w/v)的三氯乙酸溶液中(TCA)中均化,并在沸水浴中与等体积的0.67% (w/v)的硫代巴比妥酸(TBA)反应30分钟。冷却至室温后,溶液以800 g离心5分钟,上清液用于532 nm分光光度仪测量。
2.4. 氧化酶活性的测定
抗氧化酶活性测定方法参照魏晓雪等方法 [12]:新鲜杜仲叶片0.5 g加入5 mL缓冲液(50 mM Na2HPO4-NaH2PO4缓冲液,PH 7.8,含1.0 mM EDTA,1% PVP,1 mM AsA),充分研磨成匀浆,在4℃下,8000 rpm,离心30 min,上清液即为酶的粗提取液。
APX活性测定是利用了其在有H2O2环境下,使抗坏血酸含量减少的原理来测定其酶活性,酶反应体系为:100 μL酶液、0.5 mM抗坏血酸、1 mM H2O2和0.1 mM EDTA充分混匀,在290 nm波长下,读取3 min内每15 s内变化的吸光度值。
CAT活性测定通过CAT促进H2O2分解,使反应体系于240 nm波长下吸光度值减小的原理测定该酶活性。酶活性测定反应体系含有10 mM H2O2的50 mM Na2HPO4-NaH2PO4的缓冲液(PH 7.2)和50 μL酶提取液,单位为U∙g−1∙min−1。
POD活性测定利用SOD在H2O2下将愈创木酚氧化的原理测定该酶活性。反应体系为50 mM Na2HPO4-NaH2PO4的磷酸缓冲液(PH 7.0),20.1 mM愈创木酚,12.3 mM H2O2和100 μL酶液,总体积为3 mL,充分混匀。在470 nm波长下读取3 min内每15 s的变化的吸光度值。
SOD活性测定利用NBT的光化还原法测定该酶活性。反应体系中加入反应所需试剂包括30 μL酶提取液和3.0 mL混合液(50 mM磷酸缓冲液,PH 7.8,0.1 mM Na2EDTA,13 mM甲硫氨酸,75 μmol∙L−1 NBT,16.7 μmol∙L−1核黄素)。剩余反应液试管放在荧光灯下照射10 min,关灯停止反应。在560 nm波长下检测吸光度值。
2.5. 次生代谢产物的测定
皂角叶片中主要次生代谢产物的提取参考Dong等 [13] 的方法,稍作修改,称取新鲜杜仲叶片0.5 g放入20 mL 60%甲醇(色谱纯)的离心管中,于组织研磨器(宁波新艺超声设备有限公司) 60 HZ 15 min,超声提取30 min后,8000 rpm离心20 min,取上清液,残渣重提1次,合并上清液,放在40℃挥干仪中进行浓缩,最后用甲醇复溶,并定容到10 mL后过0.45 µm滤膜,将样品储存在−20℃冰箱待测。
使用UPLC/Q-TOF-MS系统(Waters,Japan)进行分析。在50~1000的m/z范围内以正离子模式进行检测。在Acquity UPLC BEH C18柱(1.7 μm, 2.1 mm × 50 mm)配备VanGuard预柱(BEHC18, 1.7 μm, 2.1 × 5 mm; Waters)上进行分离并保持柱温在
30 ℃
。进样的体积是2 μL。使用0.05%乙酸–水(A),0.05%乙酸–乙腈(B)的溶剂系统,以0.25 mL∙min−1的流速进行梯度洗脱:0~23分钟内5%B~95%B;23~25分钟内95%B~5%B;和25~31分钟的5%B。
2.6. 数据处理
利用SPSS 25进行One-way ANVOA方差分析,并进行Duncan多重比较,利用GraphPad Prism8作图。
3. 结果
3.1. 生长情况
植物的外在形态变化是其遭受干旱胁迫的最直观的表现,同时也是判断其能否在该环境中生存的最基本标准。观察结果表明(图1),皂角经历不同程度干旱胁迫后(图1(a)),产生了明显的形态差异。对照组的皂角叶片舒展,呈绿色;中度干旱胁迫的皂角叶片逐渐变黄、轻度卷曲变形;在重度干旱胁迫条件下,叶片萎蔫速度较快且更为严重,同时叶片边缘枯黄卷曲、萎蔫并大量脱落。复水后(图1(c)),叶片颜色恢复至绿色并呈舒展状态,叶片数量增加,但叶片边缘枯黄的部分无法恢复。
3.2. 干旱胁迫诱导对皂角生理特性的影响
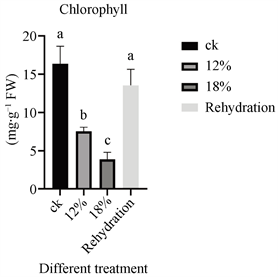
如图2所示,随着干旱程度的增加,皂角叶片叶绿素含量逐渐降低。复水处理使得叶片叶绿素含量恢复到近似对照组水平。

Figure 1. Picture of saponin drought stress and rehydration treatment. (a) From left to right with control group, mild drought, moderate drought; (b) saponin before severe drought rehydration; (c) saponin after severe drought rehydration
图1. 皂角干旱胁迫及复水处理图片。(a) 从左到右以对照组,轻度干旱,中度干旱;(b) 重度干旱复水前的皂角;(c) 重度干旱复水后的皂角
由于干旱胁迫首先会降低气孔导度(Cond),造成细胞间隙CO2浓度(Ci)的降低,抑制皂角的光合作用和蒸腾速率(Tr) [14]。在本研究中,如图3,干旱胁迫同样造成皂角的净光合速率(Photo),Cond,Ci和Tr显著降低,复水后,均显著性的恢复,但光合荧光参数并未完全恢复到对照组水平。干旱处理使皂角叶片生理功能受到限制,复水后叶片形态、叶绿素含量未完全恢复,对光合皂角的光合参数造成了一定影响。
 注:a、b、c不同字母代表显著性差异,p < 0.05。
注:a、b、c不同字母代表显著性差异,p < 0.05。
Figure 2. Changes in chlorophyll content under drought stress and rehydration treatment
图2. 皂角干旱胁迫及复水处理下叶绿素含量的变化
 注:a、b、c不同字母代表显著性差异,p < 0.05。
注:a、b、c不同字母代表显著性差异,p < 0.05。
Figure 3. Effect of gas exchange parameters on saponin drought stress and rehydration treatment. (a) Photosynthetic rate; (b) Stomatal conductance; (c) Transpiration rate; (d) Cell interstitial CO2 concentration
图3. 皂角干旱胁迫及复水处理下气体交换参数的影响。(a) Photo净光合速率;(b) Cond气孔导度;(c) Tr蒸腾速率;(d) Ci细胞间隙CO2浓度
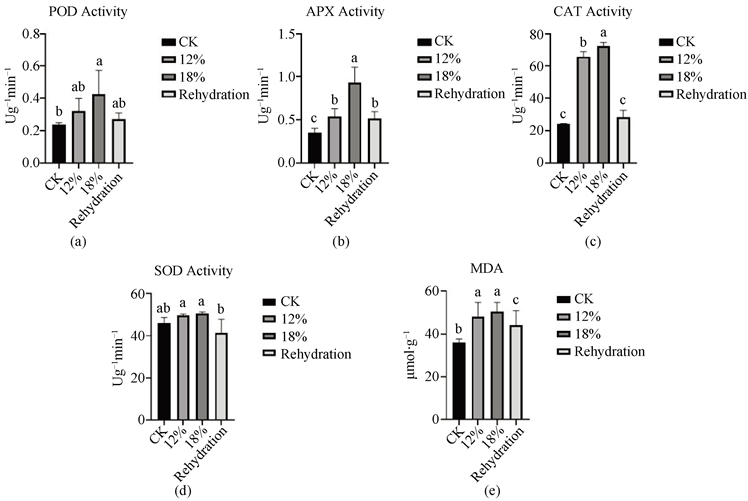
此外,随着干旱程度的增加,皂角叶片中的过氧化物酶POD、超氧化物歧化酶SOD、抗坏血酸过氧化物酶APX和过氧化氢酶CAT的活性均有所增加(图4);复水后,四种抗氧化酶活性与胁迫处理相比均有一定程度的下降,但POD、CAT和APX的酶活性均高于对照组。说明皂角中的POD、SOD、APX、CAT在干旱胁迫防御细胞膜脂过氧化过程中起到重要作用,但是干旱对皂角的细胞膜造成了不可逆的伤害,导致复水后酶活性无法完全恢复。
细胞膜损伤通过丙二醛(MDA)含量变化进行评估。在干旱胁迫下,皂角叶片中MDA含量随着胁迫强度的增加呈上升趋势(图4(e)),说明干旱胁迫下产生的活性氧引发了细胞膜质过氧化作用 [15]。复水后,叶片中的MDA含量显著降低,但未恢复至对照水平。说明干旱处理使皂角膜透性遭到破坏,复水后细胞膜透性仍未完全恢复,干旱对皂角产生了不可逆的伤害。
 注:a、b、c不同字母代表显著性差异,p < 0.05。
注:a、b、c不同字母代表显著性差异,p < 0.05。
Figure 4. Effect of antioxidant enzyme activity and malondialdehyde content on leaves under drought stress and rehydration treatment. (a) Peroxidase; (b) Ascorbate peroxidase; (c) Catalase; (d) Superoxide dismutase; (e) Malondialdehyde content
图4. 皂角干旱胁迫及复水处理下叶片的抗氧化酶活性影响及丙二醛含量的变化。(a) 过氧化物酶POD;(b) 抗坏血酸过氧化物酶APX;(c) 过氧化氢酶CAT;(d) 超氧化物歧化酶;(e) 丙二醛含量MDA
3.3. 皂角不同组织中酚类代谢物对干旱胁迫响应的分析
酚类化合物是植物中分布非常广泛的次生代谢产物的种类之一,具有多种生物学功能。将通过UPLC-MS技术得到的靶向代谢组学数据归一化处理后,进行聚类分析,得到干旱胁迫及复水后皂角不同组织中酚类化合物分布的热图(图5)。本文对22种酚类化合物进行靶向代谢组学分析,将其分为酚类化合物合成前体,C6C1型酚类化合物,C6C3型酚类化合物,黄酮类(C6C3C6型)酚类化合物4类,进一步完善对干旱影响皂角代谢的研究。
L-苯丙氨酸是合成酚类化合物的前体物质。由图5,受到干旱胁迫后皂角叶片中L-苯丙氨酸的含量增加,在重度干旱下有所降低,但始终高于对照组,复水后L-苯丙氨酸的含量降低至对照组以下。通过聚类结果,对皂角叶片中主要的C6C1型化合物进行进一步的分析。在渐进式干旱胁迫中,丁香酸的含量呈上升趋势,复水后丁香酸的含量仍持续上升。而大多数C6C3碳骨架的酚类化合物在中度干旱条件下积累,在重度干旱下略有降低,复水后恢复至近似对照组的水平。如对羟基肉桂酸、肉桂酸、香豆酸和阿魏酸。C6C3C6碳骨架的酚类化合物的变化趋势比较多样。大部分在中度干旱下显著降低,随着干旱程度的增加呈下降趋势,复水后有较低程度的恢复,与对照组差异较大。如染料木黄酮、芹菜素、柚皮苷、高良姜黄素和异甘草素。呈相反趋势的是木犀草素,木犀草素的含量随着渐进式干旱呈上升趋势,复水后恢复至近似对照组水平。此外,柚皮素和山奈酚在中度干旱胁迫时含量降低,在重度干旱胁迫时上升,但复水后山奈酚含量降低至近似对照组水平,而柚皮素含量只有小幅度的降低。

Figure 5. Effect of drought stress and rehydration on the distribution of phenolic compounds in the leaves of Gleditsia chinensis. Three biological replicates per group, blue indicates low accumulation of compounds, and red indicates high accumulation of compounds
图5. 干旱胁迫及复水对皂角叶片中酚类化合物分布的影响。每组3个生物学重复,蓝色表示化合物积累量低,红色表示化合物积累量高
4. 讨论
4.1. 皂角在干旱胁迫及复水条件下的生理响应分析
干旱会导致植物的氧化损伤,其中一个明显的表现就是脂质过氧化的程度,产生大量的MDA,最终导致膜系统的破坏 [16] [17]。叶绿素含量的降低被认为是一个典型的氧化应急指标,这可能是由于活性氧增加了类囊体膜损伤 [18]。在本研究中,渐进性的干旱胁迫使MDA的积累量呈上升趋势。植物体内存在的抗氧化防御系统可以在一定程度上减缓ROS带来的伤害 [19]。在本实验中,在渐进式干旱胁迫下,皂角叶片的抗氧化酶活性(POD,SOD,CAT和APX)均可以保持较好的上升趋势。说明在干旱和复水条件下,抗氧化系统积极发挥作用,清除ROS,使得皂角在干旱条件下也能保持细胞膜的稳定性和较低的MDA含量。复水后,MDA的含量和四种抗氧化酶的活性降低,但未达到对照组的水平,说明皂角虽有一定的抗旱性,但重度干旱会使植物组织受到不可逆伤害。
4.2. 次生代谢对干旱胁迫响应的分析
渗透调节物质的积累与抗氧化能力的提高,是植物在逆境中得以生存的两种重要机制。酚类化合物对各种非生物胁迫具有抗氧化功能,作为酶抗氧化系统的补充,具有降低ROS和避免细胞损伤的巨大潜力。近年来,关于具有抗氧化能力的非酶组分的研究集中在酚类化合物上 [20] [21]。酚类化合物对各种非生物胁迫具有抗氧化功能,作为抗氧化酶系统的非酶补充剂,具有减少ROS和避免细胞损伤的巨大潜力 [22]。
L-苯丙氨酸是合成酚类化合物的前体物质。在不同品种和不同组织之间,苯丙氨酸含量的差异与其下游代谢物,即酚类物质的积累高度相关。已经有研究报道了通过过量积累酚类来增强植物的耐旱性 [5] [23]。另外,苯丙氨酸是莽草酸途径合成酚类化合物的关键节点,可能与干旱胁迫下大部分酚类化合物积累相关。Barnaby等 [24] 发现在干旱条件下,马铃薯叶片积累了大量的苯丙氨酸,与本研究结果一致。重度干旱胁迫下L-苯丙氨酸含量的降低,可能与其在分类代谢途径上的位置有关,下游酚类化合物的大量合成,造成前体物质L-苯丙氨酸含量的降低。
多数研究表明,干旱胁迫会引起植物组织中酚类物质的增加。Kang等 [25] 对两种不同耐旱型的苜蓿进行比较后发现,耐旱性较强的品种会积累更多的黄酮和异黄酮物质,尤其是在地上部分,这些物质可能对保护光系统及延缓叶片衰老有重要作用。Lassouane等 [26] 对刺槐的研究表明,干旱胁迫能够导致其花青素含量增加。类似的研究均表明,干旱胁迫对于酚类物质的代谢有促进作用。在本研究中,对皂角施加不同程度的干旱胁迫,并对重度干旱胁迫的皂角进行复水,对其酚类化合物进行分析表明。在渐进式的干旱胁迫中,部分酚类化合物可以随着干旱进程显著积累,如C6C1碳骨架的酚类化合物丁香酸,C6C3C6碳骨架的黄酮类化合物木犀草素,且木犀草素的含量在复水后降低至近似对照组水平,表现出代谢物对干旱调控的敏感性。C6C3碳骨架的酚类化合物如对羟基肉桂酸、肉桂酸、香豆酸和阿魏酸,在中度干旱条件下积累,在重度干旱下略有降低,复水后恢复至近似对照组的水平。
但是,另外一些研究则发现,干旱胁迫对于酚类物质的促进作用具有局限性。Bettaieb等 [27] 指出,干旱胁迫可以增加酚类物质的水平,但这种增加在中度胁迫下才更明显。重度的干旱胁迫会导致酚类合成途径中酶活性的下降。类似的,Zhang等 [28] 在对活血丹进行不同程度的干旱处理后发现,在高度干旱胁迫下,活血丹的总黄酮含量是降低的。在本研究中,C6C3碳骨架的酚类化合物如对羟基肉桂酸、肉桂酸、香豆酸和阿魏酸呈类似的趋势,与中度干旱相比重度干旱下其含量有下降的趋势,复水后降低至近似对照组的水平。此外,如染料木黄酮、芹菜素、柚皮苷、高良姜黄素和异甘草素等C6C3C6碳骨架的黄酮类化合物的含量在干旱胁迫后呈下降趋势,复水后有较低程度的恢复。这可能是因为黄酮类化合物合成途径中酶活性受到了干旱影响,进而导致黄酮类化合物合成受到抑制,无法达到大量合成进而调节干旱胁迫的目的。
所以本研究结果说明,在干旱胁迫的初期,活性氧的大量产生会促使作为植物抗氧化机制的酚类物质合成增加。干旱对于酚类化合物的促进作用是显著的,但随着胁迫程度的加重,光合能力及其他代谢的降低,造成没有足够的能量和媒介来进行次生代谢物质的合成,进而造成酚类物质的含量降低。此外,高强度的干旱胁迫造成植物体不可逆的损伤,即使复水也无法让植物恢复至未处理状态。
5. 结论
皂角叶片对于干旱胁迫及复水的响应是由多种生理生化反应共同调节的。随着干旱胁迫程度的增加,造成ROS的积累导致MDA含量的增加、细胞膜质过氧化,皂角通过提高抗氧化酶活性减缓ROS对植物造成的伤害;同时,ROS的大量积累造成叶绿素含量的降低。在次生代谢中,大部分酚类化合物随着干旱胁迫程度的增加而增加,一部分黄酮类化合物由于合成酶的活性受限,导致含量的降低,体现出了干旱胁迫对次生代谢产物促进的局限性。复水后,皂角叶片表现出较强的恢复能力,但是干旱胁迫过强对皂角产生了不可逆的伤害,使各项指标无法恢复到对照组水平,因此皂角对于干旱胁迫具有一定的承受能力,程度过强会对植物体本身造成不可逆的伤害。
基金项目
感谢东北林业大学博士后(60201104)项目,黑龙江省博士后(415560)和国家博士后面上(415638)的资助。
NOTES
*通讯作者。