1. 引言
我国目前颁布实施的海水水质标准偏重于传统水质指标,包括耗氧有机物、营养物质和金属污染物等,而对于严重影响水生生态系统质量的有毒有机污染物关注较少。我国《海水水质标准》(GB 3097-1997)中涉及的有机污染物仅包含7类(种)物质:挥发性酚、石油类、六六六、DDT、马拉硫磷、甲基对硫磷、苯并(α)芘。近岸海域中的大部分污染物来自陆源排放,随着我国海洋经济的快速发展与沿海地区生产水平的提高,越来越多的陆源污染严重影响了邻近海洋区域的生态安全。相对于海水水质标准,我国《污水综合排放标准》(GB 8978-1996)涉及的有机污染物范围进一步扩大,其中包含有机污染物项目37项。此外,针对潜在危害性大以及在环境中出现频率高、残留量大的有机污染物,我国环境优先控制污染物名单进一步扩大了有机污染物范围,其中含有机污染物项目58项。我国海水水质标准对于有机污染的控制可能存在“欠保护”的问题 [1]。
但是,经由河流排入海洋的陆源污染物中含有种类繁多的有机物,种类远超过以上标准和名单 [2]。对于大多数有毒有害物质,我国现有的“名单”均未将其包含在内,因此会造成陆源污染排放监管缺乏管控标准。
因而,本研究的主要目的是通过在南黄海沿岸选取典型入海河流,以国家海水水质标准、污水综合排放标准和我国环境优先控制污染物名单内的有机污染物为重点调查目标,以其相应水质指标为监测基准,优化样品前处理和分析方法,扩大有机污染物排查范围,定性排查主要有机污染物种类,并对出现频率高、残留量大、对水环境影响严重的有机污染物进行定量分析并初步评价其生态风险。
2. 材料与方法
2.1. 采样过程
于2016年11月24日在江苏省某滨海化工园区临近河流采集排水口下游10 m处的水体。使用采样瓶为10 L的棕色玻璃瓶,实验所采用的玻璃样品瓶在使用前用经自来水、纯净水、丙酮和纯净水依次冲洗,确保样品容器清洁。玻璃瓶在采样前用实际水样冲洗3次,所采水样当天运回实验室,低温冷藏环境下保存。
2.2. 样品前处理
样品前处理过程是影响调查分析方法准确度和重现性的重要因素 [3]。入海河流水体中含有多种有机污染物,这些有机物的理化性质差异很大,本工作拟采用广泛应用于水样前处理的固相萃取技术(Solid-Phase Extraction, SPE)。通过选择不同的固相吸附剂和洗脱溶剂能够将目标化合物与其他成分和基质进行较好地分离。但现有方法通常仅针对已知目标组分设计,不符合污染物定性调查的需求。为达到快速筛查水中多组分污染物的目标,需要在样品前处理过程中尽可能多的富集和洗脱不同性质的多组分物质。
根据有机物的理化性质,从以下四个方面建立前处理方法:
1) 固相萃取吸附材料的选择。HLB(由亲脂性二乙烯苯和亲水性N-乙烯基吡咯烷酮两种单体按一定比例聚合成的大孔共聚物)和C18(十八烷基硅烷粉)为常用固相萃取小柱的填充材料。根据商业固相萃取小柱说明,HLB柱对非极性物质的回收率偏低,适用于分离极性较强的物质;而C18柱适合萃取非极性或弱极性物质,对强极性物质的回收率则明显下降 [4]。有研究证明,包括不同极性农药、多环芳烃、雌激素和酚类等水体中不同类型物质的前处理,C18柱串联HLB柱固相萃取的效果较为理想 [5]。因而,采取C18柱串联HLB柱固相萃取的方法可同时提高水样中不同性质化合物的富集效率。
2) 调节水样的pH。在对极性物质的固相萃取时,调节水样的pH值可以提高目标物的回收率,如酚类和羧酸在酸性条件下萃取效果较好,而胺类在碱性条件下的萃取效率更高。有部分水体有机污染物定性研究采用液液萃取法,先后在中性、碱性(pH > 11)以及酸性(pH < 2)条件下分别萃取并合并有机相 [6],目的在于尽可能提高各极性有机污染物的萃取效率,但该方法会造成不同极性的有机污染物在不同萃取条件下的差异性无法体现,不利于后期的物质定性。因此,本研究将水样分成三份,分别调至酸性(pH = 3)、中性(pH = 7)和碱性(pH = 11)分别进行固相萃取。
3) 选择适当的洗脱溶剂。洗脱溶剂对目标物具有选择性,根据相似相溶原理,选择溶剂极性差异较大的正己烷、二氯甲烷、乙酸乙酯和甲醇等按一定比例配成混合液,可提高对不同极性的目标物的萃取效率。根据相关研究结果 [5],本研究选用过量的二氯甲烷和甲醇混合液(体积比1:1)和正己烷和二氯甲烷混合液(体积比1:1)分别洗脱HLB柱和C18柱。
4) 温度控制。由于某些有机物具有较强的挥发性和热不稳定性,如酚类,在萃取浓缩过程中应注意温度控制,氮吹浓缩温度控制40℃以下。
根据以上要求设计样品前处理实验步骤见图1。
将4 L水样经0.7 μm玻璃纤维滤膜(英国Whatman)过滤,去除悬浮颗粒物;将过滤后的水样分装于4个玻璃瓶中,每瓶盛有水样1 L,其中1份水样留作备用,将其余3份水样分别用盐酸和氢氧化钠调至酸性(pH = 3)、中性(pH = 7)和碱性(pH = 11);将经过pH调节的3份水样,分别用Oasis HLB(200 mg,6 mL,美国Waters公司)和C18 (200 mg,6 mL,美国Supelco Inc.公司)固相萃取小柱串联对水样进行固相萃取,HLB柱同时适用于极性较强和较弱化合物的萃取,而C18柱适用于萃取非极性和弱极性化合物。HLB柱和C18柱依次用5 mL的二氯甲烷、5 mL甲醇和15 mL超纯水进行活化,水样通过SPE小柱的流速控制为5 mL/min。富集水样的HLB 和C18小柱用不同的溶剂进行洗脱,其中,HLB柱用体积比为1:1的二氯甲烷和甲醇混合液15 mL分3次(各5 mL)进行洗脱,C18柱用体积比为1:1的正己烷和二氯甲烷混合液15 mL分3次(各5 mL)进行洗脱,洗脱速度控制为1~2 mL/min,所用溶剂均为色谱纯,来自德国默克公司。2种柱子的6份洗脱液分别用无水硫酸钠脱水,氮吹定容至1.0 mL,氮吹温度控制在40℃以下。

Figure 1. Sample preparation steps
图1. 样品前处理实验步骤示意图
2.3. 样品分析
样品使用Agilent7890A-5975C气相色谱质谱联用仪分析测定,仪器条件设置为:载气为高纯氦气;采用不分流进样,进样体积为1 μL;进样口温度260℃;采用Full scan模式。初始柱温为50℃;稳定2 min,程序升温(5℃/min)至300℃;恒温10 min。质谱仪采用EI离子源;离子源温度为230℃;四极杆温度为150℃;EI电压为70 eV;扫描范围为50~300 amu。
通过以下步骤获得目标物的定性分析结果:1) 将实验测得的水样总离子图与工作站里贮存的NIST11谱库中的谱图相比较,筛选出可能性最高的对应谱图来确定该有机污染物的名称;2) 对于未知物质的定性,以谱库检索匹配度大于50%并结合人工解谱来确定;3) 当基线干扰过高或目标物响应偏低时,应采用解卷积技术(DRS)以提高解谱的准确性。
2.4. 重点目标物定量
根据样品定性分析结果,选择出现频率高、色谱峰面积大、对水环境影响较严重的邻苯二甲酸酯和农药乐果进行定量分析,以评估入海河流的水质污染情况。
16种邻苯二甲酸酯标准溶液,浓度为1000 mg/L,来自美国o2si公司,标准物质包括邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二异丁酯(DIBP)、邻苯二甲酸二正丁酯(DBP)、邻苯二甲酸双(2-甲氧基乙)酯(DMEP)、邻苯二甲酸双-4-甲基-2-戊酯(BMPP)、邻苯二甲酸双-2-乙氧基乙酯(DEEP)、邻苯二甲酸二戊酯(DPP)、邻苯二甲酸二正己酯(DHXP)、邻苯二甲酸丁苄酯(BBP)、邻苯二甲酸二丁氧基乙酯(DBEP)、邻苯二甲酸二环己酯(DCHP)、邻苯二甲酸二(2-乙基己基)酯(DEHP)、邻苯二甲酸二苯酯(DPhP)、邻苯二甲酸二正辛酯(DNOP)、邻苯二甲酸二壬酯(DNP);乐果农药标准溶液,浓度为100 mg/L,来自美国o2si公司。以正己烷为溶剂配制邻苯二甲酸酯和乐果的标准溶液,浓度分别为0.5,1,2,5,10 μg/mL,用于标准曲线的测定。
2.5. 重点目标物定量
根据美国国家环保局生态毒性数据库(http://cfpub.epa.gov/ecotox)获得邻苯二甲酸酯类化合物对不同物种(藻类、脊椎动物、无脊椎动物)水生生物的毒性参数(NOEC/LOEC、LC50、EC50),其中脊椎动物选择鱼类,无脊椎动物选择甲壳类,评价终点选择反映物种死亡率、存活率或繁殖率等。毒性数据的选择 [7]:对于藻类,一般选择4~7天的毒性数据;鱼类选择96 h的LC50/EC50,大于14天的NOEC/LOEC,且测试条件为淡水、实验室环境;大型溞选择48 h的LC50/EC50,大于7天的NOEC/LOEC。
使用商值法表征风险,商值法可以针对选定的评价受体计算化合物的风险商值(Risk Quotient, RQ):
(1)
式中,MEC为测定环境浓度(measured environmental concentration,MEC),PNEC为预测无影响浓度(predicted no effect concentration, PNEC)。若RQ < 0.1,则为低风险,0.1 ≤ RQ < 1,则为中等风险,RQ ≥ 1,则为高风险 [8]。
水体中的PNEC值的推导采用评价因子(assessment factor,AF)法 [9],依据表1的评价因子选取原则。PNEC为L(E)C50或NOEC与相应AF的比值。

Table 1. The values of assessment factors (AF) for deriving the predicted no-effect concentrations (PNEC)
表1. 推导预测无影响浓度(PNEC)所用的评价因子(AF)的取值
注:L(E)C50为半致死(效应)浓度;NOEC为无观察效应浓度。
3. 结果分析
3.1. 结果分析流程
根据GC-MS检测结果,按照图2所示工作路线进行结果分析。
首先,在化学工作站中对6份样品的色谱图进行自动积分,将6张色谱图中相同保留时间探测到的物质归为一种,按照峰面积保留主要目标物质。然后,针对筛选出的主要目标物质去除背景干扰并进行NIST谱图检索操作,以匹配度前2位的化合物信息为备选项。若匹配度大于70%,则根据不同pH下两种萃取柱的萃取量(即所测样品的峰面积)确定的目标物质极性特征来验证匹配结果,通过验证则可以确定目标物质的名称;若匹配度小于70%,则首先对质谱图的特征离子进行分析,当目标物质与备选匹配化合物的特征离子一致时,再通过分析目标物质极性特征来排除不可能的备选匹配化合物,以此可以认为目标物质与匹配化合物具有结构相似的特征;在匹配度小于70%时,当目标物质与备选匹配化合物的特征离子不一致时,则认为不能确定目标物质的名称和结构。
对于重点关注的目标物质,采用标准物质定性定量分析的方法,最终确定目标物质的化合物名称和含量,为后续的生态风险评价提供依据。
3.2. NIST谱库匹配结果
选取6个样品的色谱图中峰面积前30的色谱峰进行NIST谱库匹配分析,匹配结果见表2。根据结果分析流程的工作路线,绘制不同pH下两种萃取样品的分析结果示意图(图3),以横坐标为峰面积,纵坐标为出峰时间,Y坐标轴左侧为C18柱萃取样品测试结果,Y坐标轴右侧为HLB柱萃取样品测试结果,不同颜色代表不同pH的样品。
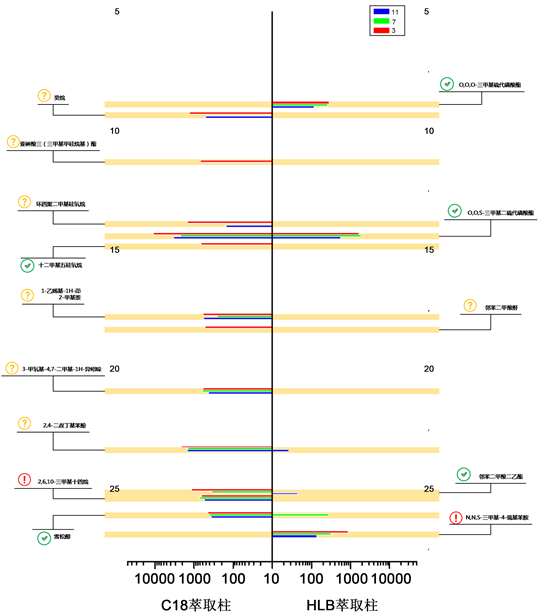

Figure 3. Results of two extracted samples at different pH values
图3. 不同pH下两种萃取样品的分析结果
综合分析检索到目标物的匹配度,出峰时间前后关系以及目标物极性特征与不同实验变量组的响应值关系:
1) 可以基本确定目标化合物名称的包括:1号O,O,O-三甲基硫代磷酸酯、5号O,O,S-三甲基二硫代磷酸酯、6号十二甲基五硅氧烷、11号邻苯二甲酸二乙酯、13号雪松醇、15号乐果、21号棕榈酸甲酯、22号棕榈酸、24号硬脂酸甲酯、25号硬脂酸、30号邻苯二甲酸二异辛酯;
2) 可以确定目标化合物与匹配物质结构具有相似性的包括:2号疑似癸烷、3号疑似亚砷酸三(三甲基甲硅烷基)酯、4号疑似环四聚二甲基硅氧烷、7号疑似1-亚乙基-1H-茚或2-甲基萘、8号疑似邻苯二甲酸酐或邻苯二甲酸、9号疑似3-甲氧基-4,7-二甲基-1H-异吲哚、10号疑似2,4-二叔丁基苯酚或2,5-二叔丁基苯酚、16号疑似2-羧基苯甲酸异丁酯、17号疑似1-十八碳烯、18号2-羧基苯甲酸异丁酯、19号疑似邻苯二甲酸二异丁酯、20号邻苯二甲酸二异丁酯、23号疑似邻苯二甲酸二丁酯、27号疑似1-二甲基(苯基)甲硅烷氧基十八烷、29号疑似癸甲基四硅氧烷;
3) 不能确定目标化合物的名称和结构的包括:12号物质、14号物质、26号物质、28号物质。

Table 2. Information of compounds with the highest matching rate
表2. 目标物匹配度最高化合物信息表
LogP:非离子态溶质在正辛醇和水中的分配系数;LogD:正辛醇中非离子态溶质与水中溶质的分配系数。
3.3. 重点化合物定量分析
通过以上的分析可以发现,邻苯二甲酸酯类化合物(phthalic acid esters, PAEs)和农药乐果及其降解产物是入海河流水体中两类重要的污染物,通过标准物质定性定量的方法,进一步确定化合物的名称,并测定其含量。各样品中最终确定含有邻苯二甲酸酯类化合物5种,包括邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二异丁酯(DIBP)、邻苯二甲酸二正丁酯(DBP)和邻苯二甲酸二(2-乙基己基)酯(DEHP)。水样邻苯二甲酸酯类化合物和农药乐果定量数据见表3。需要注意的是,由于在前处理过程中并未验证邻苯二甲酸酯类化合物和乐果的回收率,不同的前处理方法可能造成回收率不同程度地降低,因而可以认为浓度最高的结果最为接近实际浓度。

Table 3. Concentrations of PAEs and dimethoate with different pretreatment methods (μg/L)
表3. 不同前处理方法水样中邻苯二甲酸酯类化合物和乐果的含量(μg/L)
n.d. 表示未检出。
邻苯二甲酸酯类化合物,在工业上主要用作各种塑料和合成橡胶的增塑剂使用,少数情况还被用作油漆、香味剂、农药的载体,此外在驱虫剂、润滑剂、去泡剂等的生产中也有使用。邻苯二甲酸酯类化合物用途广泛,生产量大,研究表明在多种环境介质大气、水、土壤、生物体中均有检出 [10],日常接触的食品、化妆品及儿童玩具也有被检测到。PAEs可以通过呼吸道、饮食和皮肤接触进入生物内,由于PAEs降解代谢缓慢,容易产生富集作用。研究表明,PAEs具有扰乱动物内分泌的干扰特性 [11],影响人体的身体健康。
邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二正辛酯(DOP)、邻苯二甲酸丁基苄基酯(BBP)、邻苯二甲酸二(2-乙基己基)酯(DEHP)6种被美国国家环保局(EPA)列为优先控制污染物,邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二正辛酯(DOP)3种被我国确定为环境优先控制污染物。我国《地表水环境质量标准》(GB3838-2002)中规定集中式生活饮用水地表水源地邻苯二甲酸二丁酯(DBP)和邻苯二甲酸二(2-乙基己基)酯(DEHP)标准限值分别为0.003 mg/L和0.008 mg/L。本次实验的样品中邻苯二甲酸二丁酯(DBP)已超过《地表水环境质量标准》6倍以上,认为本研究河水水质受到较明显的邻苯二甲酸酯类物质的影响。
上世纪80年代后,被认为生态效应影响较小的有机磷农药(organophosphorus pesticides, OPPs)取代有机氯农药成为目前我国农药市场所占份额最大、使用范围最广的一类农药。但是随着部分高纬度地区检测到有机磷农药及其代谢产物,说明某些有机磷农药可能成为持久性有机污染 [12]。农业面源和工业点源排放和泄漏的有机磷农药通过河流、大气传输等方式进入环境介质,很大一部分最终汇入海洋。
乐果化学名O,O-二甲基-S-(N-甲基氨基甲酰甲基)二硫代磷酸酯,为一类有机磷农药,属有机磷酸酯类化合物。易被植物吸收并输导至全株。在酸性溶液中较稳定,在碱性溶液中迅速水解,属中毒农药。乐果在一定的剂量范围内有拟雌激素效应 [13]。我国已将乐果列入“水中优先控制污染物”名单。我国《地表水环境质量标准》(GB3838-2002)中规定集中式生活饮用水地表水源地乐果标准限值为0.08 mg/L,《污水综合排放标准》(GB 8978-1996)规定乐果最高允许排放浓度1.0 mg/L。本次检测乐果浓度高达143.29 μg/L,已超过《地表水环境质量标准》规定限值。由于河水中的乐果很可能来自上游农药企业的非法排放,受到河水的稀释作用,上游排放出水中的乐果浓度很可能已超过《污水综合排放标准》的要求。此外,检测到的O,O,S-三甲基二硫代磷酸酯和O,O,O-三甲基硫代磷酸酯均系乐果生产过程中第一步反应的副产物,均具有强烈恶臭味 [14],说明乐果及其副产物来自工业泄漏的可能性。2017年7月,农业部发布公告(第2552号),自2017年8月1日起,撤销乐果等的农药登记,自2019年8月1日起禁止其在作物上使用。随着禁用政策的实施,环境介质的乐果残留量将呈现逐步下降的趋势。
3.4. 生态风险评价
根据美国国家环保局数据库中关于4种PAEs以及乐果对相对敏感生物的毒性数据,利用表2和公式1确定评估因素并计算得到水体中4种PAEs和乐果的预测无影响浓度PNEC,结果见表4。计算结果显示,PAEs中,DEHP的PNEC值最小,DMP的值最大,表明水体中同等浓度下,DEHP对水生生物的影响最为严重,DMP的影响较轻;大型溞对乐果较为敏感。

Table 4. The toxicity data of PAEs and dimethoate to sensitive organisms
表4. 4种PAEs和乐果对敏感生物的毒性数据
选取各目标化合物中最高浓度作为测定环境浓度(MEC),计算得到水体中4种PAEs和乐果对藻类、甲壳类和鱼类的风险商值见表5。河水水体中4种PAEs对水生生物的风险商值范围为0.00004~30.03,整体而言,DMP的风险商值最低而DEHP的风险商值最高,4种PAEs的风险商明显可以分为两个区域,DMP和DEP的风险商值较为接近且均远小于1,呈低风险,而DBP和DEHP的风险商值均超过1,呈高风险,其中又以鱼类所受风险最高。乐果的风险商值对于三种类型生物均大于1,与PAEs不同,乐果对等级较高的鱼类风险相对较低。根据商值法评价河水水体中4种PAEs和乐果对藻类、甲壳类(大型溞)和鱼类的风险顺序整体上为DEHP > DBP > 乐果 > DEP > DMP。

Table 5. The RQ values of PAEs and dimethoate in water
表5. 水体中4种PAEs和乐果的RQ值
4. 总结
本研究以南黄海沿岸某河流入海口附近水体为典型目标水体,采用在不同酸碱条件下,C18柱串联HLB柱的固相萃取方法,提取水样中不同极性的有机污染物;利用GC-MS在全扫描模式下对样品中的物质进行了检测;在去除背景干扰情况下,使用NIST11谱库对主要的30种物质的质谱图进行检索,结合人工解谱和目标物极性判断,可确定名称的化合物10种,其中包括农药乐果及其2种副产物,2种脂肪酸及其对应甲酯、邻苯二甲酸乙酯、雪松醇;可以确定目标化合物与匹配物质结构相似的化合物16种,包括多种邻苯二甲酸酯类物质;不能确定名称和结构的目标化合物4种。由于C18柱填料分子断裂,部分含量较高的含硅化合物并非来自水样。
通过对重点污染物的进一步定量检测,测定了邻苯二甲酸酯类物质和乐果的浓度。本研究筛查出多种邻苯二甲酸类物质,该类型物质被我国确定为环境优先控制污染物,该类物质浓度已超过我国《地表水环境质量标准》(GB3838-2002)中关于集中式生活饮用水地表水源地的规定浓度。农药乐果同样被列入“水中优先控制污染物”名单,浓度与我国《地表水环境质量标准》(GB3838-2002)中规定集中式生活饮用水地表水源地乐果标准限值在同一数量级并判断河流上游可能存在高浓度乐果生产废水泄漏的情况。初步生态风险评价结果表明,邻苯二甲酸酯类物质和农药乐果对河水生态系统呈现较高风险特性。