1. 引言
白藜芦醇广泛存在于葡萄皮中,是植物体在应激霉菌感染和作用时产生的一种天然多酚类物质,又称为芪三酚 [1]。白藜芦醇具有降低血小板聚集 [2],预防和治疗动脉粥样硬化 [3],降低心脑血管疾病 [4] 发病率的作用,还具有很强的抗氧化 [5] 和防癌 [6] 的生理活性。由于葡萄品种及加工工艺的不同,造成了葡萄酒中白藜芦醇质量浓度的差异,故白藜芦醇质量浓度的多少已成为评价葡萄酒品质的重要指标之一 [7]。山葡萄抗寒力极强,其果实酿酒品质优良,是东北地区酿造甜红葡萄酒的主要原料,研究发现山葡萄酒中白藜芦醇含量高于其他葡萄酒 [8],最大差异为10倍 [9]。
本文建立的HPLC法操作简单,并对通化地区不同品牌的市售山葡萄酒中的白藜芦醇含量进行了测定,以期为通化地区山葡萄酒品质评价及产品推广提供实验依据。
2. 材料与方法
2.1. 仪器与试剂
2.1.1. 主要仪器设备
LC-2010A型高效液相色谱仪,日本岛津;KQ-100B超声波清洗仪,昆山市超声仪器有限公司。
2.1.2. 试剂
甲醇、乙腈、磷酸为色谱纯,其余试剂为分析纯。
反式、顺式白藜芦醇标品溶液的制备:反式白藜芦醇标准品(纯度大于99%),购自SIGMA-ALDRICH公司。称取25 mg反式白藜芦醇标准品,用甲醇溶解并定容25 mL,制成1 g/L储备液。取部分储备液,将其置于365 nm紫外灯处照射2 h,使反式白藜芦醇部分转化成顺式白藜芦醇,并通过差值法算出顺式白藜芦醇和反式白藜芦醇含量 [10],即用照射前反式白藜芦醇的含量减去照射后反式白藜芦醇的含量的差值为顺式白藜芦醇的含量。
2.2. 方法
国内外白藜芦醇的检测主要有3种方法,分别是GB/T15038-2005《葡萄酒、果酒通用分析方法》,乙酸乙酯提取浓缩法和直接进样法。其中,直接进样法较前两者操作更简便,且可以减少白藜芦醇在分析、提取中的损失,回收率高 [10],故本文以直接进样法测定样品中的白藜芦醇,检测波长为306 nm。
2.2.1. 样品前处理对检测结果的影响
取葡萄酒样品0.5 mL,用甲醇分别稀释1倍、5倍、10倍、20倍,超声10 min (超声功率100 W),定容。用0.25 μm针头过滤器过滤,得样品溶液,考察不同稀释倍数对检测结果的影响。
2.2.2. 流动相组成对检测结果的影响
本研究用乙腈和水作为检测流动相,调整乙腈:水的比例分别为30:70,35:65,40:60、42:58考察流动相组成对检测结果的影响。
2.2.3. 梯度洗脱对检测结果的影响
参考冯愈钦等人 [11] 的方法设置梯度洗脱条件,起始时A:B = 65:35(体积比),0~10 min,保持35% B;10~20 min内,35%~100% B;20~30 min,保持100% B;30~35 min内,100%~35% B;35~40 min,保持35% B。其中A为去离子水,B为纯乙腈,考察梯度洗脱对检测结果的影响。
2.2.4. 流动相pH对检测结果的影响
磷酸调节流动相中水相的pH = 2.4,考察pH调节前后对检测结果的影响。
2.2.5. 柱温对检测结果的影响
柱温分别设置为20℃、25℃、30℃、35℃、40℃,考察柱温对检测结果的影响。
3. 结果与分析
3.1. 样品前处理对检测结果的影响
色谱条件参考前人的研究结果:色谱柱THERMOODS-2C18(4.6 × 250 mm,5 μm);紫外检测的最大吸收波长306 nm;流速1.0 mL/min;进样量10μL;流动相为乙腈: 水 = 35:65;柱温为室温 [2] [12] [13]。如图1所示,白藜芦醇保留时间为9.990 min。
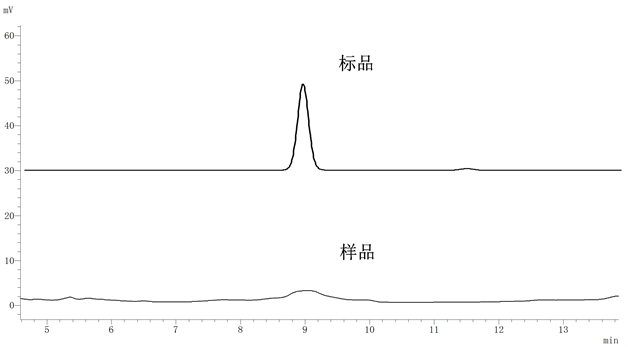
Figure 1. The chromatogram of trans-resveratrol and sample diluted 5-fold with methanol
图1. 标品及样品稀释5倍色谱图
结果显示,稀释1倍的样品分离效果不好,稀释5倍的样品峰分离效果较好(如图1所示),稀释10倍、20倍的样品均无峰。这是因为稀释1倍的样品浓度较高,不易于干扰组分分离,而稀释10倍、20倍样品浓度过低导致检测无结果。因此,样品前处理采用稀释5倍的条件进行。
3.2. 流动相组成对检测结果的影响
乙腈: 水的比例分别为30:70、35:65、40:60、42:58时,白藜芦醇出峰时间分别为15.356、9.900、8.457、6.545 min。随着流动相中水相的比例不断提高,样品中白藜芦醇的出峰时间增加,这主要是因为随着流动相中水相的比例增加,极性增加,疏水性物质在流动相中的溶解度降低,样品中极性物质先流出,白藜芦醇是弱极性,水相比例的提高增加了白藜芦醇在色谱柱上的保留时间,故而出峰时间延长。
在不同的流动相比例条件下,样品分离效果均不理想,如图2所示,其它条件所得结果与图2相似,故需进一步研究。
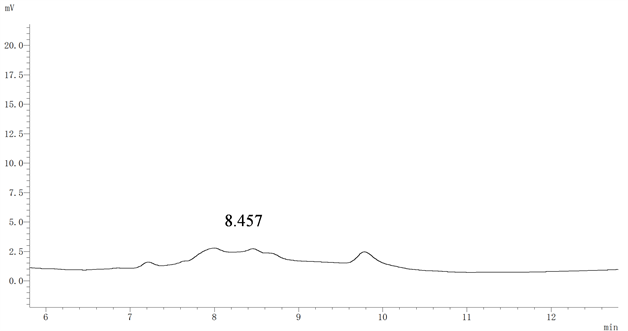
Figure 2. The chromatogram of sample obtained at a 40:60 ratio of acetonitrile:water
图2. 乙腈:水比例40:60时样品色谱图
3.3. 梯度洗脱对检测结果的影响
如图3所示,反式白藜芦醇出峰时间为19.168 min,顺式白藜芦醇出峰时间为23.177 min。
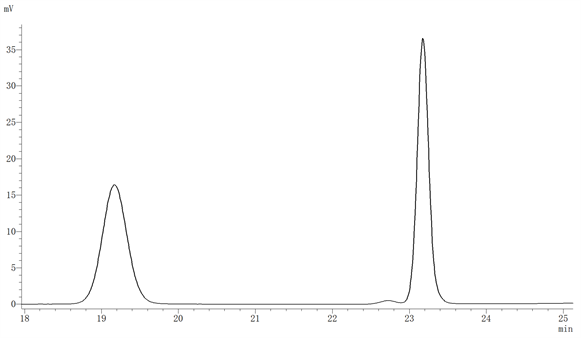
Figure 3. The chromatogram of cis- and trans-resveratrol
图3. 顺、反式白藜芦醇标品色谱图
由图4可知,与非梯度洗脱相比,梯度洗脱分离效果较好,可以满足检测需要,因此采用梯度洗脱。
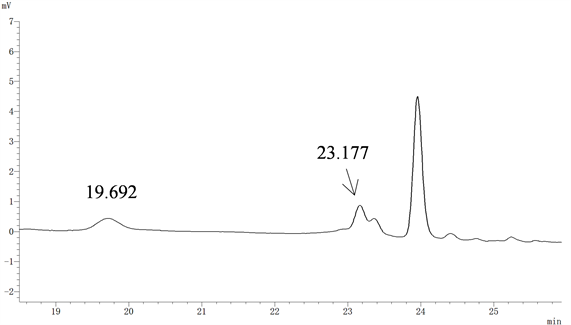
Figure 4. The chromatogram of sample obtained by non-gradient elution
图4. 非梯度洗脱样品色谱图
3.4. 流动相pH对检测结果的影响
如图5所示,pH调整后,反式、顺式白藜芦醇出峰时间延长,这可能是由于流动相水相pH调节为2.4后,白藜芦醇本身具有弱酸性受水相影响使样品中的白藜芦醇离子与色谱柱结合强度增加,从而导致出峰时间延长。水相pH调整前后分离效果差距不明显,说明流动相pH对样品分离效果没有影响。
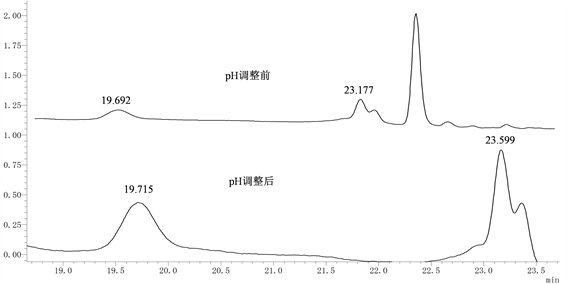
Figure 5. The chromatogram of samples with pH adjusted and without pH adjusted
图5. pH调整前后样品色谱图
3.5. 柱温对检测结果的影响
在柱温分别设置为20℃、25℃、30℃、35℃、40℃时,测定结果未有明显差别,说明柱温对检测结果的影响不显著,这与鲍会梅 [6] 的研究结果一致。
3.6. 标准曲线
分别精密移取顺、反式白藜芦醇标准品溶液,按照表1稀释不同倍数得出浓度与峰面积关系,并分别作出标准曲线,检测波长为306 nm。

Table 1. The relationship between concentration of cis-/trans-resveratrol and peak area
表1. 顺、反式白藜芦醇浓度与峰面积关系
由峰面积和浓度进行线性回归,得反式白藜芦醇标准曲线方程为
,顺式白藜芦醇标准曲线方程为
。
3.7. 样品检测
由于白藜芦醇主要存在于葡萄皮中,因此白葡萄酒中几乎无法检出白藜芦醇 [14],所以选取21瓶通化地区不同生产厂家,不同类型的山红葡萄酒进行检测。
由于葡萄酒中的白藜芦醇含量在开瓶后会随着时间的延长而降低 [10],且最适宜白藜芦醇稳定的环境是4 ~8℃冰箱的环境 [15]。因此,在开瓶后,立即取样,置于4℃~8℃条件下冷藏待测。山葡萄酒样品中白藜芦醇检测结果如表2所示。

Table 2. The concentration of resveratrol in hill wines in Tonghua region
表2. 通化地区葡萄酒中白藜芦醇的含量
由表2可知,通化地区市售山葡萄酒反式白藜芦醇含量在0.54~11.45 mg/L 之间,顺式白藜芦醇含量在0.60~5.42 mg/L之间。不同品牌的葡萄酒的白藜芦醇含量之间会存在差异,但总体反式白藜芦醇多于顺式白藜芦醇的含量,这一结论也与奚星林等人 [10] 研究结果一致。
4. 结论
本文建立了HPLC法测定通化地区山葡萄酒样品中白藜芦醇含量的方法。样品用甲醇稀释5倍后,过滤,直接进样。采用C18色谱柱进行分离,以乙腈水溶液(35:65,v/v)为流动相进行梯度洗脱,流速为1.0 mL/min,柱温为室温,检测波长为306 nm。结果表明,通化地区市售山葡萄酒反式白藜芦醇含量在0.54~11.45 mg/L之间,顺式白藜芦醇含量在0.60~5.42 mg/L之间。
NOTES
*通讯作者。