1. 引言
垂体腺瘤是颅内常见的中枢神经系统肿瘤 [1],虽然垂体瘤是良性肿瘤,但其常呈侵袭性生长,常累及周围重要的结构,导致内分泌异常 [2] [3]、视力障碍以及颅内压增高等各种并发症 [4],目前仍缺乏针对侵袭性垂体腺瘤的有效药物 [5]。近年来,随着人们对分子生物学的研究进展,我们发现微小RNA (后简称miR)在人体的疾病发展与转归中起着不可或缺的作用,微小RNA是一类由17~27个核苷酸组成的内源性非编码小RNA [6],许多真核微生物都有表达,最早在线虫体内发现。MiRNAs通过结合目的基因 mRNA 3′非编码区,使目的基因mRNA降解或抑制mRNA翻译 [7]。miR-210-3p基因位于第11号染色体短臂的末端(11p15.5),目前发现的miR-210靶基因已达50余个 [8]。miR-210通过调控这些基因的表达,广泛参与体内各种生理及病理代谢过程(如多种成体干细胞的发育、胚胎的发育、细胞生长和凋亡 [8]、细胞分化、血管生成 [9]、免疫系统的调控及肿瘤的发生、发展等) [10]。据报道,miR-210-3p与许多肿瘤的表达有异常表达,如胰腺癌、乳腺癌以及肾透明细胞癌。但是在垂体腺瘤中的表达还未见报道,miR-210在垂体腺瘤的作用机制还有待阐明 [17]。我们通过TargetScan 7.2预测的miR-210-3p的靶基因为FGFRL-1,FGFRL-1是一种单通道I型膜蛋白,属于FGF受体家族, 它们调节大多数细胞类型 [11] 的生长、凋亡、分化和迁移。FGFRL1对细胞增殖有负作用 [12]。2018年9月至2019年12月我们拟在分子生物学角度,探讨低表达miR-210-3p对大鼠垂体瘤MMQ与GH3细胞的增殖与迁移作用与机制。
2. 材料与方法
2.1. 细胞、特殊试剂来源
大鼠垂体瘤细胞系MMQ与GH3购于ATCC细胞库。特殊试剂和实验材料:FGFRL1一抗(Abcam) ab95940;CCK-8试剂盒(东仁化学);Lipofectamine3000 (Thermo);Transwell (Millipore);荧光定量PCR试剂盒(Takara);反转录试剂盒(Takara);双荧光素酶试剂盒(Promega) Dual-Luciferase Reporter Assay System。
2.2. 细胞培养、转染与分组
将MMQ与GH3细胞株于DMEM+10%FBS培养基中培养,培养环境温度为37℃,培养二氧化碳浓度为5%。当细胞密度大于30%时,将细胞随机分为阴性对照组与低表达组。使用Lipofectamine3000分别转染miR-210-3p inhibitor和miR-210-3p NC。分别于转染的24 h、48 h收集细胞(引物序列见表1)。采用qPCR技术检测MMQ与GH3细胞中的miR-210-3p表达,低表达组的miR-210-3p表达低于阴性对照组,表面转染成功。
(60℃退火30 s)。
2.3. MMQ与GH3细胞增殖测定
接种细胞于96孔板内(分别于接种后24 h、48 h、72 h进行CCK-8检测),每组细胞设置3个复孔;进行CCK-8检测前,向待测孔内加入10 μL CCK-8检测液,避光放入37℃培养箱孵育2 h后将96孔板放入酶标仪检测。
2.4. MMQ与GH3细胞迁移检测
将低表达miR-210-3p组和阴性对照的细胞在转染12 h后,离心,去上清,以500 μL无血清培养基重悬细胞,并进行细胞计数;然后将各组细胞加入Transwell小室内,每室加入2 × 105个细胞。小室置于24孔板中,板内下室加入600 μL含血清完全培养基,继续培养48 h后将24孔培养皿内的细胞悬液充分轻柔吹打均匀,用等体积PBS在清洗相应的孔,与悬液合并加入流式管,上机检测管内细胞数目。
2.5. MMQ与GH3细胞中的FGFRL-1蛋白表达检测
采用Western-blotting技术,在转染48 h后收集细胞,根据试剂盒说明书提取总蛋白并变性,完成常规电泳、转膜、封闭后行Western-blotting显影,显影后使用Image J软件计算相对灰度值。
2.6. miR-210-3p靶基因预测与验证
采用TargetScan 7.2预测miR-210-3p的下游靶基因,然后采用双荧光素酶实验,收集miR-210-3p低表达组与阴性对照组的细胞,加入1×Passive Lysis Buffer,裂解15分钟后向检测管内加入100μL的LAR II (将Luciferase Assay Substrate溶解于Luciferase Assay Buffer II中),随后上机设置程序;向上述每一个检测管内加入20 μL对应的步骤4中得到的细胞裂解液,并检测萤火虫荧光素酶活性;向每一个检测管中加入100 μL的1×Stop & Glo Reagent,并检测海肾荧光素酶活性。
2.7. 统计学方法
采用SPSS22.0统计软件计量资料用均数 ± 标准差(SD)表示,并采用两样本t检验(College Station, TX, USA)进行数据分析,P值<0.05为差异有统计学意义。
3. 结果
3.1. 细胞转染情况
qPCR检测大鼠垂体瘤MMQ与GH3细胞株中的miR-210-3p的表达,其中,低表达病毒组的MMQ细胞系miR-210-3p显著下降(P < 0.05),GH3细胞系P = 0.0594,较MMQ组稍有差异,NC组与空白组(阴性对照组)对比miR-210-3p的表达无差异(P > 0.05)表面细胞转染成功(见图1)。
 Note: *. P < 0.05. **. P < 0.01, ***. P < 0.001, ****P < 0.0001.
Note: *. P < 0.05. **. P < 0.01, ***. P < 0.001, ****P < 0.0001.
Figure 1. Expression of mir-210-3p in the two groups of pituitary tumor cell lines after transfection with inhibitor
图1. 转染inhibitor后两组垂体瘤细胞株的miR-210-3p的表达情况
3.2. 细胞增殖情况
我们利用CCK-8检测了MMQ与GH3细胞株的增殖情况,低表达miR-210-3p后的MMQ与GH3细胞株细胞增殖能力较阴性对照组下降(P < 0.05),而NC组与空白对照组(阴性对照组)相比对,增殖情况不存在差异(见图2)。

Figure 2. The effect of low expression oF mir-210-3p on MMQ and GH3 cell lines. After low expression of mir-210-3p, the proliferation of GH3 and MMQ cell lines decreased gradually with the extension of time
图2. 低表达miR-210-3p对MMQ与GH3细胞株的影响,低表达miR-210-3p后,GH3和MMQ细胞株的增殖随着时间延长,逐渐下降
3.3. 细胞迁移情况
我们采用Transwell法检测了MMQ细胞与GH3细胞跨Matrigel胶的移行能力,结果显示,低表达miR-210-3p组的细胞迁移跨胶能力下降(P < 0.05),但在NC组与空白组中,GH3细胞与MMQ细胞的迁移能力较强,NC组与空白组(阴性对照组)对比无明显差异(见图3)。
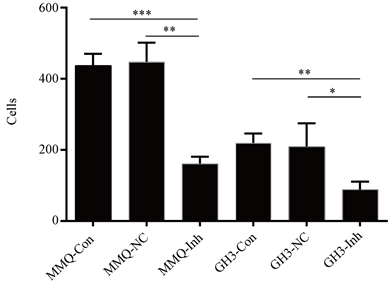 Note: *P < 0.05, **P < 0. 01, ***P < 0.001.
Note: *P < 0.05, **P < 0. 01, ***P < 0.001.
Figure 3. The effect of low expression of mir-210-3p on the migration ability of MMQ and GH3 cell lines, while the migration ability of MMQ and GH3 cell lines with low expression of Mir-210-3p was decreased
图3. 低表达miR-210-3p后对MMQ和GH3细胞株迁移能力的影响,低表达miR-210-3p的MMQ与GH3细胞株迁移能力下降
3.4. 细胞中相关蛋白表达情况
我们采用Western-blotting检测低表达miR-210-3p后,GH3与MMQ细胞中的靶基因FGFRL-1蛋白表达,结果显示低表达miR-210-3p组的MMQ与GH3细胞中,靶基因FGFRL-1的蛋白表达明显高于NC组与空白组(P < 0.05),NC组与空白对照组(阴性对照组)对比无明显差异,内参为Tubulin (见图4)。
 (a)
(a) (b)Note: *. P < 0.05. **. P < 0. 01, ***. P < 0. 001, ****P < 0.0001.
(b)Note: *. P < 0.05. **. P < 0. 01, ***. P < 0. 001, ****P < 0.0001.
Figure 4. The protein expression of target gene FGFRL-1
图4. 靶基因FGFRL-1的蛋白表达情况
3.5. miR-210-3p与FGFRL-1靶点预测与双荧光素酶报告
我们通过TargetScan7.2在线预测软件发现miR-210-3p与FGFRL-1之间存在靶向结合位点(见图5)。因此,我们通过双荧光素酶报告进行了验证,结果显示pmirGLO/FGFRL-1-UTR+miR-210-mim组中荧光素酶活性明显低于无关序列组(P < 0.05),结果进一步确定了miR-210-3p的靶基因是FGFRL-1 (见图6)。

Figure 5. TargetScan7.2 software predicted target genes
图5. TargetScan7.2软件预测靶基因
 Note: *. P < 0. 05, **. P < 0. 01, ***. P < 0. 001.
Note: *. P < 0. 05, **. P < 0. 01, ***. P < 0. 001.
Figure 6. Double luciferase reporter gene
图6. 双荧光素酶报告基因
4. 讨论
我们知道垂体腺瘤是常见的颅内良性肿瘤,近年来,随着体检的普及与人们对健康的重视,垂体瘤的检出率越来越高,针对垂体瘤的治疗,我们现在还是手术为主,但是该疾病的复发和周围侵袭是影响垂体瘤治疗的一大关键因素。这提示我们是否可以从分子生物学角度来考虑疾病的诊疗,目前对于miRNA是否参与垂体瘤发生发展的的作用机制较少 [13] [14],而miR-210-3p是否参与垂体瘤腺瘤的发病和进展我们尚且未见相关文献报道。此次我们在大鼠垂体瘤MMQ与GH3细胞系中先进行了初步探索,发现了miR-210-3p与MMQ与GH#垂体瘤细胞的增殖与迁移有一定相关性,我们知道,垂体腺瘤的发展过程中,垂体腺瘤细胞数目和迁移能力均可影响到垂体瘤的进展,通俗来讲,数目越多,垂体瘤越大,迁移能力越强,越容易向周围组织侵袭。所以,一定程度上我们可以说垂体瘤细胞的增殖活力,可反映垂体瘤的复发程度。本研究发现,低表达miR-210-3p可抑制大鼠MMQ与GH3垂体瘤细胞的增殖和迁移,提示miR-210-3p可能通过干预垂体瘤细胞的增殖从而参与垂体瘤的形成过程。
关于miRNA我们知道它的主要作用途径是通过作用于靶蛋白mRNA抑制靶基因RNA转录后的基因表达,从而来影响对应靶蛋白及相关的信号通路 [15]。Amaral等 [16] 发现,多种microRNA可以通过调节靶基因表达水平,从而参与ACTH分泌型垂体腺瘤发病过程。本研究结果显示,低表达miR-210-3p后,MMQ与GH3细胞中FGFRL-1的表达增加,而FGFRL-1在相关研究 [9] 中发现FGFRL-1是一种单通道I型膜蛋白,属于FGF受体家族,成熟的FGFRL-1由354个氨基酸胞外结构、3个类似IgG的c2型结构域、21个氨基酸跨膜段和134个氨基酸胞质结构组成。调节大多数细胞类型的生长、凋亡、分化和迁移,细胞中FGFRL-1的表达量与细胞增殖能力呈反比 [10]。本研究结果提示miR-210-3p在MMQ与GH3垂体瘤细胞系中,能通过调节靶基因FGFRL-1的表达来影响垂体瘤细胞的增殖与迁移,参与垂体瘤细胞的病理生理过程。在预测软件TargetScan7.2中我们发现了miR-210-3p的靶基因是FGFRL-1,相关研究表明FGFRL-1参与了多种肿瘤的发生以及发展 [10]。我们知道侵袭性垂体瘤是神经外科非常棘手的问题,因为肿瘤侵袭性生长使得外科手术无法全切除,导致肿瘤复发。尽管肿瘤发生和发展的机制尚不清楚,但肿瘤部分生物学特性已经阐明,一些基因表达改变在肿瘤发生中起重要作用。一些基因表达改变与垂体腺瘤侵袭性相关,如成纤维生长因子(fibroblast growth factors, FGF)和成纤维生长因子受体(fibroblast growth factorreceptors, FGFR)基因表达水平改变与垂体腺瘤侵袭性相关。与非侵袭性垂体腺瘤相比,FGF基因在侵袭性垂体腺瘤表达上调 [1]。在垂体瘤细胞中,FGFR基因过表达可诱导细胞侵袭性生长 [18]。本研究采用了双荧光素酶报告实验进一步证实了FGFRL-1是miR-210-3p的靶基因,miR-210-3p可调节FGFRL-1且miR-210-3p在GH3和MMQ细胞中的表达水平与FGFRL-1呈反比。
本研究的通过低表达GH3与MMQ大鼠垂体瘤细胞中的miR-210-3p,研究其对MMQ和GH3细胞生物学行为的影响,结果证实,低表达miR-210-3p能够抑制大鼠MMQ和GH3垂体瘤细胞的增殖与迁移,但是本实验未在人体组织和人体垂体瘤组织中验证,只是初步在动物肿瘤细胞模型上进行了初步研究,后续会在垂体瘤肿瘤组织层面进行相关研究与实验。初步我们得出的结论是低表达miR-210-3p抑制了大鼠垂体瘤MMQ和GH3细胞的增殖与迁移,miR-210-3p可能成为治疗垂体瘤的一个潜在靶点。
基金项目
国家自然科学基金青年项目(81602182)。
致谢
感谢姚维成主任在文章撰写过程的指导,感谢王建鹏主任的国家自然科学基金青年项目(81602182,miR-340通过Notch信号通路介导GSCs的“干性”抑制)以及同门谭维康的实验帮助和蒋亚楠的作图帮助。
NOTES
*第一作者。
#通讯作者。