1. 引言
真菌性角膜炎是一种由真菌病原体入侵角膜导致的严重的化脓性角膜感染,通常是溃疡性角膜感染,如果治疗不当,可能导致角膜破坏和严重失明的眼内炎。最常见的病原体是丝状真菌如镰刀菌和烟曲霉菌。普遍存在于发展中国家农业地区,常发生于角膜外伤史,佩戴隐形眼镜,慢性眼表疾病,局部或全身长期使用抗生素或类固醇 [1] [2] [3] [4]。真菌性角膜炎的药物治疗失败是很常见的,目前可用的抗真菌药物存在多种缺点,如眼部渗透性差,生物利用度不可预测,以及全身用药相关的不良反应。因此需要更有效的局部抗真菌治疗。为了增加抗真菌滴眼液的使用量,重要的是要研究其他种类的局部使用的抗真菌药物的使用情况 [5] [6]。
免疫调节在真菌性角膜炎(FK)的发病机制中起重要作用。白细胞介素作为重要的促炎细胞因子,参与角膜真菌感染的免疫防御过程。IL-6在角膜的感染和炎症过程中起着至关重要的作用,IL-6是真菌性角膜炎潜在治疗靶标,真菌感染通过IL-6介导的跨细胞信号传导促进巨噬细胞和T细胞活化调节免疫细胞迁移和诱导趋化因子分泌 [7] [8] [9]。在真菌性角膜炎中,眼表的粘膜上皮细胞和免疫细胞分泌IL-1β。信号通路Dectin-1/syk,TLR4,LOX-1等参与真菌性角膜炎中IL-1β的产生 [10] [11] [12] [13] [14]。肿瘤坏死因子-α (TNF-α)是一种多功能细胞因子,在炎症、感染中是重要免疫功能的中枢生物介质。已有多项研究发现真菌性角膜炎中IL-1β,TNF-α,IL-6表达升高,而抑制IL-1β,TNF-α,IL-6的表达会减轻真菌性角膜炎的炎症反应 [15] [16] [17]。
黄芩素是存在于黄芩干燥根中的一种酚类黄酮。黄芩素具有明显抗炎的作用,现在已经应用于感染、肝病、心脑血管疾病、神经退行性疾病等疾病中 [18]。在脂多糖诱导的RAW264.7细胞中,黄芩素通过ER依赖途径抑制诱导型一氧化氮合酶、环氧合酶-2和肿瘤坏死因子-α基因的表达,抑制一氧化氮的产生,以及炎性细胞因子(IL-1β、前列腺素E2和肿瘤坏死因子-α)的产生,从而发挥抗炎作用 [19]。黄芩素通过减弱血清和肝脏IL-6、IL-1β和TNF-α的升高,对扑热息痛所致小鼠急性肝损伤起保护作用 [20]。黄芩素通过阻断Toll样受体4的表达,抑制髓过氧化物酶活性及肿瘤坏死因子-α和白细胞介素-1β水平,在LPS诱导的乳腺炎小鼠中减轻炎症反应 [21]。而尚未发现黄芩素在真菌性角膜炎中的应用研究。本文主要研究黄芩素在真菌性小鼠角膜炎中的抗炎作用。
2. 实验材料
2.1. 实验物品
2.1.1. 实验对象
8周龄SPF级C57BL/6雌鼠,体重19~23 g,购自济南鹏跃实验动物有限公司(中国济南)。所有C57BL/6小鼠根据ARVO关于在眼科动物中使用动物眼科及视觉的声明,这项研究遵循了赫尔辛基宣言的宗旨。
2.1.2. 实验烟曲霉菌
中国普通微生物文化采集中心(中国北京)提供烟曲霉菌株(NO3.0772)。
2.1.3. 实验细胞
RAW264.7从中国科学院上海获得。
2.2. 实验主要相关耗材
2.2.1. 真菌培养所需耗材及试剂
Sabouroud培养基 北京Solarbio公司;无水乙醇 南京宏益化学试剂有限公司;磷酸盐缓冲液(PBS)北京Solarbio公司。
2.2.2. 制备动物模型相关耗材与试剂
封口膜 美国National Can公司;8%水合氯醛,青岛大学附属医院提供;1 ml注射器,山东新华安得医疗用品有限公司;外科5-O黑丝线,上海浦东金环医疗用品股份有限公司;75%酒精,南京宏益化学试剂有限公司;眼科显微器械,美国Fisher Scientific公司。
2.2.3. 小鼠角膜局部处理及RAW细胞处理所需试剂
黄芩素(BE) MCE公司;二甲基亚砜(DMSO) 北京Solarbio公司。
磷酸盐缓冲液(PBS)北京Solarbio公司。
2.2.4. Real-time PCR相关试剂及耗材
RNAiso Plus大连宝生物工程有限公司;EP管 美国Corning公司;氯仿 南京宏益化学试剂有限公司;异丙醇 南京宏益化学试剂有限公司;无水乙醇 南京宏益化学试剂有限公司;八联排 美国Axygen公司;DEPC水 上海生物工程有限公司;RNAisoPlus 中国大连TaKaRa;SYBR PremixExTaq 中国大连TaKaRa;Prime Script RT reagent kit with g DNA Eraser 中国大连TaKaRa。
2.2.5. Elisa相关试剂及耗材
小鼠的IL-1β酶联免疫吸附测定试剂盒R & D Systems (SanDiego, CA, USA);小鼠的TNF-α酶联免疫吸附测定试剂盒R & D Systems (SanDiego, CA, USA);小鼠的IL-6酶联免疫吸附测定试剂盒R & D Systems (SanDiego, CA, USA)。
2.3. 实验方法
2.3.1. 烟曲霉菌培养与菌丝的制备
取冻存的烟曲霉菌标准菌株,在超净台上,将其接种于Sabouroud琼脂固体培养基,置于28℃的恒温箱内孵育7天。在显微镜下观察到菌株生长状态,待其生长良好时,用消毒后洁净的接种环刮取培养基来收集烟曲霉菌的孢子和菌丝,接种于经过高压消毒后的300 ml Sabouroud液体培养基的无菌烧瓶内,用纱布严密包扎盛有液体培养基的无菌烧瓶瓶口。放置37℃的120 rpm摇床培养箱中培养5天。当烟曲霉菌菌丝生长至团块状菌丝形态时,收集菌丝于无菌玻璃管中,研磨棒研磨并制备均匀混悬液。将研磨后菌液置于离心机4℃,4500 rpm,离心10分钟,离心结束后弃上清,并用无菌PBS洗涤菌丝沉淀3次后再次离心10分钟后弃上层培养液。一部分加入不含胎牛血清的DMEM混匀,得到有活性的烟曲霉菌菌丝;另一部分菌丝中加入75%的酒精混匀,并置于4℃冰箱过夜灭活菌丝。第二天将其离心后弃上层酒精,再使用 PBS 洗涤菌丝沉淀3次,再次离心,弃去洗涤液,然后细胞培养液得到灭活的菌丝悬液。细胞计数板并调整其终浓度为1 × 107 CFU/ml。
2.3.2. 小鼠真菌性角膜炎模型的建立
采用8%水合氯醛腹腔内注射法对C57BL/6小鼠进行麻醉,麻醉成功后,将小鼠并固定于操作台。显微镜下,用洁净刀片在小鼠角膜中央划伤上皮深达浅基质层,(约2 mm直径范围),然取已制备好的浓度为1 × 107 CFU/mL的具有活性的烟曲霉菌菌丝5 μL覆盖于角膜上皮缺损位置,在菌丝表面放置上软性角膜接触镜,最后用5-0缝合线缝合上下眼睑1针,使其闭合。右眼为空白对照组。将小鼠随机分为两组,分别为BE处理组,和DMSO处理组。第一天拆线后每天三次给药处理,给药方式为眼水点眼,并于1,3天拍照并对小鼠角膜进行炎症评分。炎症评分和分度,评分标准参考Wu [22]。
2.3.3. RAW细胞处理
将培养在6孔板或12孔板的RAW细胞于温箱培养24小时后,给予灭活烟曲霉菌菌丝刺激1小时后,加入BE或DMSO,菌丝感染8小时后收集12孔板的细胞用于PCR实验,用于检测IL-1β,TNF-α和IL-6的mRNA表达水平。菌丝感染24小时后收集24孔板的上清液用于Elisa实验用于检测IL-1β,TNF-α和IL-6的蛋白表达水平。
2.3.4. Real-time RT-PCR实验方法
1. Total RNA的提取
(1) 将含有角膜或者细胞的RNA裂解液的EP管置于冰盒上,使其充分裂解30分钟。
(2) 将EP管于4℃,12000 rpm,离心5分钟后取上清并置于另一洁净EP管中。
(3) 加入与RNA裂解液1/5体积量相等的三氯甲烷,并上下颠倒震荡EP管15秒使其彻底混匀。室温放置5分钟后再置于4℃,12000 rpm,离心15分钟。
(4) 离心后小心取出EP管,小心地吸取最上层的液体转移至另一洁净EP管中,注意不要碰到蛋白层以及最下层液体。
(5) 向含有最上层液体的EP管中加入等体积的异丙醇,并将EP管上下颠倒震荡混匀15秒,并置于室温下10分钟。
(6) 置于离心机,4℃,12,000 rpm,离心10分钟后弃上清液,此时乳白色的RNA沉淀于EP管管底,弃掉上清液。
(7) 加入75%酒精(使用DEPC水配制),并上下颠倒15秒。置于4℃,12,000 rpm,离心5分钟后小心弃掉酒精。
(8) 室温下干燥EP管沉淀约20分钟后,加入适量DEPC水10~15 μl,吹打、震荡使其彻底溶解后,立即测定RNA含量以及纯度。
2. Total RNA含量及浓度测定
使用核酸浓度分析设备测定260 nm、280 nm处吸光度(opticaldensity,OD值)以及两者比值,根据所测样本RNA浓度建立2 μg RNA体系,计算所需RNA体积。
3. PCR
配置相应混合待测液,立即置PCR仪上,进行内参及目的基因扩增反应。扩增条件为:95℃预变性30 s → 95℃变性5 s、60℃ 30 s (重复40个循环) → 95℃退火、延伸15 s → 60℃ 30 s → 95℃溶解15 s。反应结束后,根据各样本的内参及目的基因循环数,计算目的分子的mRNA相对表达量。引物序列见表1。

Table 1. Primer sequence of target gene
表1. 目的基因引物序列
F, forward; R, reverse.
2.3.5. ELISA
按照蛋白酶抑制剂:PBS缓冲液为495:5配制小鼠角膜保存液。每组6个角膜。研磨器进一步磨碎角膜组织,然后离心后取上清。24孔板的上清液于1500 g离心取上清液。
按照ELISA试剂盒的说明书进行实验:
(1) 96孔板中加入Capture Antibody室温下孵育一整夜。
(2) 弃去液体,加入Wash Buffer,浸泡1~2分钟,拍干,重复洗板3次。
(3) 加入Reagent Diluent在室温下孵育1小时。
(4) 重复(2)步骤洗涤。
(5) 加入标准品工作液以及样本,室温孵育2小时。
(6) 重复(2)步骤洗涤。
(7) 加入Detection Antibody在室温下孵育2小时。
(8) 重复(2)步骤洗涤。
(9) 加入Streptavidin-HRP在室温避光下孵育20分钟。
(10) 重复(2)步骤洗涤。
(11) 加入Substrate Solution在室温避光下孵育20分钟。
(12) 加入Stop Solution立即用酶标仪在450 nm波长测量各孔的光密度(OD)值。
(13) 根据OD值,计算样品浓度。
2.4. 统计学方法
每项实验均独立重复至少三次,实验数据用x ± s表示,对各组实验进行统计学分析,采用单因素方差分析(ANOVA)对三组或三组以上的数据进行比较,并采用未配对双尾t检验对多组数据进行比较。P < 0.05差异具有统计学意义。
3. 结果
3.1. 黄芩素处理后小鼠烟曲霉菌角膜炎临床评分
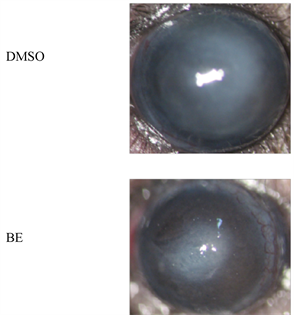
在烟曲霉菌角膜炎小鼠第三天,DMSO处理组小鼠角膜溃疡面积大,角膜水肿,表面粗糙欠光滑,虹膜纹理不清,少数病例还可引起角膜穿孔。而黄芩素处理组小鼠角膜溃疡面积减小,角膜尚透明,无水肿(图1(a))。DMSO处理组烟曲霉菌性角膜炎模型与黄芩素处理组烟曲霉菌性角膜炎模型的临床评分相比,黄芩素处理组临床评分明显低于DMSO处理组,差异有统计学意义(图1(b))。
 (a)
(a) 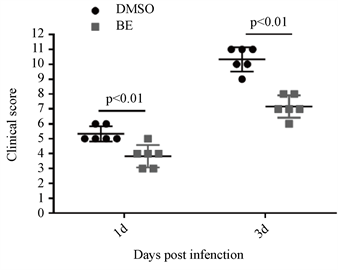 (b)注:(a) 烟曲霉菌感染小鼠角膜三天后黄芩素素处理组与DMSO处理组临床表现在裂隙灯下拍照;(b) 烟曲霉菌感染小鼠角膜一,三天后黄芩素素处理组与DMSO处理组临床评分比较(n = 6组)。
(b)注:(a) 烟曲霉菌感染小鼠角膜三天后黄芩素素处理组与DMSO处理组临床表现在裂隙灯下拍照;(b) 烟曲霉菌感染小鼠角膜一,三天后黄芩素素处理组与DMSO处理组临床评分比较(n = 6组)。
Figure 1. The clinical manifestations and clinical scores of BE in the treatment of A. fumigatus keratitis in mice
图1. 黄芩素治疗小鼠烟曲霉菌角膜炎的临床表现及临床评分
3.2. 黄芩素降低小鼠烟曲霉菌角膜炎促炎因子mRNA的产生
检测小鼠烟曲霉菌角膜炎模型第三天,角膜中促炎因子mRNA的变化。PCR结果显示,黄芩素处理组与对照组相比,明显降低了IL-1β,TNF-α和IL-6的mRNA表达。差别具有统计学意义(图2(a)~(c))。
3.3. 黄芩素降低小鼠烟曲霉菌角膜炎促炎因子蛋白的产生
检测小鼠烟曲霉菌角膜炎模型第三天,角膜中促炎因子蛋白的变化。Elisa结果显示黄芩素处理组与对照组相比,明显降低了IL-1β,TNF-α和IL-6的蛋白表达。具有统计学意义(图3(a)~(c))。
3.4. 黄芩素处理后,RAW中促炎因子的mRNA变化
灭活烟曲霉菌处理RAW1小时后,用黄芩素或DMSO处理7小时,检测IL-1β,TNF-α和IL-6的mRNA表达。PCR结果显示,单纯烟曲霉菌处理组IL-1β,TNF-α和IL-6的mRNA表达升高,烟曲霉菌+ DMSO组与单纯烟曲霉菌处理组相比,炎症因子无任何变化,排除DMSO对实验造成的影响,烟曲霉菌 + 黄芩素组与单纯烟曲霉菌处理组相比,降低IL-1β,TNF-α和IL-6的mRNA表达(图4(a)~(c))。
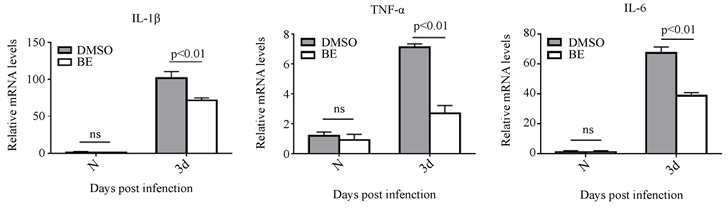 注:(a)~(c) 烟曲霉菌感染小鼠角膜第三天,与DMSO处理相比,黄芩素组角膜中IL-1β、TNF-α、IL-6mRNA表达降低(n = 6组)。
注:(a)~(c) 烟曲霉菌感染小鼠角膜第三天,与DMSO处理相比,黄芩素组角膜中IL-1β、TNF-α、IL-6mRNA表达降低(n = 6组)。
Figure 2. The mRNA expression of pro-inflammatory factors in the BE treatment group and DMSO treatment group on the third day of the cornea of mice infected by A. fumigatus
图2. 烟曲霉菌感染小鼠角膜第三天黄芩素处理组与DMSO处理组促炎因子mRNA表达
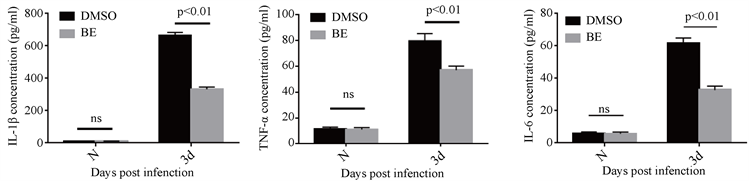 注:(a)~(c) 烟曲霉菌感染小鼠角膜第三天,与DMSO处理相比,黄芩素组角膜中IL-1β、TNF-α、IL-6蛋白表达降低(n = 6组)。
注:(a)~(c) 烟曲霉菌感染小鼠角膜第三天,与DMSO处理相比,黄芩素组角膜中IL-1β、TNF-α、IL-6蛋白表达降低(n = 6组)。
Figure 3. The expression of pro-inflammatory factor proteins in the BE treatment group and DMSO treatment group on the third day of the cornea of mice infected by A. fumigatus
图3. 烟曲霉菌感染小鼠角膜第三天黄芩素处理组与DMSO处理组促炎因子蛋白表达
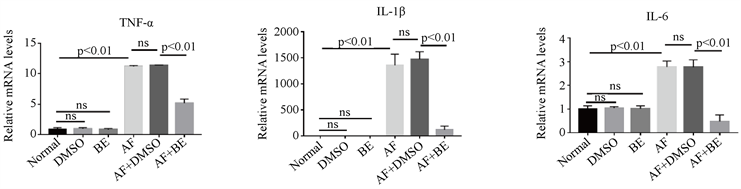 注:(a)~(c) 烟曲霉菌刺激RAW细胞,用黄芩素或DMSO处理,与DMSO处理相比,黄芩素组角膜中IL-1β、TNF-α、IL-6mRNA表达降低(n = 6组)。
注:(a)~(c) 烟曲霉菌刺激RAW细胞,用黄芩素或DMSO处理,与DMSO处理相比,黄芩素组角膜中IL-1β、TNF-α、IL-6mRNA表达降低(n = 6组)。
Figure 4. RAW cells stimulated by A. fumigatus, the expression of pro-inflammatory factors mRNA in the BE treatment group and DMSO treatment group.
图4. 烟曲霉菌刺激RAW细胞,黄芩素处理组与DMSO处理组促炎因子mRNA表达
3.5. 黄芩素处理后,RAW中促炎因子的蛋白变化
灭活烟曲霉菌处理RAW1小时后,用黄芩素或DMSO处理23小时,检测IL-1β,TNF-α和IL-6的蛋白表达。Elisa结果显示,单纯烟曲霉菌处理组IL-1β,TNF-α和IL-6的蛋白表达升高,与对照组DMSO组相比,黄芩素组IL-1β,TNF-α和IL-6的蛋白表达下降。说明黄芩素通过抑制炎症因子的表达减轻炎症反应(图5(a)~(c))。
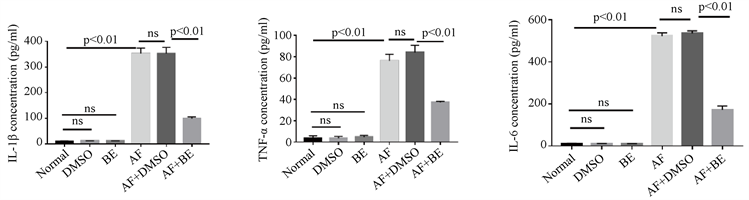 注:(a)~(c) 烟曲霉菌刺激RAW细胞,用黄芩素或DMSO处理,与DMSO处理相比,黄芩素组角膜中IL-1β、TNF-α、IL-6蛋白表达降低(n = 6组)。
注:(a)~(c) 烟曲霉菌刺激RAW细胞,用黄芩素或DMSO处理,与DMSO处理相比,黄芩素组角膜中IL-1β、TNF-α、IL-6蛋白表达降低(n = 6组)。
Figure 5. RAW cells stimulated by A. fumigatus, the expression of pro-inflammatory factor proteins in the BE treatment group and DMSO treatment group
图5. 烟曲霉菌刺激RAW细胞,黄芩素处理组与DMSO处理组促炎因子蛋白表达
4. 讨论
真菌性角膜炎是一种严重的溃疡性化脓性疾病,患者主要是发展中国家的农民,因其治疗手段有限,有效药物匮乏,角膜供体缺乏,导致致盲率很高,并有失明风险。引起角膜炎的常见致病真菌是曲霉,镰刀菌,念珠菌,弯孢菌和青霉菌,其中镰刀菌和曲霉菌是主要的 [23] [24],真菌感染角膜时,首先触发先天性免疫,激活的先天免疫随后会导致有效的适应性免疫 [25]。在真菌和宿主之间接触后,真菌可以被宿主上皮细胞和免疫细胞表达的模式识别受体(PRR)识别。PPR包括Toll样受体(TLR,包括TLR2和TLR4),C型凝集素受体(CLR,Dectin-1,Dectin-2和Mincle)和NOD样受体(NLR)并不直接有助于真菌识别。在烟曲霉性角膜炎期间,识别受体的表达增加可导致下游IL-1β,TNF-α,IL-6升高,明显高于非角膜炎对照组。IL-1β,IL-6被认为是反映炎症严重程度的标志物,然而过度表达炎症成分可能会对宿主产生破坏性影响,造成导致角膜细胞和组织成分的破坏引起角膜透明度降低,角膜水肿,混浊溃疡面积增加。而抑制过度炎症反应可能会改善真菌性角膜炎患者的预后 [26] [27]。
黄芩素是一种广泛存在于植物中的黄酮类化合物,具有明显的抗炎,抗氧化、抗病毒、抗菌等多种药理活性。其中抗氧化和抗炎作用已在各种疾病模型中得到证实,包括糖尿病、心血管疾病、炎症性肠道疾病、痛风和类风湿性关节炎、哮喘、神经退行性疾病、肝脏和肾脏疾病、脑脊髓炎等。并且黄芩素对人体正常的细胞几乎没有毒性 [28]。有报道黄芩素通过抑制巨噬细胞MAPK和NFκB信号转导通路的激活,抑制炎性细胞因子IL-1β、IL-6、IL-8和肿瘤坏死因子α的分泌,抑制铜绿假单胞菌感染引起的炎症反应 [29];通过抑制巨噬细胞中的IL-6、IL-8和肿瘤坏死因子-α的产生,发挥抗H5N1病毒的作用 [30];通过减少心肌组织损伤,减少中性粒细胞浸润,减少促炎细胞因子TNF-α,IL-1β的产生,缓解心肌缺血/再灌注(I/R)损伤 [31]。
在本实验结果中可以看到,在烟曲霉菌小鼠角膜炎角膜中检测到IL-1β、IL-6、TNF-α分泌增高,而黄芩素处理组会抑制IL-1β、IL-6、TNF-α炎症因子mRNA及蛋白的表达。同样,在烟曲霉菌感染的巨噬细胞中会检测到上述促炎因子的表达增加,而这些促炎因子在黄芩素处理后却表达下调,另外黄芩素处理过小鼠角膜较对照组更加透明,溃疡面积减小,虹膜纹理清楚。所以这些结果提示黄芩素具有减轻烟曲霉菌小鼠角膜炎炎症反应的作用。可为以后作为真菌性角膜炎代替药物,或者联合用药奠定基础。
参考文献
NOTES
*通讯作者。