1. 引言
香蕉是世界上热带、亚热带地区最重要的作物之一,在我国热区的农业和社会发展中具有重要的作用。但由于香蕉自身的生理特性及生产发展的限制,容易遭受水分胁迫而受害,造成很大的经济损失。因而研究香蕉的抗逆机理并研制出实用有效的抗逆药剂显得尤为迫切。
在逆境条件下植物的膜脂过氧化反应和保护酶系统包括超氧化物歧化(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等。资料表明,干旱诱导的膜脂过氧化是造成植物细胞膜损伤的关键因素,而膜伤害是导致植物组织伤害和衰老的重要诱导因素,但同时植物可启动保护酶系统来有效防御和清除自由基 [1]。小麦、花生、甘草、沙棘等方面的研究均证明保护酶活性与植物抗旱性有一定关系 [2] [3],但有关香蕉在干旱胁迫下体内保护酶活性与植物抗旱性关系的报道较少 [4]。
许多研究表明,植物抗旱性与其清除自由基的能力相关 [5],外源自由基清除剂对植物具有一定的抗旱保护作用 [6]。本文主要研究了维生素C (Vc)、岩藻糖(Fo)、苯甲酸钠(Cy)、半胱胺酸(Se)、乙醇胺(Ea)等五种药剂对香蕉幼苗抗旱性的作用。以这五种药剂作为外源自由基清除剂分别进行预处理,能降低干旱条件下香蕉叶片细胞的膜脂过氧化程度和膜透性增加程度以及过氧化氢酶活性的提高幅度,延缓了超氧歧化酶活性的下降幅度,减少丙二醛(MDA),超氧自由基(
)在叶片内的积累从而提高了香蕉幼苗的抗旱能力 [7]。选用五种不同的自由基清除剂的最佳处理浓度进行香蕉干旱胁迫试验,测定香蕉叶片丙二醛(MAD)含量、超氧自由基(
)和保护酶(SOD、POD、CAT)活性,旨在探讨干旱胁迫对香蕉叶片保护酶系统与抗旱性的关系,同时选出最佳处理药剂,为香蕉抗旱机理研究提供理论依据。
2. 材料与方法
2.1. 供试材料
试验材料巴西蕉(Musa AAA Giant Cavendish cv. Baxi)幼苗由中国热带农业科学院组培中心提供,幼苗长势相对一致,含五片展开叶及一未展开心叶,生长健壮正常,无病虫害。实验中主要采用维生素C (Vc)、岩藻糖(Fo)、苯甲酸钠(Cy)、半胱胺酸(Se)、乙醇胺(Ea)等五种抗旱药剂。
2.2. 实验设计与材料处理
幼苗取回后于室外培养1 d,第2 d去土洗净根部后转入培养室,室内培养条件为:光照强度80 μmol∙m−2∙s−1,光照时间14 h∙d−1,昼夜温度27℃/21℃,相对湿度90%以上,培养过程加盖薄膜保湿润。经1/2 Hoagland培养液水培2 d恢复生长后,于次日早晨8:00用五种药剂均匀喷施叶面和叶背,以叶片有明显的水珠下滴为标准。在培养室中继续水培1 d后转入浓度为10% PEG-6000中进行水分胁迫,24 h后取相同药剂处理浓度的香蕉幼苗心叶下第一张叶片3张,去除中脉,剪碎混合后取样测定生理指标,每个样品平行测定3次。
采用随机区组试验设计法,设Vc、Fo、Cy、Se、Ea五种药剂处理,分别用五种药剂厂家推荐药效浓度水平(Vc 12.5 mmol∙L−1、Fo 9.0 mmol∙L−1、Cy 8.0 mmol∙L−1、Se 10.0 mmol∙L−1、Ea 32.0 mmol∙L−1,含2‰ Tween-40)处理,设喷施蒸馏水(含2‰ Tween-40)为胁迫对照。每水平重复3次,以不加药剂为对照,各项指标均测定3次,取其平均值。
2.3. 测定方法
2.3.1. 丙二醛(MDA)的测定
MDA的测定用硫代巴比妥酸(TBA)法 [8]。
2.3.2. 超氧自由基(
)产生速率的测定
以香蕉幼苗叶片为材料,参照华南热带农业大学植物生理生化教研室1998年编写的《植物生理生化试验讲义》进行。
2.3.3. SOD活性测定
参考张雯和张志良(2003)的方法 [9]。
2.3.4. POD活性测定
参考张雯和张志良(2003)的方法 [9]。
2.4. 数据分析
所得数据先用Excel处理后,再用SAS 9.0进行方差分析。
3. 结果与分析
3.1. Vc、Fo、等五种药剂对水分胁迫下香蕉幼苗叶片
产生速率的影响
超氧阴离子(
)即活性氧,它是一种自由基常会对植物细胞产生氧化胁迫作用,尤其是在干旱、盐渍、极端温度等逆境条件下,这种作用更为突出。在正常条件下,植物体内的自由基的产生和清除处于平衡状态,一旦植物遭受低温寒害,这种平衡状态就会被破坏,活性氧的产生大于清除,造成活性氧的大量积累,从而使膜脂产生过氧化作用 [10]。由于水分胁迫能使植物自由基增多,而自由基能直接或间接启动膜脂的过氧化作用,导致膜的损伤或破坏,故通过测定自由基在植物体内的浓度或产生速率增减,即可判定香蕉抗旱性的强弱。自由基(
)产生的速率越小说明香蕉抗旱性越强,速率越大侧反之,即自由基(
)的产生速率与香蕉抗旱性成反相关性 [11]。
如图1所示,在水分胁迫下,Vc、Fo、等五种药剂可降低香蕉幼苗叶片
产生速率。但不同药剂处理对
产生速率的增减也不相同。Vc 12.5 mmol∙L−1、Fo 9.0 mmol∙L−1、Cy 8.0 mmol∙L−1、Se 10.0 mmol∙L−1、Ea 32.0 mmol∙L−1处理后与对照相比较分别降低香蕉幼苗叶片中
产生速率为64.7875%,69.3567%,46.0104%,44.2919%,58.0813%,效果都达到了极显著。但Vc、Fo、Ea三种药剂相对其它Cy、Se两种药剂对降低
产生速率的幅度更大作用更好。结果表明可以通过喷洒Vc、Fo、等五种自由基清除剂来降低自由基(
)产生的速率而减少
在体内的积累从而提高香蕉的抗旱性。同时,选用Vc、Fo、Ea等三种药剂的效果更好。
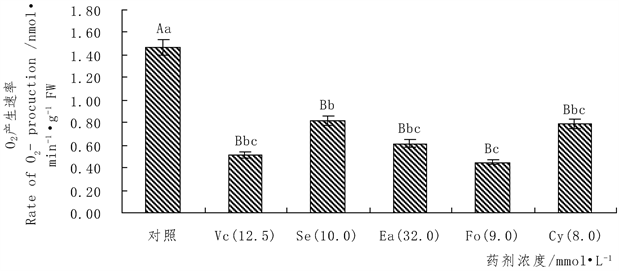
Figure 1. Effects of different pharmaceutical treatment on banana leaves
of a rate. Note: “lowercase letters,” said compared with the control group in the p < 0.05 level significantly, “Capital letters” that compared with the control group in the p < 0.01 level significantly, The picture below is the same
图1. 不同药剂处理对香蕉幼苗叶片
产生速率的影响。注:“小写字母”表示与对照组相比在p < 0.05水平上差异显著,“大写字母”表示与对照组相比在p < 0.01水平上差异显著,下图同
3.2. Vc、Fo、等五种药剂对水分胁迫下香蕉幼苗叶片丙二醛(MDA)的影响
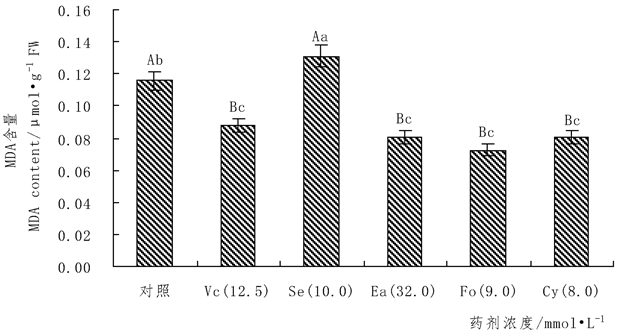
Figure 2. Effects of different chemical treatments on malondialdehyde (MDA) of banana seedling leaves
图2. 不同药剂处理对香蕉幼苗叶片丙二醛(MDA)的影响
MDA是膜脂过氧化的中间产物,具有很强的细胞毒性,会严重的损害生物膜,其损伤主要是膜中的蛋白质的聚合或交联以及膜中类脂的变化引起的,另外MDA能与膜中的蛋白质的氨基和核酸反应生成Shiff碱,降低膜的稳定性,导致胞内物质泄 [12],它的含量可以作为植物受到胁迫的伤害程度的重要指标 [13]。
MDA含量变化与膜透性变化趋势相一致,MDA含量越高说明膜透性越大细胞膜脂过氧化水平增加 [14],质膜透性是反映细胞损伤的主要指标 [15],故香蕉幼苗叶片MDA含量越高说明抗旱性越弱,是与香蕉的抗旱性成反相关性。
如图2所示,在水分胁迫下,Se未能是体内丙二醛(MDA)减少,但Vc、Fo、Cy、Ea等四自由基清除剂都可降低丙二醛(MDA)在香蕉幼苗叶片中的含量并都与对照组达到极显著水平,且经Cy、Ea处理的使叶片内丙二醛(MDA)的含量都降低了30.2593%,经Fo处理的使叶片内丙二醛(MDA)含量降低了37.4644%,而经Vc处理只能降低24.2074%。结果表明通过喷洒Fo、Cy、Ea三种自由基清除剂对提高香蕉抗旱性的效果更好。
3.3. Vc、Fo、等五种药剂对水分胁迫下香蕉幼苗叶片POD活性的影响

Figure 3. Effects of different chemical treatments on the POD activity of banana seedling leaves
图3. 不同药剂处理对香蕉幼苗叶片POD活性的影响
POD也是植物体内抗氧化保护酶系统的重要酶,催化H2O2形成O2和H2O,有效阻止
和H2O2的积累,限制潜在的氧伤害。POD活性变化的在一定程度上表明植物在干旱胁迫条件下,机体内活性氧清除系统的功能能维持相对较高的水平,减轻了活性氧的伤害。当POD的活性在很长一段时间内维持一个较高的稳定水平则有效阻止
和H2O2的积累,减少了对植物的伤害,有利于增强植物的抗旱胁迫性。POD的活性越高香蕉的抗旱性越强,活性越低则反之。
如图3所示,在水分胁迫下,Vc、Fo、等五种药剂处理都能使POD的活性增加并维持在一个稳定的水平,虽然与对照组比较都未达到显著水平,但其中Se、Cy两种药剂处理都使POD的活性相比对照组增加了103.0928%,远高于Vc处理的7509454%,Se处理的60.1371%,Fo处理的15.8423%。结果表明Vc、Fo、等五种药剂处理能使POD的活性增加从而提高香蕉的抗旱性,且Se、Cy两种药剂处理效果更佳。
3.4. Vc、Fo、等五种药剂对水分胁迫下香蕉幼苗叶片SOD活性的影响
SOD是生物体内重要的保护酶之一,是重要的活性氧清除酶。当外来胁迫导致植物体内产生大量活性氧时,它能及时有效清除自由基,保护细胞免受活性氧伤害,维持体内活性氧代谢的平衡,保护膜结构,减轻有毒物质对生物细胞的毒害,它的主要功能是催化超氧物阴离子自由基
发生歧化反应生成H2O2和O2,从而清除
对细胞的损害,延迟或阻止细胞结构的破坏,使组织保持活力,从而使植物能在一定程度上忍耐、减弱或抵抗逆境胁迫 [14] [16]。SOD活性的升高有助于提高植物的抗旱性。
如图4所示,在水分胁迫下,Vc、Fo、等五种药剂处理都能使SOD的活性增加并维持在一个稳定的水平。虽然Se处理的一组与对照组相比较效果不显著,但Vc、Fo、Cy、Ea四种药剂与对照组相比较达到极显著水平且乙醇胺(Ea)处理使SOD的活性提高了191.6530%远远高于其它三种药剂的处理结果。结果表明,Vc、Fo、等五种药剂处理都能使SOD的活性增加从而提高香蕉的抗旱性,且使用32.0 mmol∙L−1浓度的乙醇胺(Ea)效果最显著。

Figure 4. Effects of Different Chemical Treatments on SOD Activity of Banana Seedling Leaves
图4. 不同药剂处理对香蕉幼苗叶片SOD活性的影响
4. 结论与讨论
直到目前科研工作者对水分胁迫下植物体内活性氧的产生、活性氧对植物的伤害及植物保护系统的作用进行了大量研究,并取得了明显进展 [17]。在正常代谢过程中,植物细胞通过多条途径和多部位产生活性氧自由基。它能够直接或间接启动膜脂的过氧化作用,导致膜损伤和破坏 [14]。当植物受到水分胁迫时,细胞体内自由基产生和清除的平衡受到破坏而出现自由基的积累,并由此而引发或加剧细胞膜的过氧化,导致植物受到伤害。水分胁迫下香蕉叶片和细胞膜透性都明显提高,且两者的变化趋势一致,这就证明水分胁迫引发自由基的过量积累而导致膜脂过氧化加剧,进而造成膜脂过氧化产物MDA的大量积累和膜透性的破坏。故通过香蕉叶片内超氧自由基(
)和膜脂过氧化产物MDA含量的多少可以作为反映植物抗旱性强弱的重要指标。
同时,在生物进化过程中细胞内形成了防御活性氧毒害的保护酶系统,即SOD、和POD等酶类,该系统在清除超氧自由基、过氧化氢和过氧化物以及阻止或减少羟基自由基形成等方面起着重要作用。有研究证明SOD活性在抵御轻度干旱胁迫时发挥着重要作用,而在重度胁迫时POD活性作用更大 [4]。可见植物体内保护酶活性越强,其耐旱能力也越强。故通过香蕉叶片内SOD、和POD等酶活性的高低也可作为反映植物抗旱性强弱的重要指标。细胞中的各种保护酶,都有清除活性氧、抗氧化以及维持细胞正常新陈代谢的功能。但单独提高某一种酶的活性,对于生物抗氧化能力的提高影响不会很明显,只有各酶活性达到平衡、协同作用才能有效地清除活性氧。因为超氧负离子歧化产物H2O,能够还原Cu-ZnSOD活性中心Cu2+,致使酶失去活性,POD可清除完H2O2对SOD起到保护的作用;同时超氧负离子自由基能使POD失活,但SOD可清除超氧负离子,对POD酶起到保护作用,两种酶可组成相互保护的防御群网 [10]。
从以上实验我们可以得出一个结论:要证明一种植物的抗旱性强弱就必须从植物体内的细胞膜脂过氧化的程度,细胞膜透性的破坏程度和各项保护酶酶活性的高低程度综合取证。本实验主要选用了超氧自由基(
)、膜脂过氧化产物丙二醛(MDA)、超氧歧化化酶(SOD)、过氧化物酶(POD)等四项重要指标来研究维生素C (Vc)、岩藻糖(Fo)、苯甲酸钠(Cy)、半胱胺酸(Se)、乙醇胺(Ea)五种药剂对香蕉的抗旱性影响。
从以上数据分析不难看出,有的指标中是几种药剂处理都可以达到极显著水平,有的药剂在膜脂过氧化产物丙二醛(MDA)指标中反映效果比其他药剂要好,但在超氧自由基(
)指标上反映的效果却比有些药剂要差,如苯甲酸钠(Cy);有的药剂与对照组比较没有达到显著水平,如半胱胺酸(Se);有的药剂在超氧自由基(
)指标中反映效果比其他药剂要好,但在膜脂过氧化产物丙二醛(MDA)指标上反映的效果却比其它药剂要差,如维生素C (Vc);有的药剂在超氧自由基(
)指标中反映效果比其他药剂要好,但在过氧化物酶(POD)指标上反映的效果却比其它些药剂要差,如岩藻糖(Fo);但乙醇胺(Ea)在四个指标中均表现出极显著水平且相对其它四种药剂的处理效果都要好。
综上所述可知,维生素C (Vc)、岩藻糖(Fo)、苯甲酸钠(Cy)、半胱胺酸(Se)、乙醇胺(Ea)五种药剂均可通过对植物体细胞内防御活性氧毒害的保护酶系统的影响,提高香蕉抗旱能力。此结果与前人对维生素C (Vc)、半胱胺酸(Se)在香蕉抗旱的研究一致 [18],与前人对苯甲酸钠(Cy)在香蕉抗旱的研究一致 [7],与前人对岩藻糖(Fo)在香蕉抗寒的研究一致,与前人对乙醇胺(Ea)在林木上抗旱的研究一致 [19]。同时综合各项指标的变化结果,我们可以得出最佳自由基清除剂为胱胺酸(Se)。
本实验只是进一步证明了以上五种药剂对香蕉抗旱性影响的研究,并且选出乙醇胺(Ea)为最佳的自由基清除剂。但仍有以下几个方面有待进一步深入研究:① 以上五种药剂对超氧歧化化酶(SOD)、过氧化物酶(POD)影响的作用机制是什么还有待进一步研究。② 乙醇胺(Ea)只是在以上五种药剂中比较是最佳药剂,要在所有可以对香蕉抗旱性有影响的药剂中选择一种最佳药剂还需更深入,更广泛的研究,并且可以科学地投入生产实践中去。
NOTES
*通讯作者。