1. 引言
单分子操纵技术被用来研究蛋白质和DNA等生物大分子的物理、化学性质和生物功能已经超过20年 [1] [2]。其中,光镊和原子力显微镜较早的被应用于蛋白质分子的去折叠和折叠的实验,磁镊早期被应用于较长的DNA分子的拉伸实验。近年来,得益于纵向磁镊在较大拉力下精确测力问题的解决,磁镊被广泛的应用于蛋白质分子去折叠和折叠的研究 [3]。由于磁镊的测力系统和加力系统的分离,长时间的恒定力实验和蛋白质折叠和去折叠平衡态的测量成为了磁镊研究蛋白质折叠与去折叠动力学的优势。磁镊不需要考虑光镊实验中由于激光照射导致的样品温度上升和样品性质变化的问题 [4],也避免了原子力显微镜长时间对蛋白质分子拉伸时的机械漂移 [5]。近年来,由于磁镊设备的搭建难度相对较低,扩展性较强,已经被广泛的应用于检测蛋白质、核酸性质以及生物大分子之间的相互作用 [6] [7] [8] [9] [10]。
我们利用磁镊技术的优势,测量了多种蛋白质在100皮牛以下的机械稳定性和DNA的配对碱基之间的结合能 [3] [11] [12] [13]。但是,这些蛋白发生折叠和去折叠所需要的力超过10皮牛,它们在构象发生转变时伸长变化经常大于5 nm [14]。因此,小球在溶液中的布朗运动带来的背景噪音对实验蛋白的信号影响很小。但是当我们测量一种小尺寸,可以很容易在较小拉力下发生折叠和去折叠转变的蛋白时 [15],背景噪音对收集到的蛋白发生折叠和去折叠的信号影响就会很大,甚至会掩盖真实的折叠信号。
传统的双磁铁磁镊体系中。理想情况下反向双条形磁体磁镊测力的示意简图如图1(a)。黄球是连接目的蛋白的顺磁球,两块条形永磁铁产生从N极出发回到S极的磁场磁化顺磁球,磁球在磁场的作用下受到了竖直向上的拉力,力的方向被定为Z方向,我们将平行于焦平面的磁场方向定义为X方向。垂直于X-Z平面的方向被定义为Y方向。磁球在溶液中做布朗运动,在X和Y方向上会有不同的扰动 [16],在X方向上,磁球的系绳端沿着X轴做平移运动;但是在Y方向上,磁球在系绳端平动的同时,磁球还会围绕其磁矩方向X轴转动,使得磁球在Y方向上拥有较大的幅度的热运动。通常蛋白质的长度很短,所以系绳末端的平动很小,磁球的转动是测量噪音的一个主要来源。传统磁镊的磁场由两条形磁铁提供,磁球围绕Y轴的转动自由度会被限制 [1] [17],而磁球绕X轴的旋转是自由的 [18]。这个特性被用来做磁镊拉力的
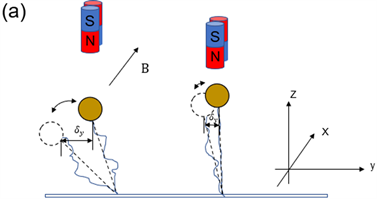

Figure 1. Sketch of the magnetic tweezers systems with a single magnetic rod or double magnetic rods. B represents the magnetic field direction. (a) Side view of dual magnets system. The blue line shows the target molecule of interested being stretched. The magnetic bead rotates around the X axis. When the magnet is far away from the magnetic bead, the magnetic bead has a larger thermal fluctuation δy along the Y axis. When the magnet is close to the magnetic bead, the magnetic field intensity and stretching force increase, and the fluctuation of the magnetic bead on the Y axis decreases. (b) Side view of single magnet system. With a single magnetic rod above the sample, the direction of the magnetic field at the position of the magnetic bead and the direction of the magnetic moment are both vertical along Z axis. The magnetic bead rotates around the Z axis, which will not introduce noise in the direction of extension
图1. 单双磁铁磁场对磁球不同的影响的示意图。B标出磁球位置处的磁场方向。(a) 双磁铁磁镊的侧视图。蓝色线条表示被拉伸的分子,磁球围绕磁矩方向X轴转动,当磁铁距离磁球较远时,磁球在Y轴方向上有较大的热运动δy,当磁铁靠近磁球时,由于磁场强度和拉力都增大,磁球在Y轴方向上的热运动减小。(b) 单磁铁磁镊的侧视图。对于单根磁铁,磁球位置处磁场和磁矩的方向都沿竖直的拉力方向(Z轴)。磁球围绕Z轴转动,这样的转动不会引入伸长方向的噪音
校准,特别是拉伸蛋白质等较短的分子时,较大的延Y方向的热运动使得拉力可以被更准确地校准 [3]。在
这种情况下,拉力
,其中
为小球在Y轴上的热运动方差,
是玻尔兹曼常数,T是绝
对温度,z是系链沿力的方向的伸长,R是磁球的半径 [17],只要高分子链或磁球与表面没有相互作用,不必考虑链是刚体还是柔性链,这个方程都适用 [19]。
较大的
虽然为拉力校准提供了方便,但是磁球的转动也会引入较大沿拉力方向的伸长的测量误差。我们推测在较小拉力时,实验中的噪音主要来源于磁球的转动。所以我们重新设计磁场与磁铁,只使用一根磁铁,它的磁场从N极出发(图1(b))。在理想状态下,当磁球位于磁铁正下方时,磁球处的磁场沿Z轴。磁球的自由转动也是围绕Z轴。这样的转动不会引入伸长方向的噪音。
本文中我们考虑到磁球的磁化方向对于磁球转动的影响,对比了传统的反平行双根永久磁铁与单根磁铁在DNA拉伸实验中的结果,发现由于单根磁铁的磁场方向与拉力方向相同,磁球转动所引入的测量噪音在拉力小于3皮牛时比双根反平行磁铁更小。单根磁铁更加适用于拉力较小时的单分子测量。
2. 材料与方法
2.1. 甘油样品样品槽的制备
将22 * 22 mm和22 * 32 mm两种规格的玻璃载玻片放置在染色皿中,使用体积分数5%的活性剂超声清洗20分钟,然后使用去离子水冲洗干净,接着使用去离子水超声10分钟。将玻璃烘干,等离子清洗十五分钟,接着在含1%的APTES (3-氨丙基三乙氧基硅烷)的甲醇溶液中浸泡一小时。然后分别使用甲醇,去离子水和无水乙醇冲洗干净,烘干备用。将两种规格的玻璃居中对齐,在两玻璃间使用封口膜粘贴。分别在左右两端沿着玻璃边缘使用点胶棒点胶形成矩形凹槽。将溶解在1X PBS中的直径3微米的聚乙烯球加入样品槽,并静置20分钟,等待聚乙烯球沉积在玻璃表面,样品槽制备完成。向质量分数为95%的甘油中加入M280小球并混合均匀,将混合物充满制备好的样品槽,在样品槽的两端使用硅脂密封,避免由于长时间的实验,样品缓冲液浓度由于蒸发而改变。
2.2. DNA样品的制备
我们准备了一段517 bp的DNA,DNA的一端被氨基修饰,另一端标记有生物素。向制备好的样品槽中加入50 ul 25%戊二醛。放置一小时,1 X PBS冲洗样品槽,去掉未连接在玻璃表面的戊二醛。加入溶解在1X PBS溶液中的DNA样品,放置30分钟。使用1 X PBS冲洗样品槽,加入200微升含1% BSA溶液在四摄氏度冰箱过夜。
2.3. 单分子磁镊实验
基于一个倒置的光学显微镜(IX73, Olympus),我们搭建了单分子力学磁镊系统。我们使用了压电陶瓷调节控制100X的油浸物镜的焦平面。带有步进电机的电动载物台(LS-110, PI)通过设置好的程序调节永久磁铁和样品台之间的距离。通过CMOS摄像头(XIMEA MQ022MG-CM)捕获磁球的衍射图像。在实验前,我们将磁铁放置在离样品台较远的位置,找到合适的磁球,然后在磁球周边确定参考白球。通过摄像头在磁球和参考球之间记录一系列的聚焦面衍射图像存入数据库。在测量开始后,使磁铁靠近样品台对磁球施加拉力,高速相机会记录磁球的实时位置图像,将获得的图像和之前建立的数据库进行比对来判别磁球的位移,通过这种方法我们的实验空间分辨率可达2 nm。
3. 实验结果
3.1. 单磁铁校力实验
为了探究单磁铁的磁场分布,我们准备了三种相同材料不同直径的磁铁,直径分别为1 mm,1.62 mm,3 mm,和一个由两根直径为3 mm磁铁反平行捆绑形成的双磁铁。在校力实验中,我们主要依靠斯托克斯方程。当物体在连续的流体中运动时,所受到的阻力可以写为:F = 6 πηrv。我们将磁铁固定在到样品表面合适距离的位置,顺磁球在磁场的作用下,在流体中做匀速运动。我们通过测量得到小球做匀速运动的速度,据此推导出磁力的大小。在多个不同距离处测量磁铁给予磁球的力的大小后,将磁力与距离的关系用指数方程进行拟合。
实验开始,将条形磁铁固定于离样品表面5 mm的位置,此时磁球所受磁场施加的拉力几乎为零。推动物镜,找到白色聚乙烯球所在的平面作为基准面,然后寻找居于甘油中部的黄色磁球。确定磁球后,调节磁铁的位置,记录小球在Z轴上的位移曲线。当曲线开始稳定在单一斜率时,磁球处于匀速运动阶段,此时直线的斜率为小球的速度,结合前面的斯托克方程可以计算出小球在该磁铁位置下所受到的磁力。如图2,上图是小球在甘油中沿Z轴的位移,下图为3 mm单磁铁距离样品的距离。为了使开始时小球不受到磁铁的影响,我们将磁铁距离样品10 mm,然后让磁铁匀速接近样品,当磁铁距离样品4 mm时,磁球开始运动。磁铁距样品2 mm时停留2.5 s,我们可以观察到后面一段磁球在Z轴上的位移为一条直线,磁球此时做匀速运动。调整磁铁位置,重复之前的操作。对于同一磁铁,至少使用不同的小球重复实验三次。图3展示了不同直径的单磁铁和双磁铁距离样品表面的高度和磁球受到的磁力之间的曲线。
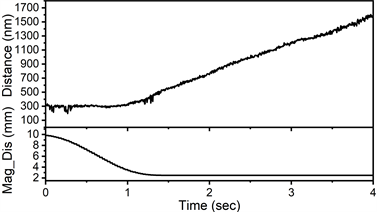
Figure 2. The movement of the magnetic beads in 95% glycerol solution when magnetic rod is approading the sample. The top panel shows the vertical movement of M280 magnetic bead in glycerol solution. The bottom panel shows the distance of the 3-mm diameter single magnetic rod from the sample
图2. 当磁铁接近样品时,磁球在95%甘油中的移动过程。上图为M280磁球在磁铁的影响下在95%甘油溶液中的位移曲线,下图为与之对应的3 mm直径的单根磁铁到样品的距离
对于同一根单根磁铁,不同的磁球测得的曲线在对数坐标下是一系列的平行线,这是由于不同磁球的异质性导致的 [3]。对于单磁铁我们使用单指数方程进行拟合:
(式1)
F为单磁铁给予磁球的拉力,C表示磁球的异质性,d为磁铁距离样品台的距离,γ,y为两个参数。不同的磁铁γ,y不同。不同于单磁铁,双磁铁磁镊获得的曲线使用双指数方程拟合的更好:
(式2)
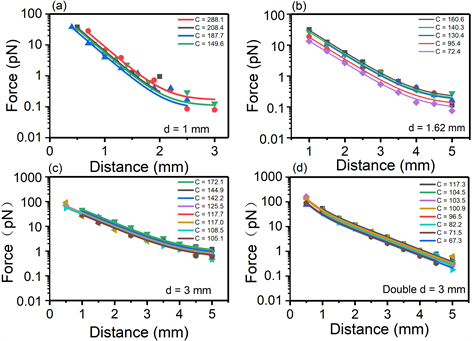
Figure 3. Magnetic force applied on Dynabead M270 as a function of the distance between magnets and sample for four types of magnets configurations: (a) 1 mm diameter single magnetic rod. (b) 1.62 mm diameter single magnetic rod. (c) 3 mm diameter single magnetic rod. (d) two antiparallel 3 mm diameter magnetic rods
图3. 四种不同类型的磁铁对Dynabead M270磁球施加的磁力与磁铁到样品距离的函数依赖关系。(a) 1毫米直径单根磁铁。(b) 1.62毫米直径单根磁铁。(c) 3毫米直径单根磁铁。(d) 反平行的两根3毫米直径的磁铁
对比几根单磁铁力与距离的曲线,我们发现直径为1 mm磁铁在距离样品表面2.5 mm时磁球开始在甘油中运动。其余两种单磁铁都在距离样品5 mm左右产生让磁球运动的力。为了保护样品,我们设置磁铁距离样品的最短距离为0.5 mm。而此时1 mm直径的单磁铁只能提供十几皮牛的力,由此可见1 mm直径的单磁铁磁场强度较低,不能达到DNA发生过拉伸转变的65皮牛。对比剩下的两种单磁铁,可以发现直径更大的磁场强度更强,在距离样品相同距离时,3 mm磁铁提供的力比1.62 mm的更大,提供相同的力,3 mm磁铁距离样品更远,因此这三种不同直径的单磁铁中,3 mm磁铁表现出的性质最为优异。所以在下面的探究实验中,我们选择了直径最大的3 mm单磁铁和两条3 mm双磁铁来进行比较。
3.2. 小力下的验证实验
考虑到适用性的影响,我们选择了拥有更大的力学区间的直径为3 mm的单磁铁和两条反向平行的3mm磁铁进行小力下背景噪音的探究实验。实验样品为一条长度517 bp的双链DNA,较长的长度可以保证小球远离玻璃表面,减轻小球和玻璃表面的相互作用对实验的影响。DNA在受到拉力65皮牛时会有过拉伸的现象,我们将该现象作为一个标记信号,确认拉伸的是目的片段,同时可以使用该特征给磁镊进行校力。DNA的一端修饰的氨基可以被戊二醛固定在经过APTES处理的玻璃表面,一端是生物素可以连接到被链霉素亲和素包裹的小球。
将DNA样品放置在样品台以后,通过马达控制磁铁缓慢接近样平台。受磁场的影响,磁球开始朝向靠近磁铁的方向运动同时拉伸DNA。当DNA处于熵弹性状态时,只需要很小的力DNA就会发生很大的位移。当DNA被完全拉直后,拉力到达65皮牛时,DNA双链开始发生过拉伸转变,DNA伸长在很小的拉力范围内增加超过100 nm并具有较大的涨落(图4(a)) [20],我们可以根据这一现象来校正磁镊的力。根据DNA伸长和磁铁位置之间的曲线,找到当DNA发生过拉伸时磁铁的位置。将该位置磁球受到的力记为65皮牛,然后根据前文提到的磁铁位置和磁球受力之间的关系方程获得作用在该磁球上力和距离的方程(图4(a))。校力完成后,我们让磁铁分别对磁球施加1,2,4,8,16,32,64皮牛的恒定力,在每个力下持续90sec,记录不同力下的伸长曲线,(图4(b))展示了在1,8,64皮牛时DNA的伸长曲线。

Figure 4. DNA over-extension time course and DNA extension under different constant forces. (a) The figure above is a typical DNA over-stretching time course. A single magnet with a diameter of 3 mm approaches the sample to increase the stretching force. When the force reaches 65 pN, the DNA extension increased more than 100 nm in a small force range. In the figure below, the force is calculated according to the position of the magnet when the DNA is stretched. (b) In the single 3 mm diameter magnet system, the extension curve of DNA under a constant force of 1, 8, 64 pN for 60 s
图4. DNA的过拉伸曲线和不同恒力下DNA的伸长曲线。(a) 上图为典型的DNA过拉伸曲线,3 mm直径单磁铁逐渐接近样品使得拉力逐渐增大,当拉力达到65 pN时,DNA的伸长在很小的拉力区间内增加超过100 nm。下图,由磁铁的位置换算出的拉力随时间的变化曲线。(b) 在3 mm直径单磁铁体系中,DNA在1,8,64 pN恒定力下60 s的伸长曲线
通过伸长曲线,我们可以清晰的观察到随着力的增大,伸长的涨落幅度在减小,但是当力到达64皮牛时,伸长的振幅又增大了。这是因为64皮牛很接近DNA的过拉伸力,此时的DNA部分发生了过拉伸转变。恒定拉力下伸长曲线的标准差既包含DNA分子的热运动信息,又包含由于磁球转动或测量误差导致噪音,相同的力下伸长标准差较小时的背景噪音也比较小。
如图5我们发现在双磁铁体系,当拉力小于8皮牛时,随着力的增大,伸长的标准差是单调衰减的。而后,伸长的标准差基本保持不变,直到拉力达到64皮牛时伸长的标准差突然增大。而在单磁铁体系,拉力小于8皮牛时,伸长的标准差几乎不随拉力的改变而变化。拉力大于8皮牛时,小球的振幅才有了略微的减小。当力小于3皮牛时,单磁铁体系的噪音比双磁铁的体系小。但是当拉力大于3皮牛以后,双磁铁体系就会优于单磁铁体系。

Figure 5. Standard deviation of DNA extension under different forces in a single magnetic rod system and double magnetic rods system with diameter of 3 mm. Black symbols represent the results from double magnetic rods system, while gray symbols represent the results from single magnetic rod system. Bigger symbols of black solid circle show the average results from double magnetic rods system, while bigger symbols of gray solid triangles show the average results from single magnetic rod system
图5. 磁铁直径为3 mm的单双磁铁体系中,在不同力下DNA伸长的标准差。黑色代表双磁铁数据,灰色代表单磁铁数据,不同的形状代表不同DNA的测量数据。较大的黑色圆点图标表示双磁铁测量结果的平均值,较大的灰色三角形图标表示单磁铁系统测量结果的平均值
4. 实验结论
我们发现双磁铁体系中,在所需力比较小时,磁球扰动导致的背景噪音会对实验产生比较大的影响。考虑到磁场的方向给予小球的磁矩不同,由此小球的自由转动状态会有所不同。由于单磁铁产生的磁场在磁球位置处沿竖直方向,磁球的磁矩方向也沿竖直方向,进而磁球的自由转动也是绕竖直方向的Z轴的。这种转动理论上不造成磁球沿拉力方向的位移,进而不影响分子伸长的测量。
我们对比了直径为3 mm的单根磁铁和反平行双根磁铁对于DNA伸长在不同拉力下的测量噪音的影响。实验发现对于单根磁铁体系,在拉力小于8皮牛时,伸长的测量值的标准差基本为一个常数,只有当拉力大于8皮牛时,伸长的标准差才会随着力的增大而减小。而对于双磁铁体系,伸长的标准差在小于8皮牛时随着拉力的增大而单调衰减。当拉力小于3皮牛时,单磁铁体系的伸长标准差小于双磁铁体系可以给出更高的伸长测量精度。如果拉力大于3皮牛时,传统的双磁铁系统的测量精度更高。我们的实验对获得高精度测量结果的磁铁选择给出了一个参照。
基金项目
本论文获得国家自然科学基金项目资助(批准号:11874309,11474237,11574310)。