1. 引言
阿尔茨海默症(AD)是一种慢性进行性神经退行性疾病,被认为是痴呆症最常见的原因之一 [1]。患有AD的患者在临床上以记忆力丧失和认知能力下降为特征,给家庭和社会带来沉重负担。迄今为止,尚无针对AD患者的治疗方法。通常,AD患者的最初症状是轻度的记忆困难,并逐渐演变为认知障碍和痴呆 [2]。在AD临床表现发展之前,大脑的许多区域已经发生了神经元丢失和神经病理学损害。因此,挖掘敏感的生物标志物有助于AD的早期诊断,对于AD的干预治疗至关重要。
近年来,microRNA (miRNA)在人类疾病中的作用受到越来越多的关注,其在各个领域的生物调节中起着至关重要的作用 [3]。MiRNA是一类小的非编码RNA,通过与靶基因的3’-非翻译区(UTR)结合,参与生物中基因表达的转录后调控 [4]。越来越多的证据表明,miR-320a参与神经发育的调控 [5]。近期的文章发现,miR-320a在AD患者的血清和脑脊液(CSF)中均显著下调 [6]。但是,miR-320a在AD发生中的作用和潜在机制尚不清楚。
在本研究中,我们调查了miR-320a在AD患者中的表达变化和临床价值。根据qRT-PCR结果,确定AD患者血清中的miR-320a被下调。此外,我们进一步研究了miR-320a在Aβ诱导的SH-SY5Y细胞神经毒性中的作用。
2. 材料和方法
2.1. 研究对象和样品收集
本研究共招募110名AD患者,并收集另外100名健康志愿者作为对照组。所有个人均签署了知情同意书,该研究已获得上海市宝山区老年护理院伦理委员会的批准。
2017年1月至2019年12月,所有患者均根据NINCDS-ADRDA标准确诊 [7]。根据病史,一般检查,实验室检查和迷你精神状态检查(MMSE)的测量结果,确定对照组人群神经系统健康。排除标准如下,将具有冠心病,传染病,癌症,青光眼,缺血性或出血性中风以及2型糖尿病史的患者排除在研究范围之外。禁食12~14小时后,从每个参与者中收集5 ml外周血样品,离心,收集血清样品,并在−80℃下保存以进行进一步实验。
2.2. 细胞培养和转染
人神经母细胞瘤SH-SY5Y细胞由美国典型培养物保藏中心(ATCC)提供。将细胞在加有10%胎牛血清(FBS;PAN,Aidenbach,德国)的Dulbecco改良版Eagle培养基(DEME;Gibco,CA,美国)中进行培养,培养稳定为37℃。培养24小时后,加入Aβ25-35 (25μM/L;Sigma-Aldrich,美国密苏里州圣路易斯),孵育24小时,随后进行细胞转染。
为了调节miR-320a在细胞中的表达,用Gene-Pharma公司(上海,中国)提供的miR-320a模拟物,miR-320a抑制剂或阴性对照(miR-NC)转染SH-SY5Y细胞。在Aβ25-35处理之前,按照制造商的说明,使用Lipofectamine 3000 (Invitrogen, Carlsbad, CA, USA)将miR-320a模拟物(miR-mimic),miR-320a抑制剂(miR-inhibitor)或miR-NC转染到细胞中。转染后24小时,收获不同组的细胞用于随后的实验。
2.3. RNA提取和实时定量PCR (qRT-PCR)
TRIzol试剂(Invitrogen,Carlsbad,CA,美国)用于从血清和细胞中提取总RNA。确定RNA的纯度和浓度后,使用PrimeScript RT试剂盒(Takara,东京,日本)将RNA逆转录为cDNA。然后使用SYBR green I Master Mix Kit (Invitrogen, Carlsbad, CA, USA)进行qRT-PCR以测量miR-320a表达。miR-320a的相对表达通过使用2−ΔΔCt方法计算,使用U6作为内参。PCR反应条件如下:94˚C预变性2 min,然后94℃变性20秒,60℃变性34秒,循环40次。
2.4. CCK-8测定
CCK-8分析用于细胞活力的检测。将细胞以2 × 104细胞/孔的密度接种到96孔板中。转染后24小时,将10 μl CCK-8溶液混合到培养基中,再孵育1小时。然后,通过使用微孔板读取器(Bio-Tek Instruments, Winooski, VT, USA)读取450 nm处的吸光度来检测光密度。并且计算细胞存活率作为对照组的百分比。
2.5. 凋亡分析
Annexin VFITC细胞凋亡检测试剂盒(Keygen Biotechnology,中国南京)用于计算细胞凋亡。首先将不同组的细胞在黑暗中于孵育10分钟,温度2~8℃。然后使用FACSCalibur流式细胞仪(BD Biosciences,美国加利福尼亚州圣何塞)计算细胞凋亡。
2.6. 荧光素酶报告基因检测
TargetScan分析结果表明,PTEN在3’-UTR处具有miR-320a的潜在结合位点。进行荧光素酶报告基因测定以证实PTEN是否是SH-SY5Y细胞中miR-320a的靶基因。合成了包含miR-320a结合位点的PTEN 3’-UTR序列的野生型(Wt)或突变型(Mut),并将其克隆到pGL3荧光素酶载体(Promega,麦迪逊,威斯康星州,美国)中,将其共转染到具有miR-320a模拟物,miR-320a抑制剂或模拟NC,抑制剂NC的SH-SY5Y细胞。荧光素酶活性通过使用双重荧光素酶报道试剂盒(Promega Corporation, Wisconsin, USA)测量,并且使用海肾荧光素酶用作内部对照以进行标准化。未进行任何处理的细胞被确定为对照组。
2.7. 统计分析
连续变量表示平均值 ± 标准差(SD)。卡方检验用于比较分类变量,而学生t检验用于比较连续变量。使用单向方差分析(ANOVA),然后进行Tukey进行多重比较检验,比较组之间的差异。采用Kolmogorov-Smirnov (K-S)正态检验对数据进行正态检验,发现血清miR-320a水平与MMSE评分符合正态分布。通过确定Pearson相关系数来评估血清miR-320a水平与MMSE评分之间的关系。绘制受试者工作特性(ROC)曲线,并计算该曲线下的面积(AUC)以评估miR-320a对AD的诊断准确性。P < 0.05被确定为差异具有统计学意义。使用SPSS 18.0版软件(SPSS Inc.)和GraphPad Prism 5.0软件(GraphPad Software, Inc.)进行所有数据分析。
3. 结果
3.1. 受试者的基本特征
如表1所示,该研究招募了110名AD患者和100名健康对照。比较受试者的人口统计学和临床特征,两组之间在年龄和性别分布上均无显著差异(P > 0.05)。但是,AD患者的MMSE评分(17.33 ± 3.96)与健康个体(27.40 ± 1.62)相比明显降低。此外,健康对照组的血清miR-320a水平为0.59 ± 0.15,而AD患者的相对较低水平为1.00 ± 0.29。
3.2. MiR-320a在AD中被下调
进行qRT-PCR以计算miR-320a在AD患者血清中的表达。如图1所示,AD患者的血清miR-320a水平显著低于健康对照组(P < 0.001)。
3.3. 血清miR-320a与MMSE评分的关系
MMSE分数是广泛使用的认知功能测验,它可以反映个人的心理状态。在本研究中,我们分析了MMSE评分与AD患者血清miR-320a表达的相关性。结果表明,AD患者的血清miR-320a与MMSE评分呈正相关(r = 0.651,P < 0.001,图2)。
3.4. MiR-320a对AD患者的诊断价值
由于AD患者的miR-320a血清水平与健康个体存在显著差异,并且在患者组中观察到miR-320a血清表达与MMSE评分呈正相关,因此我们进一步研究了诊断方法miR-320a对AD的诊断潜力。根据miR-320a的血清水平,建立了ROC曲线,发现AUC为0.885,临界值为0.774的情况下,诊断灵敏度和特异性分别为90.0%和81.0% (图3)。

Figure 1. Expression of miR-320a in serum of patients with AD. ***P < 0.001
图1. miR-320a在AD患者血清中的表达。***P < 0.001

Figure 2. Correlation between serum miR-320a level and MMSE score in patients with AD. r = 0.651, P < 0.001
图2. AD患者的血清miR-320a水平与MMSE评分的相关性。r = 0.651,P < 0.001

Figure 3. ROC curves were constructed to evaluate the diagnostic potential of miR-320a for AD
图3. 构建了ROC曲线以评估miR-320a对AD的诊断潜力
3.5. MiR-320a减弱了Aβ25-35诱导的SH-SY5Y神经细胞毒性
在这项研究中,用Aβ25-35处理SH-SY5Y细胞以建立细胞AD模型,以进一步探索miR-320a在AD中的功能。从图4(a)发现,在Aβ25-35处理后,SH-SY5Y细胞中miR-320a表达显著降低。另外,与对照组相比,Aβ25-35处理的神经元细胞的细胞活力将受到显著抑制(图4(b))。同样,Aβ25-35处理可显著促进细胞凋亡(图4(c))。这些结果表明,成功建立了细胞AD模型。此外,与AD患者的血清表达数据相似,Aβ25-35处理也降低了神经元细胞中miR-320a的表达水平。
我们进一步探讨了miR-320a的调节对神经元细胞活力和凋亡的影响。通过转染,miR-320a模拟物可上调miR-320a的表达,但miR-320a抑制剂可下调其表达(图4(a))。根据CCK-8,注意到miR-320a的过表达抑制了Aβ25-35处理诱导的细胞活力降低,而miR-320a的下调则加剧了细胞活力的抑制(图4(b))。此外,miR-320a的上调抑制了Aβ25-35诱导的细胞凋亡,而miR-320a的下调则加剧了Aβ25-35对细胞凋亡的诱导作用(图4(c))。这些数据表明,miR-320a减弱了Aβ25-35对SH-SY5Y细胞的神经毒性。
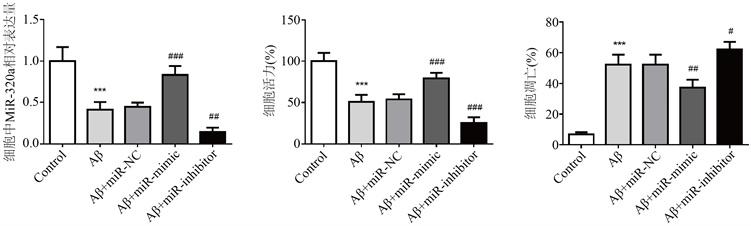 (a) (b) (c)
(a) (b) (c)
Figure 4. MiR-320a attenuated the neurotoxicity of SH-SY5Y cells induced by Aβ25-35. ***P < 0.001, compared with the control group; Compared with Aβ group, #P < 0.05, ##P < 0.01, and ###P < 0.001
图4. MiR-320a减弱了Aβ25-35诱导的SH-SY5Y细胞神经毒性。***P < 0.001,与对照组相比;与Aβ组相比,#P < 0.05,##P < 0.01,###P < 0.001
3.6. PTEN是SH-SY5Y细胞中miR-320a的靶基因
根据TargetScan分析结果,我们注意到miR-320a可以与PTEN的3’-UTR结合,这表明PTEN可能是miR-320a的候选靶向基因(图5(a))。然后,我们进行了荧光素酶报告基因检测,以进一步验证PTEN是否是miR-320a的直接靶标。如图5(b)所示,结果表明miR-320a的上调抑制了细胞的荧光素酶活性,而miR-320a的下调则促进了荧光素酶的活性。但是转染PTEN突变质粒的SH-SY5Y细胞,其荧光素酶活性不受miR-320a表达量的影响。因此,PTEN是SH-SY5Y细胞中miR-320a的靶基因。
4. 讨论
AD是不治之症,通常在老年中发作,可严重影响患者的短期和长期记忆 [8]。目前,AD的确切病因仍未确定,但是Aβ和过磷酸化的tau蛋白在神经原纤维缠结中的积累被认为是AD的根本原因 [8]。在本研究中,我们调查了AD患者血清中miR-320a的表达变化和临床价值,并进一步探讨了miR-320a对Aβ25-35诱导的SH-SY5Y细胞活力和凋亡的调节作用。结果表明,与健康组相比,AD患者血清中miR-320a的表达明显降低。血清miR-320a的表达与AD患者的MMSE评分呈正相关,对AD有一定的诊断价值。此外,体外实验进一步确定,miR-320a减弱了Aβ25-35诱导的SH-SY5Y细胞的神经毒性,而PTEN可能是其靶基因。
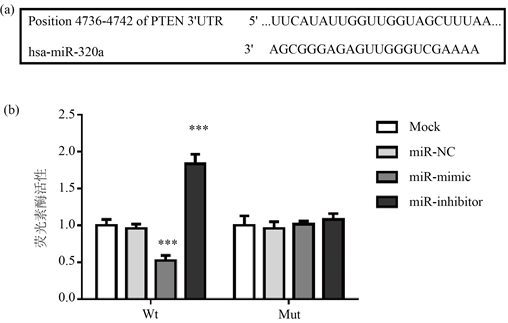
Figure 5. PTEN is the target gene of miR-320a in SH-SY5Y cells. (a) MiR-320a binding site in PTEN; (b) Overexpression of miR-320a inhibited the activity of wild-type PTEN transfected cells, while down-regulation of miR-320a promoted luciferase activity.***P < 0.01, compared with the simulation group.
图5. PTEN是SH-SY5Y细胞中miR-320a的靶基因。(a) PTEN中的MiR-320a结合位点;(b) miR-320a的过表达抑制了转染野生型PTEN的细胞的活性,而miR-320a的下调则促进了荧光素酶的活性。***P < 0.01,与模拟组相比
已发现大量miRNA在AD患者中异常表达,例如miR-29c-3p,miR-19b-3p,miR-34a-5p [9] [10],反映了miRNA的在AD发展中的关键作用。在本研究中,我们发现与健康对照组相比,AD患者血清中的miR-320a显著降低。与我们的观察结果一致,先前已报道miR-320a的循环水平在AD患者中异常表达 [6]。MMSE分数是广泛使用的认知功能测验,它可以反映个人的心理状态 [11]。我们还发现,AD患者的血清miR-320a与MMSE得分呈正相关。所有证据表明,miR-320a在神经退行性疾病的发生和发展中具有至关重要的作用。
MiRNA在血清中稳定表达,在血清中检测miRNA标志物被认为是许多人类疾病的潜在策略,近年来受到越来越多的关注 [12]。已确定miR-320a是许多癌症进展中的重要调控因子 [13] [14]。鉴于AD患者中血清miR-320a的异常表达,及其与MMSE评分的显著相关,我们进一步研究了miR-320a对AD的诊断潜力。ROC曲线分析结果表明miR-320a具有较高的诊断准确性,可将AD患者与健康对照区分开。
淀粉样蛋白β肽(Aβ25-35)是AD中淀粉样蛋白β肽的片段,据报道在神经元细胞中表现出神经毒性作用 [15]。在这项研究中,用Aβ25-35处理SH-SY5Y细胞建立细胞AD模型,以进一步探索miR-320a在AD中的功能。与AD患者血清表达数据一致,神经元细胞中Aβ25-35处理也降低了miR-320a的表达水平。进一步的回复实验表明,miR-320a的过表达可减弱Aβ25-35诱导的SH-SY5Y细胞的神经毒性。考虑到该研究揭示的miR-320a的作用,我们试图鉴定SH-SY5Y细胞中miR-320a的靶基因。根据通过TargetScan进行在线预测,PTEN被确定为miR-320a的合适候选基因。此外,我们进一步进行了荧光素酶报告基因检测,并确定PTEN是SH-SY5Y细胞中miR-320a的靶基因。
PTEN (phosphatase and tensin homolog deleted on chromosome ten),位于10号染色体上,是一种脂质和蛋白质磷酸酶,具有蛋白质和脂质磷酸酶的活性。它在调节细胞生长,存活和代谢中起重要作用 [16]。PTEN参与神经发生,神经突向外生长,突触形成和突触可塑性的调节 [17]。已有大量文献证明,PTEN可以抑制与细胞生长和存活相关的细胞信号通路,包括PI3K/AKT信号通路,这在AD的发生和发展中起着至关重要的作用 [18] [19]。此外,在AD中有针对性地抑制PTEN活性可以促进神经保护并抵抗细胞氧化应激,内质网应激和神经毒性 [20]。此外,已证明在Aβ25-35处理的PC12细胞中PTEN的表达水平被上调 [21]。结合上述结论,我们推测miR-320a可能通过靶向PTEN作用于PI3K/AKT信号通路,从而减弱AD中β-淀粉样蛋白诱导的神经毒性。但是,这一推断需要进一步的研究来验证我们的假设,并且应该探索具体的机制。
综上所述,本研究的结果提出血清miR-320a可以作为诊断AD的有前途的生物标志物,并且miR-320a的过表达通过靶向PTEN减弱了Aβ诱导的AD的神经毒性。这些数据为miR-320a参与AD的发病机理提供了重要的理论基础,且miR-320a的上调可能具有一定治疗AD的潜力。
基金项目
本研究由宝山区科技创新基金“基于精准代谢组学方法的阿尔兹海默症早期预测生物标志物探索研究”资助(19-E-29)。
NOTES
*通讯作者。