1. 引言
肺癌是临床上常见的恶性肿瘤,其发病率和死亡率均居全世界首位。在肺癌的分型中,非小细胞肺癌(NSCLC)约占肺癌总数的80%,其中腺癌是目前最常见的肺癌病理类型 [1]。肺癌的传统治疗手段是手术、化疗或放疗,但大多数肺癌患者在确诊时已处于晚期,往往对传统治疗手段不能耐受,而中医药在治疗中晚期NSCLC具有稳定病灶、防止肿瘤细胞转移、改善临床症状、提高患者生存质量、延长生存期等显著的优势 [2]。周仲瑛认为治疗肺癌祛邪重于扶正,治法上以清热解毒、化痰散结、活血化瘀、益气养阴等复法组方为主 [3]。本研究旨在通过体外实验,检测清热解毒方、软坚散结方对人肺腺癌A549细胞增殖的影响,并初步探讨其作用机制。
2. 材料与方法
2.1. 材料
2.1.1. 细胞株
人肺腺癌细胞A549,由青岛大学附属医院中心实验室提供。
2.1.2. 实验药品
清热解毒方(牡丹皮15 g,栀子10 g,连翘10 g,夏枯草15 g,鱼腥草15 g,金荞麦15 g),软坚散结方(牡蛎20 g,夏枯草10 g,山慈菇10 g,白花舌蛇草20 g,瓜蒌10 g,半夏10 g),两组中药方剂配方均由青岛大学附属医院中医科提供,药材均购自青岛大学附属医院中药房。以分析天平精密称取两种按原方比例配伍的各中药免煎颗粒,将其粉碎后置入试管中,分别加入100℃去离子水80 ml振荡溶解,静置放凉,此时所得中药免煎颗粒溶剂浓度相当于原饮片1 g/ml,超净工作台内将药液经0.22 um微孔滤膜除菌,得清热解毒方、软坚散结方原液,4℃冰箱保存备用。根据预实验情况确定两种方剂有效抑制浓度范围,实验时将上述原液用培养液稀释后配置成所需终浓度,分别为2.5、5、10、20、40、80、160 mg/ml后使用。药物均为实验前新鲜配用。
2.1.3. 实验试剂
CCK8试剂盒购自大连美仑生物技术有限公司,Annexin V-FITC/PI细胞凋亡检测试剂盒购自上海优宁维生物科技股份有限公司,SYBR® Premix Ex Taq™ II PCR扩增试剂盒购自日本TaKaRa公司,Bcl-2及β-actin (内参)上下游引物均由上海生工生物工程技术服务有限公司合成。
2.2. 方法
2.2.1. 人肺腺癌A549细胞培养及处理
将A549细胞用DMEM培养基(含10%血清、青霉素100 ug/L,链霉素100 ug/L)于37℃、5% CO2饱和湿度培养箱中培养,以0.25%胰蛋白酶消化,选择对数生长期,且生长状态良好的A549细胞随机分为3组:两种不同功效中药方剂组,DMEM培养基阴性对照组。
2.2.2. CCK8法检测细胞生长抑制率
选择对数生长期,且生长状态良好的A549细胞,以3 × 104/ml的密度接种到96孔板中,培养过夜。向细胞中添加终浓度分别为2.5、5、10、20、40、80、160 mg/ml的两种不同功效中药方剂,设置添加DMEM培养基的A549细胞为阴性对照组,设置添加DMEM培养基为空白组。每组设3复孔。培养48 h后,常规CCK8显色,用全自动酶标仪在波长450 nm测定各孔吸光度(OD值)。计算细胞生长抑制率,抑制率(%) = [1 − (实验组OD值 − 空白组OD值)/(对照组OD值 − 空白组OD值)] × 100%。应用加权直线回归分析法计算IC50值。以下实验均选用两种中药方剂的IC50值作为实验浓度。每组实验至少重复3次,下同。
2.2.3. 流式细胞仪检测细胞凋亡率
选择对数生长期,且生长状态良好的A549细胞,按照1 × 105/ml的密度接种到6孔板中,培养过夜。向细胞中添加两种不同功效的中药方剂,药物浓度为相对应中药方剂的IC50值,设置添加DMEM培养基的A549细胞为阴性对照。培养48 h后,用不含EDTA胰酶消化、离心收集细胞。用预冷的磷酸盐缓冲液(PBS)重悬冲洗、离心收集细胞。用300 ul Binding Buffer (1:10)重悬细胞,加入5 ul Annexin V-FITC,混匀后室温避光孵育15分钟,再加入5 ul溴化丙锭(PI),混匀后室温避光孵育5分钟,上流式细胞仪检测细胞凋亡率。
2.2.4. RT-PCR法检测A549细胞Bcl-2 mRNA表达
选择对数生长期,且生长状态良好的A549细胞,按照1 × 105/ml的密度接种到6孔板中,培养过夜。向细胞中添加两种不同治法的中药方剂,药物浓度为相对应中药方剂的IC50值,设置添加DMEM培养基的A549细胞作为阴性对照。每组设3复孔。培养48 h后,用预冷的磷酸盐缓冲液(PBS)冲洗一次,Trizol裂解细胞,提取RNA并检测RNA浓度和纯度。将RNA反转录为cDNA。RT-PCR检测Bcl-2 mRNA表达。
2.2.5. 统计学方法
应用SPSS 22.0软件将实验所得数据进行统计分析,所得数据用平均数 ± 标准差(
± s)表示,两组间比较采用方差分析。*P < 0.05,**P < 0.01,差异有统计学意义。
3. 结果
3.1. 不同浓度两组中药方剂对人肺腺癌A549细胞增殖的影响(图1)
不同浓度两组中药方剂均呈剂量依赖性抑制人肺腺癌A549细胞的增殖。与阴性对照组比较,2.5 mg/ml软坚散结方作用于A549细胞后吸光度下降,差异无统计学意义(P > 0.05),余不同浓度两组中药方剂作用于A549细胞后吸光度下降,差异均有统计学意义(P < 0.05, P < 0.01)。清热解毒方、软坚散结方的IC50值分别为11.313 mg/ml、23.874 mg/ml。
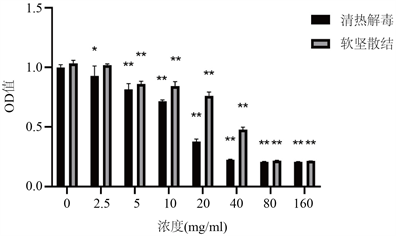 注:与阴性对照组比较,*P < 0.05,**P < 0.01。
注:与阴性对照组比较,*P < 0.05,**P < 0.01。
Figure 1. Comparison of absorbance of A549 cells treated with different concentrations of traditional Chinese medicine prescriptions
图1. 不同浓度两组中药方剂作用于A549细胞后吸光度比较
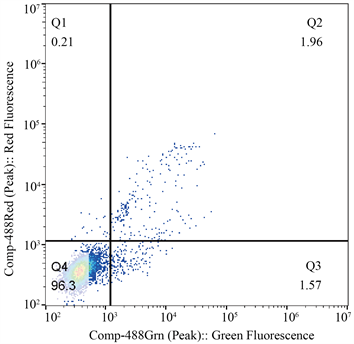
3.2. 细胞凋亡情况(图2)
细胞经Annexin V-FITC/PI染色后,利用流式细胞仪检测细胞凋亡率,清热解毒方、软坚散结方作用于A549细胞48 h后检测细胞凋亡率(早期凋亡 + 晚期凋亡)分别为8.66%、11.17%,与空白对照组(3.53%)比较,细胞凋亡率增加,差异有统计学意义(P < 0.01)。
 (a)
(a)  (b)
(b) 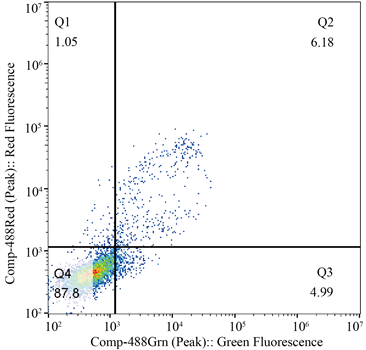 (c)注:(a)为阴性对照组,(b)为清解解毒组,(c)为软坚散结组。
(c)注:(a)为阴性对照组,(b)为清解解毒组,(c)为软坚散结组。
Figure 2. Comparison of apoptosis rate of A549 cells treated by two groups of traditional Chinese medicine prescriptions
图2. 两组中药方剂作用于A549细胞后凋亡率比较
3.3. Bcl-2 mRNA表达(图3)
与阴性对照组比较,清热解毒方、软坚散结方均能不同程度下调Bcl-2 mRNA表达,差异有统计学意义(P < 0.05,P < 0.01)。
4. 讨论
中医认为,肿瘤的发生与正气虚损、阴阳失衡、脏腑功能失调、留滞客邪有关,致使气滞血瘀、痰凝毒聚,相互胶结日久形成肿瘤 [4],故痰淤热毒、气阴两伤是肺癌的基本病机,而清热解毒、软坚散结即成为治疗肺癌的重要治则 [3]。
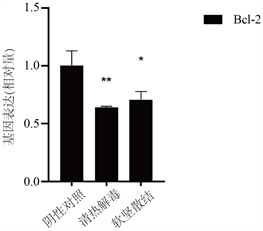 注:与阴性对照组比较,*P < 0.05,**P < 0.01。
注:与阴性对照组比较,*P < 0.05,**P < 0.01。
Figure 3. Comparison of relative expression of Bcl-2 mRNA in A549 cells treated with two groups of traditional Chinese medicine
图3. 两组中药方剂作用于A549细胞后Bcl-2 mRNA相对表达量比较
研究证实,抑制肿瘤增殖、诱导肿瘤细胞分化和凋亡是中医药抗肿瘤的重要机制 [2]。细胞凋亡包括外在的死亡受体通路和内在的线粒体信号通路。Bcl-2凋亡信号通路为内源性通路,可分为促凋亡蛋白和抑凋亡蛋白两大类,其中Bax和Bcl-2分别是典型的促凋亡和抑凋亡蛋白。当Bax高表达或者Bcl-2基因低表达所致其比值上升,Bax同源二聚体增多,可引起细胞凋亡增加 [5]。李小江等观察到具有益气滋阴、活血祛瘀、清热解毒、扶正祛邪功效的消岩汤及其拆方组(清热解毒组、活血化瘀组、益气扶正组)在体外实验中均能抑制人肺腺癌A549细胞的生长 [6]。研究证实,软坚散结方中多种药物均具有抑制人肺腺癌A549细胞的增殖,诱导人肺腺癌A549细胞凋亡的作用,其中白花蛇草乙醇提取物可呈剂量依赖性抑制人肺腺癌A549细胞的增殖 [7]。
本实验采用CCK8法观察不同浓度清热解毒方、软坚散结方对人肺腺癌A549细胞体外增殖作用的影响,结果提示:不同浓度两组中药方剂均呈剂量依赖性抑制A549细胞的增殖,说明清热解毒方、软坚散结方在体外均具有较强的细胞毒性和抑制肿瘤细胞增殖的作用。采用流式细胞仪观察发现,清热解毒方、软坚散结方作用于A549细胞48 h后细胞凋亡率(早期凋亡 + 晚期凋亡)明显增加,提示两组中药方剂均能不同程度诱导A549细胞凋亡。采用PCR法观察发现,清热解毒方、软坚散结方均能不同程度下调Bcl-2表达,提示两组中药方剂诱导A549细胞凋亡的作用机制可能与下调Bcl-2 mRNA表达有关。
5. 结论
综上所述,清热解毒方、软坚散结方均具有较强的抑制人肺腺癌A549细胞增殖及诱导细胞凋亡的能力,其共同作用机制可能为通过下调Bcl-2 mRNA表达来诱导A549细胞凋亡。因此,清热解毒方、软坚散结方均具有较强的抗肿瘤作用,两种中药方剂不同的作用机制有待进一步阐明。
基金项目
山东省中医药科技发展计划项目编号:2017-199;青岛市中医课题编号:2020-zyy062。
NOTES
*通讯作者。