1. 引言
结肠炎相关性结肠癌(Colitis-associated cancer, CAC)是由肠道慢性炎症反复损伤、修复、增生引起的结肠癌变。CAC的发病率是散发性结直肠癌的5~11倍,研究表明在炎症性肠病(Inflammatory bowel disease, IBD)患者确诊8~10年后,发展为CAC的风险每年增加0.5%~1.0%,最终因CAC死亡人数约占IBD患者总数的15% [1] [2]。目前临床治疗CAC主要涵盖手术治疗、放疗、化疗、免疫治疗和其他支持治疗等方式。手术治疗是CAC首选疗法,但其5年生存率仅为50%左右,其他治疗效果亦不令人满意 [3]。前期研究发现针灸能够在一定程度上改善IBD肠道形态学和超微结构,减少炎症反应,防止炎症向肿瘤的转变,同时在CAC的发病过程中,针灸也发挥了延缓肿瘤生长的作用 [4] [5] [6] [7] [8]。
肿瘤形成的一个重要基础为细胞增殖和凋亡失衡,导致细胞数目的不断增加,表现出生长优势,导致细胞增殖失控 [9]。现代研究表明增殖细胞核抗原(Proliferating cell nuclear antigen, PCNA)和细胞周期素D1 (CyclinD1)与细胞增殖直接相关,能够通过提高肿瘤细胞DNA的增殖速度,促进肿瘤细胞扩增水平 [10] [11] [12]。PCNA在细胞周期G1晚期开始表达,S期达到峰值,在DNA复制、DNA修复、细胞周期调控和细胞增殖中发挥着重要的作用 [13]。过度表达的CyclinD1会使原本正常生长的细胞出现持续增殖的状态,进而导致正常细胞转化为肿瘤细胞,其主要促进细胞周期从G1期进入S期,促进DNA的合成 [14] [15]。为探讨艾灸对CAC的作用机制是否与参与调节细胞增殖有关,本研究观察艾灸对CAC模型大鼠结肠组织中PCNA和CyclinD1的影响,为促进艾灸作为治疗CAC的一种补充替代疗法的临床应用提供一定的科学依据。
2. 材料
2.1. 实验动物
购入由上海斯莱克实验动物有限公司提供的26只清洁级SD雄性大鼠,体质量100 ± 20 g,将其置于室温18℃~22℃,相对湿度50%~70%,采光和通风良好的环境中,自由活动。所有动物及饲料均由上海中医药大学实验动物中心提供,动物生产许可证号:SCXK(沪)2017-0005。实验操作遵循美国国立卫生研究院和上海市实验动物伦理委员会的规定。
2.2. 主要试剂和主要仪器
5%BSA封闭液、ECL发光试剂盒、RIPA裂解液、RNA酶抑制剂、GAPDH内参、鼠兔通用免疫组织化学试剂盒(上海威奥生物科技有限公司,中国),Anti-PCNA抗体、Anti-CyclinD1抗体(Abcam,英国),Anti-C-myc抗体(Santa Cruz Biotechnology,美国),ELISA试剂盒(R & D Systems,美国)。组织脱水机、石蜡切片机(Leica,德国),组织包埋机、全自动酶标仪(Thermo Fisher,美国),转模仪、电泳槽、凝胶成像系统(Bio-Rad,美国)。
3. 方法
3.1. 动物分组及模型制备
26只SD大鼠适应性喂养1周后,先采用随机数字表法随机分为2组:正常大鼠(正常组) 6只、造模大鼠20只(2只用于模型鉴定),造模成功后再次将18只造模大鼠随机分为模型组、隔药灸组、隔姜灸组,每组各6只。造模大鼠予以氧化偶氮甲烷(Azoxymethane, AOM)腹腔注射(2 mg/ml浓度,10 mg/Kg) 1次后正常饮水饲养7天,然后改为饮用3%-2%-2%浓度葡聚糖硫酸钠(Dextran sodium sulfate, DSS)溶液,饮用DSS溶液4天,正常饮水17天 [16]。详见图1。造模后次日,抽取2只造模大鼠,通过肉眼观察结肠组织有无肿瘤及HE染色检测造模是否成功。
3.2. 干预方法
造模成功后,提前1天剃除各组大鼠“天枢(双)、气海”穴附近毛发。正常组和模型组大鼠陪同固定,不予艾灸干预。隔药灸组采用隔药灸治疗:将木香、附子、肉桂等药粉,以黄酒调和,压制于黄铜模具内,制成直径约0.8 cm,厚约0.4 cm的药饼。放于大鼠“天枢”、“气海”穴,取穴方法参考《实验针灸学》 [17]。药饼上放置约90 mg的艾炷,每穴灸2壮,每日1次,每周6次,共30次。隔姜灸组采用隔姜灸治疗:将新鲜生姜切成直径约0.8 cm、厚约0.4 cm的姜片,余操作同隔药灸组。
3.3. 结肠组织取材
末次治疗结束,各组大鼠禁食24 h后采用2%的戊巴比妥钠进行腹腔注射麻醉。麻醉成功后断颈处死,纵向剖开从耻骨联合至回盲部约5 cm结肠,生理盐水清洗后肉眼观察结肠肿瘤数量。剪下约1 cm含瘤体结肠,固定于4%多聚甲醛中。剩余结肠组织剪碎,分装保存在冻存管中,置于−80℃冰箱备用。
3.4. 检测指标与方法
3.4.1. 大鼠成瘤率 [18]
3.4.2. HE染色法观察大鼠结肠组织病理学变化
组织固定脱水,石蜡包埋,切片为4 μm厚度。二甲苯、乙醇脱蜡至水,HE染色,梯度酒精脱水,二甲苯透明,中性树脂封片。在200倍光镜下观察结肠组织形态的改变并拍照分析。
3.4.3. 基于结肠组织病理形态进行肿瘤评分 [19]
标准如下:① 隐窝(正常为0分,杯状细胞减少为1分;分支状、不规则、隐窝腔扩张为2分;萌芽复合体为3分);② 上皮(正常为0分,过度增生或畸形隐窝病灶为1分,轻度不典型增生:核仁增大、轻度深染、细胞核秘籍分层现象为2分,高度不典型增生:细胞核分层、重度深染、多形性、核极性消失为3分),黏膜下浸润(无为0分,有为1分)。
3.4.4. ELISA法检测大鼠血清CysC浓度
遵照CysC检测指标ELISA试剂盒的使用方法,为避免实验误差,进行了2个复孔的检测,求取平均值。具体操作如下:将100 μL/孔的标准品、待测样品孵育2.5 h,洗板。加100 μL/孔生物素标记抗体,孵育1 h,洗板。每孔加100 μL Streptavidin Solution孵育45 min,洗板。每孔加100 μL TMB Substrate Solution避光孵育30 min。每孔加50 μL终止液,在450 nm波长处测定每孔的OD值。
3.4.5. 免疫组织化学法检测大鼠结肠组织PCNA、CyclinD1蛋白的表达
切片常规脱蜡至水;于3% H2O2浸泡10 min,冲洗10 min;抗原热修复;滴加5% BSA封闭液35 min,滴加一抗[稀释浓度为PCNA (1:10,000)、CyclinD1 (1:100)],4℃冰箱过夜,PBS清洗。滴加二抗,37℃烘烤35 min,PBS清洗。DAB显色。脱水,透明与封片;随机选取每张组织片上3~5个视野拍照,运用Image-Plus Pro 6.0软件进行分析,计算出每张图片的阳性目标阳性面积和积分光密度,并计算出平均光密度。
3.4.6. Western blot法检测大鼠结肠组织PCNA和CyclinD1蛋白的表达
在剪碎的结肠组织中滴加组织裂解液粉碎匀浆,取上清液;采用BCA蛋白定量法测定蛋白浓度;80 v恒压电泳1 h,根据目的蛋白120 v恒压电泳1~2 h;在转膜缓冲液中依据目的蛋白200 mA恒流转膜50~70 min;5% BSA室温封闭2 h。洗膜后加入一抗[稀释浓度为PCNA (1:1000)、CyclinD1 (1:200)、β-Actin (1:1000)],4℃孵育过夜,洗膜后加辣根过氧化物酶标记的羊抗兔二抗(Jackson1:2000)摇床上孵育2 h。洗膜后用化学发光法进行显色,放入凝胶成像系统内自动曝光显影。将胶片进行扫描,用凝胶图像处理系统对样品条带的灰度值进行数字化分析,以目的蛋白/β-Actin的比值为其相对表达量。
3.5. 统计学分析
采用SPSS26.0统计分析软件对数据进行统计学处理。若计量资料符合正态分布以均数±标准差(
)表示,各组间比较采用单因素方差分析,两两比较采用LSD法或Tamhane法;若计量资料不符合正态分布以中位数(四分位数) [Median (P25, P75)]表示,各组间比较采用秩和检验。计数资料检以例数和率进行表示,采用Fisher确切概率法。以P ≤ 0.05表示差异有统计学意义的标准。
4. 结果
4.1. 艾灸延缓结肠炎相关性结肠癌大鼠肿瘤生长的效应观察
4.1.1. 各组大鼠结肠成瘤率比较
正常组大鼠结肠未见瘤体。模型组、隔药灸、隔姜灸大鼠结肠可见瘤体,肿瘤位于结肠远端三分之二处,靠近直肠位置最多。隔药灸组和隔姜灸组成瘤率明显低于模型组(P < 0.05)。详见表1。

Table 1. Comparison of colon tumor formation rate in rats from each group
表1. 各组大鼠结肠成瘤率比较
注:与正常组比,1)P < 0.05;与模型组比,2)P < 0.05。
4.1.2. 各组大鼠结肠组织病理学观察
正常组结肠组织黏膜及上皮组织完整,腺体排列有序,黏膜固有层分布有毛细血管和散在的淋巴细胞,未见充血、水肿、炎性细胞浸润等表现;模型组结肠组织可见黏膜层增厚,大量固有腺体消失,腺体大小和形状十分不规则,排列紊乱,杯状细胞丢失,腺体内腺上皮细胞排列失去极向,紧密重叠,可见多层,细胞核深染,核质比增大,核分裂增多,间质出血水肿,部分腺腔高度扩张呈囊状;隔药灸组结肠组织固有腺体萎缩,形态不一,排列紊乱,杯状细胞部分消失,淋巴细胞浸润,间质出血水肿,核分裂和不典型增生程度较模型组降低;隔姜灸组结肠固有腺体萎缩,形态不一,排列紊乱,杯状细胞部分消失,大量炎性细胞浸润,间质出血水肿及核分裂程度较模型组减轻,可见不典型增生。详见图2。
4.1.3. 各组大鼠结肠组织肿瘤评分
与正常组比,模型组大鼠结肠组织肿瘤评分显著升高(P < 0.05);与模型组比,隔药灸组、隔姜灸组大鼠结肠组织肿瘤评分均显著降低(P < 0.05);隔药灸组与隔姜灸组比,差异无统计学意义(P = 0.514)。详见表2。

Figure 2. Histopathological observation of the colon in rats from each group
图2. 各组大鼠结肠组织病理学观察

Table 2. Colon tissue tumor scores rate in rats from each group [Median (P25, P75)]
表2. 各组大鼠结肠组织肿瘤评分[Median (P25, P75)]
注:与正常组比,1)P < 0.05;与模型组比,2)P < 0.05。
4.1.4. 各组大鼠肿瘤标志物血清CysC浓度的比较
与正常组比,模型组大鼠血清CysC浓度显著升高(P < 0.01);与模型组比,隔药灸组、隔姜灸组大鼠血清CysC浓度均显著降低(P < 0.01, P < 0.05);隔药灸组与隔姜灸组比,差异无统计学意义(P = 0.514)。详见表3。

Table 3. Serum CysC concentration in rats from each group [Median (P25, P75)]
表3. 各组大鼠血清CysC浓度[Median (P25, P75)]
注:与正常组比,1)P < 0.05;与模型组比,2)P < 0.05。
4.2. 艾灸对CAC模型大鼠结肠组织细胞增殖的影响
4.2.1. 各组大鼠结肠组织PCNA蛋白表达
采用免疫组织化学法检测结果显示:PCNA蛋白主要定位于结肠组织细胞胞核中,阳性表达呈棕黄色或棕褐色颗粒。模型组中可见较多棕黄色或棕褐色颗粒,分布密集,隔药灸组和隔姜灸组胞核中阳性表达较模型组有不同程度的降低,而正常组胞核中仅见少量黄色或淡黄色细颗粒。与正常组比,模型组大鼠结肠组织PCNA平均光密度显著升高(P < 0.01);与模型组比,隔药灸组、隔姜灸组大鼠结肠组织PCNA平均光密度表达均显著降低(P < 0.05);隔药灸组与隔姜灸组比,PCNA平均光密度表达差异无统计学意义(P > 0.05)。详见图3和表4。
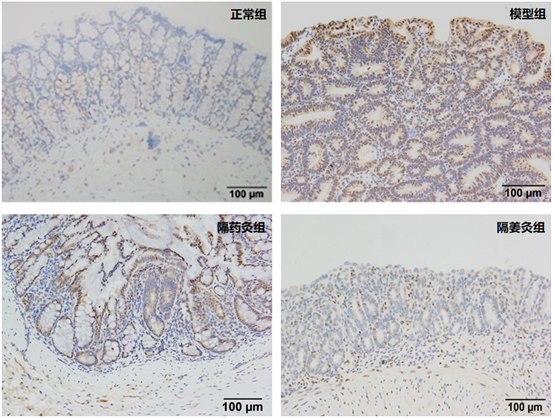
Figure 3. PCNA protein positive expression in rats colon tissue from each group
图3. 各组大鼠结肠组织PCNA蛋白阳性表达

Table 4. Comparison of PCNA protein positive expression in rats colon tissue from each group ( x ¯ ± s )
表4. 各组大鼠结肠组织PCNA蛋白阳性表达的比较(
)
注:与正常组比,1)P < 0.05;与模型组比,2)P < 0.05。
WB结果表明:与正常组比,模型组大鼠结肠组织PCNA蛋白表达显著升高(P < 0.01);与模型组比,隔药灸组、隔姜灸组大鼠结肠组织PCNA蛋白表达均显著降低(P < 0.05)。隔药灸组与隔姜灸组比,差异无统计学意义(P > 0.05)。详见图4和表5。
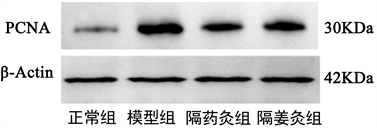
Figure 4. Comparison of colon tissue PCNA protein in rats from each group
图4. 各组大鼠结肠组织PCNA蛋白比较

Table 5. Comparison of the relative expression of PCNA protein in rats colon tissue from each group ( x ¯ ± s )
表5. 各组大鼠结肠组织PCNA蛋白相对表达量的比较(
)
注:与正常组比,1)P < 0.05;与模型组比,2)P < 0.05。
4.2.2. 各组大鼠结肠组织CyclinD1蛋白表达
采用免疫组织化学法检测结果显示:CyclinD1蛋白主要定位于结肠组织细胞胞核中,阳性表达呈棕黄色或棕褐色颗粒。模型组中可见较多棕黄色或棕褐色颗粒,分布密集,隔药灸组和隔姜灸组胞核中阳性表达较模型组有不同程度的降低,而正常组胞核中仅见少量黄色或淡黄色细颗粒。与正常组比,模型组大鼠结肠组织CyclinD1平均光密度显著升高(P < 0.01);与模型组比,隔药灸组、隔姜灸组大鼠结肠组织CyclinD1平均光密度表达均显著降低(P < 0.05);隔药灸组与隔姜灸组比,CyclinD1平均光密度表达差异无统计学意义(P > 0.05)。详见图5和表6。
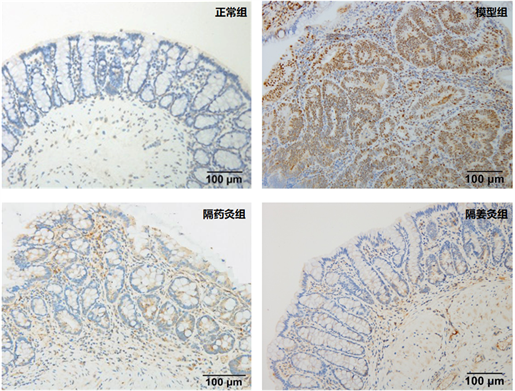
Figure 5. CyclinD1protein positive expression in rats colon tissue from each group
图5. 各组大鼠结肠组织CyclinD1蛋白阳性表达

Table 6. Comparison of the relative expression of CyclinD1 protein in rats colon tissue from each group ( x ¯ ± s )
表6. 各组大鼠结肠组织CyclinD1蛋白阳性表达的比较(
)
注:与正常组比,1)P < 0.05;与模型组比,2)P < 0.05。
WB检测结果提示:与正常组比,模型组大鼠结肠组织CyclinD1蛋白表达显著上升(P < 0.001);与模型组比,隔药灸组、隔姜灸组大鼠结肠组织CyclinD1蛋白表达显著下调(P < 0.001);隔药灸组与隔姜灸组比,差异无统计学意义(P = 0.443)。详见图6和表7。

Figure 6. Comparison of colon tissueCyclinD1 protein in rats from each group
图6. 各组大鼠结肠组织CyclinD1蛋白比较

Table 7. Comparison of the relative expression of CyclinD1 protein in rats colon tissue from each group ( x ¯ ± s )
表7. 各组大鼠结肠组织CyclinD1蛋白相对表达量的比较(
)
注:与正常组比,1)P < 0.05;与模型组比,2)P < 0.05。
5. 讨论
近年来,CAC模型的制备主要涵盖自发型、基因工程型、化学致癌物型3种方法。化学致癌物诱导的CAC模型具有造价低、周期短、癌变率高的优势而成为研究的热点 [20] [21] [22]。其中因腹腔注射AOM结合DSS饮水的方法制备的CAC动物模型成瘤率高,且可在动物身上复制出IBD的相关临床症状、体征及病理学改变,较好地模拟了人类CAC的发生发展而成为最常用且公认的方法之一 [16] [23] [24]。
众所周知,肿瘤的发生和发展离不开肿瘤细胞的增殖。正常细胞在体外传代培养中,分裂增殖到一定的次数,虽仍保持存活力但增殖能力明显下降或停滞于非增值状态,肿瘤细胞则不同,可获得无限增殖的“永生性” [9]。PCNA是真核染色体DNA复制机制的重要组成部分,可增加DNA复制和修复错误率,参与肿瘤细胞的增殖过程 [25] [26]。同时研究表明PCNA还能够评估细胞的成熟程度和分裂的风险 [27]。PCNA与DNA聚合酶δg’t共同促进RNA/DNA引物的合成,与交互因子共同参与DNA复制和修复、DNA甲基化、组蛋白乙酰化、细胞周期控制和细胞存活等细胞过程 [28] [29] [30] [31] [32]。有研究发现PCNA的阳性表达率越高,癌细胞增殖越旺盛,细胞分化程度越低,复制时间越短,转移速度越快 [33]。CyclinD1是短半衰基因编码蛋白质,是细胞增殖信号的关键蛋白之一,在结肠癌中存在过度表达 [34]。CyclinD1蛋白主要对细胞周期G1期起正向调控作用,通过作用于G1期的多种蛋白,并与这些蛋白产生相互影响,调节细胞周期进程,加快G1期向S期转变的进程,造成细胞增殖失控及恶性生长,诱发肿瘤的发生发展 [35] [36]。在正常情况下,G1期的CyclinD1表达是恒定的,在基因扩增、易位的情况下会引起CyclinD1过表达,缩短细胞周期,细胞异常增殖,不断堆积,诱导细胞癌变 [37]。
中医认为,结肠炎相关性结肠癌应归属于“积聚”、“癌病”等范畴。其病因病机多因正气内虚、脏腑功能失调、感受邪毒,导致气滞、血癖、痰凝、湿浊、毒聚等病理变化聚集肠府,久之相互胶结而至肠癌的产生 [38]。本研究选取气海、天枢两穴进行艾灸治疗可发挥益气理脾、通肠调腑,扶正培元之效。天枢为大肠募穴,穴内气血循胃经运行而外出大肠经,是肠腑气机运行的枢机,可健脾和胃,通调肠腑。气海隶属任脉,循行于肠腑所属的位置,正所谓“经络所过,主治所及”,且气海穴位于下腹部,具有近治作用,故气海可补气理气,治疗肠腑病证。
结合本研究模型组大鼠成瘤率、病理形态中发现特征性腺癌和肿瘤评分检测结果,说明采用AOM/DSS方法制备出CAC动物模型。CysC在肿瘤的生长、侵袭、转移中具有重要的作用,并且不受年龄、性别、炎性因子、脂血和溶血等因素的影响,临床上已作为消化系统恶性肿瘤的标志物,有助于判断肿瘤的转移及预后 [39] [40] [41]。隔药灸、隔姜灸“天枢”、“气海”穴干预CAC模型大鼠,发现其可降低成瘤率、肿瘤评分和血清CysC水平。病理形态学方面,模型组形成大小不等、形状不一、排列不规则的腺样结构,细胞常不规则地排列成多层,核大小不一,核分裂多见等典型的腺癌病变 [42],与模型组比,隔药灸组和隔姜灸组呈现分化高、异型性小,与原有组织形态相似,核分裂现象减少的组织形态学变化。上述结果表明艾灸疗法能不同程度延缓炎症介导的肿瘤生长。为探究细胞增殖是否为艾灸延缓肿瘤生长的作用途径之一,进一步采用免疫组化法和Western blot法检测大鼠结肠组织PCNA、CyclinD1蛋白表达。PCNA、Cyclin D1蛋白主要对细胞周期G1期、S期起正向调控作用。细胞周期是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,划分为间期与分裂期两个阶段。G1期为DNA合成前期,S期为DNA复制期,作为间期的主要阶段,G1期为DNA的合成做好了准备工作,S期合成DNA、组蛋白和DNA复制所需要的酶。可见G1期、S期在细胞合成中发挥至关重要的作用。结果发现CAC模型大鼠结肠组织中PCNA、CyclinD1蛋白较正常组明显升高,说明模型组大鼠结肠组织细胞增殖活跃。经过隔药灸与隔姜灸干预后,大鼠结肠组织中PCNA、CyclinD1蛋白均明显降低,提示隔药灸与隔姜灸干预可降低CAC大鼠结肠组织PCNA、CyclinD1蛋白的表达,改善CAC大鼠结肠肿瘤增殖的情况。同时研究发现隔药灸组和隔姜灸组在改善CAC模型大鼠结肠组织肿瘤相关指标及PCNA、CyclinD1蛋白中没有表现出明显的差异性,表明两种艾灸方法发挥了相似的作用。
基金项目
国家自然科学基金(81873372),上海市自然科学基金课题(20ZR1453200),上海市卫生和计划生育委员会卫生行业临床研究专项(20184Y0106)。
NOTES
*通讯作者。