1. 引言
Fe3O4纳米粒子可应用于生物医学和治疗,例如成像 [1]、细胞特异性靶向 [2] 和药物递送 [3] 等,这是由于Fe3O4纳米粒子具有的磁性 [4]。更重要的是,Fe3O4纳米粒子的表面可以用具有良好生物相容性的分子进行修饰 [5] [6],为后续Fe3O4纳米粒子在药物输送系统、医疗诊断等生物医学应用提供了一个良好的平台。因此,Fe3O4-NP的表面改性是至关重要的。
为了改善Fe3O4-NP的性能,一些化合物被用于修饰Fe3O4-NP,比如硅烷偶联剂。硅烷偶联剂是一种有机化合物,化学结构通式可以表示为RSiX3 [7]。Fe3O4-NP与不同的硅烷偶联剂反应可使Fe3O4-NP表面带不同的活性基团 [8],如羰基、羧基和环氧基等。这些基团的存在,使其既能够通过化学键进行表面改性,又可以用π-π堆积、离子键和氢键等非共价键作用进行表面改性。Fe3O4-NP表面带有-OH [9],因此,利用γ-缩水甘油醚丙基三甲氧基硅烷(KH560)对Fe3O4-NP进行表面修饰,使得Fe3O4-NP表面带有环氧基。环氧基是一种化学性质相对活泼的基团,其可与氨基、羧基等基团发生反应。
目前,抗体 [10]、蛋白质 [11]、DNA [12]、酶 [13] 等都被用来作为Fe3O4-NP表面改性的材料,以改善其生物相容性。但研究表明,纳米颗粒与大分子结合时,不可避免地会影响其空间结构 [14]。肽作为生物小分子,具有更加简单的结构。DGEA (Asp-Gly-Glu-Ala)来源于I型胶原,其可以作为胶原受体的拮抗剂。胶原蛋白是细胞外基质中最具血栓形成性的成分,它与血小板表面膜受体之间直接相互作用,在这个过程中,两种糖蛋白是至关重要的:粘附受体整合素α2β1和GPVI,它们负责这一过程的信号转导。研究表明,DGEA肽对整合素α2β1具有特异性,可以拮抗胶原蛋白介导血小板粘附并诱导血小板活化和聚集的过程 [15]。
因此,本文将生物小分子多肽DGEA用于Fe3O4-NP的表面改性,通过各种材料学对其进行了表征,并研究了DGEA多肽改性Fe3O4-NP的生物相容性。
2. 实验部分
2.1. 实验材料及设备
Fe3O4纳米颗粒,AR,Aladdin;KH560,AR,Aladdin;DGEA多肽,1 g,吉尔生化(上海)有限公司;甲苯胺蓝(TBO),纯度99%,成都市科隆化学品有限公司;无水乙醇,AR,成都市科伦化工试剂厂。
恒温水浴锅(S212,郑州长城科工贸有限公司);恒速搅拌机(W-0不升降,上海申顺生物科技有限公司);傅立叶反射红外光谱仪(NICOLET 5700,美国Thermo公司);激光粒度仪(ZetasizerZS90, Malvern),酶标仪(Epoch12, biotech USA)。
2.2. DGEA多肽改性Fe3O4纳米颗粒的制备
(1) KH560修饰Fe3O4-NP的制备(Fe3O4-EG ):将2 g Fe3O4纳米颗粒置于50 ml两口烧瓶内,加入30 ml无水乙醇和5 ml KH560,在机械搅拌下,水浴60℃反应5 h,将产物磁性吸附,分别用无水乙醇洗涤产物数次,真空干燥得产品Fe3O4-EG。
(2) DGEA多肽改性Fe3O4-NP的制备(Fe3O4-DGEA):称取Fe3O4-EG纳米颗粒20 mg和18.8 mg DGEA多肽于50 ml 两口烧瓶内,超声分散于30 ml无水乙醇,加入NaOH调节体系的pH为碱性,在机械搅拌下,水浴80℃反应5 h,将产物磁性吸附,分别用无水乙醇洗涤产物数次,真空干燥得产品Fe3O4-DGEA。
2.3. 改性Fe3O4-NP材料学表征
(1) Fe3O4-DGEA的水合粒径测定。任何悬浮于液体的颗粒都会不停的做布朗运动,其运动强度与颗粒本身的大小,性质有关。本文采用ZetasizerZS90激光粒度仪表征Fe3O4-DGEA的水合粒径。
(2) Fe3O4-DGEA结构表征。通过红外光谱分析(FTIR)可以表征材料的结构。本文采用NICOLET5700 FTIR表征DGEA多肽改性Fe3O4-NP前后的结构变化。
(3) Fe3O4-DGEA表面官能团-COOH定量表征。甲苯胺蓝(TBO)是常用的碱性染料之一 [16]。在碱性溶液中,其阳离子可与带负电荷的基团或阴离子结合,在酸性溶液中解脱,发挥染色作用,使得水溶液呈现蓝色,在530 nm处有明显吸光度变化。这一反应迅速且准确,因此,该方法可定量检测Fe3O4-DGEA表面-COOH的含量。标准曲线制作:配制pH = 11浓度为2.12 mmol/L的TBO溶液,使用移液枪吸取20 μL、30 μL、40 μL、50 μL、60 μL,加入pH = 11 NaOH溶液使其总体积为2000 μL,在530 nm处测量吸光度值。Fe3O4-DGEA表面-COOH测定:称量一定质量的Fe3O4-DGEA,加入1000 μL 2.12 mmol/L的TBO溶液,室温下静置6 h,使Fe3O4-DGEA表面充分吸附TBO,待反应结束后,使用pH = 11 NaOH溶液漂洗6次,最后加入pH = 3的HCl溶液,在530 nm处测量吸光度值。
2.4. 改性Fe3O4-NP生物相容性评价
(1) 血小板的粘附与激活实验。取新鲜的抗凝人血,在离心机中以1500 r/min的速度离心15 min,离心结束后,取上层富板浆(platelet rich plasma, PRP)备用;将200 µg Fe3O4-DGEA放入24孔板中,通过磁性分离的方式除去液体;在孔板中加入300 µL PRP,使Fe3O4-DGEA浸没,所有样品在37℃孵箱中孵育30 min;计时完毕后,使用NaCl清洗三次,用浓度为2.5%的戊二醛固定24小时;将固定好的样品再次使用NaCl清洗三次,在避光条件下使用罗丹明对其进行染色15 min。再次用NaCl清洗三次,使用荧光显微镜对其进行观察。
(2) 平滑肌细胞静态培养。从新生儿脐带中分离平滑肌细胞(Smooth muscle cell, SMCs),5% CO2和37℃条件下传代培养。在24孔板中分别加入细胞悬液和Fe3O4-DGEA,使得SMCs接种浓度为2 × 104 cells/cm2,Fe3O4-DGEA的浓度为50 μg/mL,培养1天和3天后用CCK-8检测细胞活性,使用戊二醛将样品固定,罗丹明染色,每个样品设3个平行样。
(3) 内皮细胞静态培养。从新生儿脐带中分离内皮细胞(Endothelial cells, ECs),5% CO2和37℃条件下传代培养。在24孔板中分别加入细胞悬液和Fe3O4-DGEA,使得ECs接种浓度为1 × 104 cells/cm2,Fe3O4-DGEA的浓度为50 μg/mL,培养1天和3天后用CCK-8检测细胞活性,使用戊二醛将样品固定,罗丹明染色,每个样品设3个平行样。
(4) 内皮细胞迁移实验。细胞划痕实验常常用来分析细胞迁移能力和损伤组织的修复能力,当细胞长到融合的单层细胞状态时,在融合的单层细胞上人为制造一个空白区域,称为“划痕”,划痕边缘的细胞会逐渐进入空白区域使“划痕”愈合 [17]。将ECs接种于24孔板中,使其接种密度为5 × 104 cells/cm2,培养,待细胞长满后,使用200 μL枪头在样品上垂直轻轻划过,使得划过的地方细胞被擦掉,在光镜下拍照取值;将制备好的Fe3O4-DGEA在紫外的条件下,灭菌30 min,计时结束后,用培养基对Fe3O4-DGEA溶解,使其溶度为50 μg/mL;向24孔板中加入1 mL样品溶液,将样品放回细胞培养箱培养24 h,计时结束后,在光镜下拍照取值。
2.5. 统计学分析
本文中,使用单因素方差分析方法(ANOVA)进行统计,样品设置3个平行样,结果均以平均值土标准差的方式展示。*P < 0.05被认为是统计学上的显著差异。
3. 结果与讨论
3.1. 改性Fe3O4-NP水合粒径表征结果
由图1可得,Fe3O4-NP、Fe3O4-EG 和Fe3O4-DGEA样品的水合粒径分别为683.8,592.4和517.2 nm。Fe3O4-NP 样品水合粒径较大,这是由于Fe3O4-NP颗粒直径存在磁性,在水中容易聚集。Fe3O4-NP表面引入KH560后,Fe3O4-NP在水中的分散性有所提高,因此水合粒径下降。Fe3O4-EG样品引入DGEA肽后,使得Fe3O4-NP的水合粒径大幅度下降,说明接枝了DGEA肽的Fe3O4-NP的分散性有所提高。

Figure 1. Results of hydration particle size of different samples (mean ± SD, N = 3)
图1. 不同样品水合粒径检测结果(mean ± SD, N = 3)
3.2. 改性Fe3O4-NP的FTIR结果
图2为样品表面结构变化的红外光谱。Fe3O4-NP样品588 cm−1出现了Fe-O特征吸收峰,这是Fe3O4-NP的典型特征峰。1632 cm−1和3432 cm−1处的分别出现了C=O和-OH伸缩振动峰,这表明Fe3O4-NP表面既存在-OH,又存在C=O结构,Fe3O4-NP表面存在-OH,表明Fe3O4-NP与硅烷偶联剂KH560成功发生反应。Fe3O4-EG样品在1110 cm−1处出现的Si-O特征吸收峰,说明此反应成功将KH560引入Fe3O4-NP表面。Fe3O4-DGEA样品1540 cm−1出现了N-H的弯曲振动峰,1403 cm−1处出现了C-N伸缩振动峰,这是环氧基开环生成-OH和与氨基结合之后生成的C-N键。以上结果表明在Fe3O4-NP表面成功引入DGEA肽。

Figure 2. FTIR spectra of different samples
图2. 不同样品的FTIR表征结果
3.3. 改性Fe3O4-NP表面-COOH定量表征结果
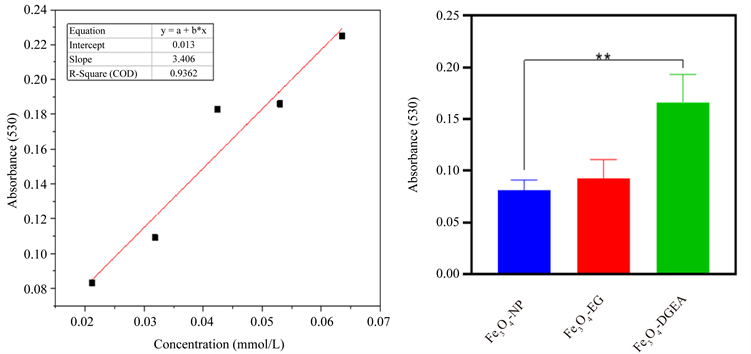
图3(a)为不同浓度梯度下甲苯胺蓝的标准曲线。拟合方程为:
Y = 3.406 X + 0.013 (1)
其中Y代表的是530 nm处吸光度值,X代表的是TBO浓度,拟合度R2 = 0.936。
通过测定Fe3O4-DGEA样品的吸光度值,代入公式(1)中,得到Fe3O4-DGEA表面-COOH含量,由公式(1)可得,Fe3O4-DGEA表面-COOH含量为(4.50 ± 0.65) × 10−5 mol/L.从测定结果看,进一步证明Fe3O4-NP表面成功引入DGEA。
3.4. 血小板粘附与激活实验
如果血管有任何损伤,血小板会立刻响应,血小板粘附、聚集是血小板活化的标记,通过血小板的黏附实验从而对Fe3O4-DGEA样品的血液相容性进行初步评估,实验结果如图所示。从图4可知,空白对照样及Fe3O4-NP样品血小板数量明显多于Fe3O4-DGEA样品,并且出现了大量聚集,聚集的血小板会释放出内部物质促进血小板激活,血小板激活后,会呈铺展形态。而Fe3O4-DGEA样品中,粘附的血小板数量与空白对照样相比显著下降,基本无呈现铺展形态的血小板。
3.5. 平滑肌细胞培养实验结果
将SMCs与各样品共培养,检测样品对SMCs的影响,细胞培养1天和3天的荧光染色图如图5(a)所示。图5(a)中,各样品与SMCs共培养后,SMCs都出现了典型的长梭形,观察发现,各组样品中,SMCs的细胞骨架都出现了一定程度破坏,其中,Fe3O4-NP样品最为明显,但是,在Fe3O4-NP表面引入多肽以后,其细胞相容性大大增加,SMCs细胞骨架的破坏程度下降。图5(b)中,不同样品对SMCs活性产生了不同的影响,通过对比Fe3O4-NP样品与空白对照组,可以发现,培养SMCs 1天和3天后,Fe3O4-NP样品SMCs的细胞活性比空白对照样下降,这是因为Fe3O4-NP本身具有一定的毒性。Fe3O4-DGEA样品的细胞活性与Fe3O4-NP样品相比较小,说明Fe3O4-DGEA样品可以抑制SMCs的增殖。
 (a) (b)
(a) (b)
Figure 3. (a) Standard curve of TBO determination; (b) Determination of surface COOH of Fe3O4-DGEA sample (0.001 < *P < 0.01, mean ± SD, N = 3)
图3. (a) TBO测定的标准曲线;(b) Fe3O4-DGEA样品表面-COOH测定结果(0.001 < *P < 0.01, mean ± SD, N = 3)

Figure 4. Fluorescence staining results of platelet adhesion on different samples Morphology platelet adhesion on different surfaces of samples
图4. 不同样品表面血小板粘附的荧光染色结果

Figure 5. (a) Immunofluorescence staining of SMCs on different samples; (b) CCK-8 results of SMCs on different samples (0.01 < *P < 0.05, mean ± SD, N = 3)
图5. (a) 不同样品平滑肌细胞免疫荧光图片;(b) 不同样品平滑肌细胞CCK-8结果(***P < 0.001, mean ± SD, N = 3)
3.6. 内皮细胞培养实验结果
图6(a)中,各样品与ECs共培养后,ECs都出现了明显的铺路石状,观察发现,各组样品中,内皮细胞的细胞骨架都出现了一定程度破坏,其中,Fe3O4-NP样品最为明显,但是,在Fe3O4-NP表面引入多肽以后,其细胞相容性大大增加,ECs细胞骨架的破坏程度下降。各组样品与ECs培养1天和3天后,ECs CCK-8检测结果如图6(b)所示。图6(b)中,不同样品对内皮细胞活性产生了不同的影响。通过对比Fe3O4-NP样与空白对照样,可以发现,培养ECs 1天和3天后,Fe3O4-NP样品ECs的活性明显下降,这是因为Fe3O4-NP本身具有一定的毒性。而Fe3O4-DGEA样品的细胞活性明显增加。
3.7. 内皮细胞迁移实验结果
内皮细胞在划痕模型下的迁移距离对于受损组织的修复起着至关重要的作用,其结果是ECs的粘附、迁移以及增殖等细胞基本生理活动的综合表现。当划痕实验构建成功以后,立刻在倒置相差显微镜下,记录此时划痕的宽度,记为0 h,继续培养24 h后,再次记录划痕的宽度,记为24 h。各样品在划痕模型下培养24 h前后的划痕结果如图7(a)所示。图7(b)中,经过24 h的培养,Fe3O4-NP样品ECs迁移距离小于空白对照样,这说明Fe3O4-NP本身具有一定的毒性,不能为ECs的迁移提供较好的诱导环境,细胞创伤愈合能力下降,因此ECs迁移的距离下降。Fe3O4-DGEA样品ECs迁移的距离远远大于空白对照样ECs迁移的距离,产生此结果的可能原因是DGEA肽的引入,使得Fe3O4-NP的毒性大大降低。

Figure 6. (a) Immunofluorescence staining of ECs on different samples; (b) CCK-8 results of ECs on different samples (0.01 < *P < 0.05, mean ± SD, N = 3)
图6. (a) 不同样品内皮细胞免疫荧光图片;(b) 不同样品内皮细胞CCK-8结果(0.01 < *P < 0.05, mean ± SD, N = 3)

Figure 7. Each sample (a) migration diagram of ECs before and after 24 h scratch; (b) statistical diagram of migration results of ECs before and after 24 h scratch (0.01 < *P < 0.05, mean ± SD, N = 3)
图7. 各样品ECs划痕(a) 24 h前后迁移图;(b) 24 h前后Es迁移结果统计图(0.01 < *P < 0.05, mean ± SD, N = 3)
Fe3O4-NP具有广泛的应用,研究也发现,Fe3O4-NP对生物具有毒性效应。作为介于氨基酸和蛋白质之间的一种中间产物,多肽具有良好的生物相容性,将多肽用于Fe3O4-NP的表面改性,可以提高其生物相容性。同时,由于DGEA多肽的功能,DGEA多肽改性Fe3O4-NP具有抑制血小板粘附与激活的能力。
4. 结论
本文通过固–液反应,将DGEA多肽与KH560修饰的Fe3O4-NP共价结合,对Fe3O4-NP表面进行改性,该结构为Fe3O4纳米粒子的生物应用提供了一个良好的平台。
1、水合粒径检测结果表明,在Fe3O4-NP表明固定DGEA多肽增加了Fe3O4-NP在水中的分散性。
2、FTIR结果表明,DGEA多肽结构中的氨基与KH560结构中的环氧基在碱性条件下发生反应,使得改性后的Fe3O4-NP为羧基化的表面。
3、血小板黏附结果表明Fe3O4-DGEA不会导致血小板激活程度增加,细胞培养结果表明,Fe3O4-DGEA对内皮细胞和平滑肌细胞无明显的细胞毒性作用,同时,可以促进损伤内皮细胞的迁移,具有一定的生物相容性。
综上所述,DGEA多肽改性Fe3O4-NP不仅提供了有效的表面改性方法,同时也为Fe3O4-NP表面生物修饰的进一步应用开辟了的新途径。
基金项目
国家自然科学基金(31870955),国家重点研发计划(2020YFC11077303)。
NOTES
*通讯作者。