1. 引言
牡丹(Paeonia suffruticosa Andr·)原产地中国,是木本油料作物,且兼具有药用和观赏价值。属于毛茛科芍药属。至今培植已有大约2000年的历史。通过对传统药用牡丹以及观赏牡丹价值的研究进而衍生出油用牡丹,并将其制备成为牡丹籽油作为首要用途。紫斑牡丹和凤丹牡丹的籽仁制备的籽油在2011年卫生部发布的第9号公告中被批准为新资源食品 [1]。据统计我国油用牡丹种子的年产量约为99.9 × 103吨,如果全部用来生产牡丹籽油,每年将产生约44.95 × 103吨牡丹籽壳。如果不能很好的将牡丹籽壳利用起来,就会造成严重的资源浪费现象,还会引起环境问题。牡丹籽壳加工利用问题吸引了许多研究人员的注意力。然而到目前为止,牡丹的应用和开发仍处于起步阶段,关于牡丹籽壳的研究报告更是少之又少。故该研究将对牡丹(凤丹)籽壳的研究与开发应用提供更加广泛的途径。
正己烷作为提取植物油的常用溶剂,存在诸多不足,如毒性、安全性、不可再生性和一定的环境污染等 [2]。目前,已有一些国家在食品、药品、保健食品和化妆品生产中对正己烷的适用性出台了相关法规和限制 [3]。乙醇作为提取的溶剂,已广泛用于食品和制药行业 [4]。2016年,Toda等人以乙醇作为溶剂研究了大豆油提取动力学 [5]。贝萨等人的研究成果进一步表明,乙醇能够从固体基质中将油脂完全提取出来 [6]。与正己烷相比,乙醇法提取油脂含有更多的活性物质 [7]。
综上所述,本研究以乙醇作为提取溶剂,油用牡丹(凤丹)加工剩余物籽壳为原料,以提取物产率为响应值,通过单因素实验和正交实验制备最优提取工艺。通过热重分析(Thermogravimetric Analysis, TG)、傅里叶变换红外光谱仪(Fourier Transform Infrared Spectromete, FTIR)、扫描电子显微镜(Scanning Electron Microscope, SEM)、高效液相色谱(High Performance Liquid Chromatography, HPLC)、气相色谱(Gas Chromatography, GC),以及体外抗氧化活性和鼠体内毒性实验对富含活性成分的籽壳提取物进行表征分析。本研究将为油用牡丹企业深加工,以及牡丹籽壳提取物的潜在应用提供基础数据支撑,为其资源开发利用做出贡献。
2. 材料与方法
2.1. 材料
白藜芦醇标准品、芍药苷标准品:美国Sigma公司;芦丁标准品:成都普思生物科技股份有限公司;超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒、丙二醛(MDA)试剂盒:南京建成生物科技有限公司;没食子酸、亚硝酸钠、氯化铝、过氧化氢、三氯化铁、苯酚、抗环血酸、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、硫代巴比妥酸(TBA)、三氯乙酸(TCA)、硫酸亚铁、3,5-二硝基水杨酸等均为分析纯。
2.2. 仪器与设备
UV-5500紫外–可见光分光光度计:IRAffinity-1傅里叶变换红外色谱(FTIR) :日本岛津公司;QUANTA200电子扫描显微镜(SEM) :FEI;7890A气相色谱仪:安捷伦有限公司;1525高效液相色谱仪(HPLC) :WATERS;Infinite M200 PRO酶标仪:长沙泰肯生物技术有限公司;STA449F5 Jupiter®热重分析仪:德国耐驰。
2.3. 方法
2.3.1. 样品处理
油用牡丹(凤丹)加工剩余物牡丹籽壳是由江苏国色天香油用牡丹技术开发有限公司惠赠,牡丹籽壳置于阴凉通风处,吹干,使用多功能粉碎机将样品碎成粉末状,过筛,目数20。0℃~4℃低温干燥处保存,留作备用。
2.3.2. 牡丹籽壳的提取
将40.0 g牡丹籽壳粉与一定体积的乙醇溶液混合于圆底烧瓶中,回流提取,一定时间后,5000 r/min离心8 min,取出上清液,置于旋转蒸发仪上负压旋出溶剂乙醇,剩余物为牡丹籽壳提取物,标记为PEO,−20℃低温保存备用。
将PEO用十倍体积的石油醚置于分液漏斗中进行萃取,分离得到石油醚相,旋蒸回收溶剂,所获得的部分为PEO的含油部分,剩余部分为PEO的非油部分。另外,采用传统索氏提取法,以石油醚为溶剂,抽提,干燥后得到的提取物,标记为SEO。
(1)
式中:
为粉碎后的牡丹壳粉的质量/g,
为离心干燥后牡丹壳提取物的质量/g。
2.3.3. 单因素及正交实验设计
单因素实验部分:以PEO产率为响应值,分别探讨乙醇浓度(55%、65%、75%、85%、95%)、固液比(1:6、1:8、1:10、1:12、1:14)、提取温度(60℃、70℃、80℃、90℃、100℃)和提取时间(2 h、3 h、4 h、5 h、6 h) 4个单因素对PEO产率的影响。
正交实验部分:以单因素实验为基础,PEO产率为响应值,采用正交实验设计表L16(45)对PEO提取工艺进行优化,因素与水平设计如表1,每组实验进行三次平行。

Table 1. L16 (45) orthogonal experiment factors and levels
表1. L16 (45)正交实验因素与水平
2.3.4. SEM分析方法
用导电双面胶将样品固定在样品台上,真空喷镀,通过扫描电子显微镜观察牡丹籽壳原料和提取后残渣的表面形态。
2.3.5. TG分析方法
称取25~30 mg样品放在氧化铝坩埚,以空坩埚作为基线,氮气气氛,加热温度从40℃~800℃,升温速率为10℃/min,对样品的热分解规律进行检测。
2.3.6. FTIR分析方法
称取2.0 mg样品与200.0 mg KBr研磨混合压片,采用红外光谱仪在500~4000 cm−1范围对样品进行红外光谱检测。
2.3.7. 多糖、酚类和总黄酮含量测定
1) 采用苯酚–硫酸法 [8] 检测多糖含量
以葡萄糖为标准品制作标准曲线,波长设定为490 nm,测定数值,并计算出回归方程及相关系数R2。将牡丹籽壳油样品(1 mg/mL)吸光值,带入回归方程,计算出总糖在样品溶液中的含量。
2) 检测牡丹籽壳油样品中总酚 [9] 含量
标准曲线的制作:在试管中加入不同体积的(0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL)没食子酸标准品(1 mg/mL),没食子酸标准品用甲醇溶解,加入甲醇将各管补至相同的体积(1 mL)。加入福林酚1.5 mL和Na2CO3(20%)溶液2 mL,混匀后,静置0.5 h,波长设定为765 nm,测定数值,并计算出回归方程及相关系数R2。
样品中总酚含量的测定:甲醇溶解样品,浓度为5mg/mL。按照上文标准曲线的制作方法,用配置好的牡丹籽壳油样品来替代没食子酸,测定吸光值,带入回归方程,计算出总多酚在牡丹籽壳油样品溶液中的含量。
样品中总黄酮含量采用氯化铝比色法 [10]:用5.0 mL蒸馏水溶解一定质量的牡丹籽壳油样品,加入0.3 mL的亚硝酸钠(6%),混匀,室温静置5 min。然后,加入0.3 mL的氯化铝(10%)和2.0 mL的氢氧化钠(1 M),再静置6 min。最后,用蒸馏水定容至10 mL。波长设定为510 nm。测定数值,并计算出回归方程及相关系数R2。对应样品中总黄酮含量用每克样品芦丁当量毫克来表示。
2.3.8. 牡丹籽壳油中白藜芦醇和芍药苷含量测定
1) 白藜芦醇含量检测:配置白藜芦醇标准储备液(1 mg/mL),稀释成不同的浓度,采用HPLC仪检测,Diamonsil反相C18色谱柱(4.6 mm × 150 mm, 5 μm);流动相为乙腈–乙酸水(0.2%) (30:7, V/V);流速1.0 mL/min;柱温30℃;进样量10 μL;检测波长306 nm。其保留时间为7.9 min,白藜芦醇的回归方程为Y白藜芦醇 = 23861X + 34896 (R2 = 0.9994, n = 8)。通过比较其与白藜芦醇标准品的保留时间比对,算出白藜芦醇在样品中的含量。
2) 芍药苷含量检测:配置芍药苷标准储备液(1 mg/mL),稀释成不同的浓度,采用HPLC仪检测,Diamonsil反相C18色谱柱(4.6 mm × 150 mm, 5 μm);流动相为乙腈–水(16:84, V/V);流速1 mL/min;柱温30℃;进样量10 μL;检测波长230 nm。芍药苷的保留时间为13.2 min,芍药苷的回归方程为Y芍药苷 = 4173.9X + 5245.3 (R2 = 0.9994, n = 8)。通过比较其与芍药苷标准品的保留时间比对,算出芍药苷在样品中的含量。
2.3.9. 脂肪酸成分分析
样品前处理:正己烷溶解一定量的样品,定容至25 mL。将样品进行甲酯化,用移液枪吸取PEO样品2 mL至试管中,向其再加入氢氧化钠-甲醇溶液2 mL(0.5 mol/L)。混匀后,静置5 min,向混合液中加入一定体积的超纯水,摇匀,静置后,弃去下层液体,上层液体用超纯水反复洗涤,直至PH为7,并弃去水层。用于GC分析。
GC条件:Agilent HP-55%苯基甲基硅氧烷毛细管柱(30 m × 0.32 mm, 0.25 μm);载气:高纯氮气;载气压力:0.25 mpa;分流进样,分流比:10:1;流速:0.90 mL/min;进样量:1.0 μL;进样口温度:250℃;检测器温度:280℃;升温程序:初始温度设置为130℃,以4℃/min的速率升至230℃,在230℃保持30 min直至分析完成。
2.3.10. 体外抗氧化活性分析
1) DPPH自由基清除:参照文献方法 [11],并稍作修改。用80%乙醇配置不同浓度样品,对照组为抗坏血酸。用无水乙醇配制25 mg/mL的DPPH溶液。在各试管中,加入2 mL配置好的PEO样品和2 mL的DPPH溶液,混匀,避光处理,0.5 h后,波长设定为517 nm,检测吸光值。清除率表示样品PEO清除DPPH的能力。平行3次,计算清除率。其公式为:
(2)
式中:
为DPPH溶液与80%乙醇的混合液;
为DPPH溶液与样品溶液的混合液;
为80%乙醇与样品溶液的混合液。
2) ABTS自由基清除:用80%乙醇配置不同浓度样品,对照组为抗坏血酸。在各试管中,加入2.0 mL样品和2.0 mL ABTS [12] 溶液(7 mmol/L),避光处理,0.5 h后,波长设定为734 nm,检测吸光值。清除率表示PEO样品清除ABTS的能力。平行3次,计算得出清除率。其公式为:
(3)
式中:
为ABTS溶液与80%乙醇的混合液;
为ABTS溶液与样品溶液的混合液;
为PBS溶液与样品溶液的混合液。
3) 超氧自由基清除:用80%乙醇配置不同浓度样品,对照组为抗坏血酸。在各试管中,加入待测样品1 mL,Tris-HCl缓冲溶液4 mL (PH = 8),邻苯三酚 [13] 溶液0.4 mL,5 min后加入1 mL HCl (8 mmol/L),波长设定为322 nm,检测吸光值。清除率表示样品PEO清除超氧自由基的能力。平行3次,计算得出清除率。其公式为:
(4)
式中:
为空白对照;
为待测样品的吸光值;
为无邻苯三酚时样品的吸光值。
4) 羟自由基清除:用80%乙醇配置不同浓度样品,对照组为抗坏血酸。在各试管中,加入1 mL样品和2 mL浓度为6 mmol/L的FeSO4溶液,混匀后加入6 mmol/L的H2O2 2 mL,避光处理,混匀,静置8 min,再加入2 mL的水杨酸 [14] 溶液(6 mmol/L),37℃,水浴反应0.5 h,波长设定为510 nm,检测吸光值。清除率表示样品PEO清除羟自由基的能力。平行3次,计算得出清除率。其公式为:
(5)
式中:
为空白对照;
为样品的吸光值;
为无水杨酸时样品的吸光值。
5) 脂质体过氧化抑制活性:采用硫代巴比妥酸(TBARS) [15],通过硫代巴比妥酸反应物测定牡丹籽壳中PEO和SEO样品对脂质过氧化抑制的活性(TBARS)分析。将小鼠的肝脏加入生理盐水(W/V = 1:100),使用高速匀浆机进行匀浆,在各试管中加入1 mL小鼠肝脏溶液,和1 mL不同浓度的样品,0.5 mmol/L的FeCl3,0.05 mL的H2O2 (0.5 mmol/L),混匀后37℃条件下静置30 min,再加入1.5 mL TCA (20%, W/V)溶液,1.5 mL硫代巴比妥酸(TBA)溶液(0.8%, W/V)终止反应,混匀,置于99℃水浴中加热10 min,冷却后,4000 r/min离心10 min,上清液在532 nm处进行检测。其公式为:
(6)
式中:
为空白对照;
为待测样品的吸光值;
为小鼠肝细胞溶液的吸光值(80%无水乙醇和小鼠肝细胞溶液的混合液)。
2.3.11. 鼠体内毒性分析
30只体重60~80 g的雄性Wistar大鼠(六周)购买于中国上海SLAC动物实验室,每5只为一组,将其随机分为六组。在一定条件下(每12 h进行明暗循环,温度20℃~24℃和相对湿度35%~60%)饲养在不锈钢笼中,食物和水自由供应。实验前12小时,自行饮水,禁食。使用盐水–羧甲基纤维素钠盐(99:1, V:V)制备PEO样品溶液。将该溶液在室温搅拌直至使用,大鼠实验组使用不同剂量0.0546~0.8736 mg/kg的PEO溶液,对照组使用相同剂量的盐水–羧甲基纤维素钠盐(99:1, V:V)的溶液。每天下午2点进行灌胃,连续灌胃45天后,将大鼠禁食24 h,并通过脊椎脱臼法处死,本研究依据《黑龙江省实验动物管理条例》进行。将大鼠的血清收集,分离并在−80℃保存。大鼠血清中CAT、SOD、MDA水平的测定是按照CAT、SOD、MDA检测试剂盒说明书进行操作的。
3. 结果与分析
3.1. 单因素实验结果
3.1.1. 乙醇浓度对PEO产率的影响
固定料液比1:10 g/mL、提取温度90℃、提取时间4 h条件下,评价乙醇在不同浓度(55%、65%、75%、85%、95%)条件下对PEO产率的影响见图1(a)。可以观察得出,乙醇浓度对PEO产率的影响极为明显。随乙醇浓度的增加,PEO产率也持续增加。较高乙醇浓度有利于溶剂的扩散和渗透,可提取较多的弱极性物质。本实验结果与文献 [3] 结论相一致。因此,选择95%的乙醇浓度作为最佳提取浓度。
3.1.2. 料液比对PEO产率的影响
固定乙醇浓度95%、提取温度90℃、提取时间4 h,评价不同料液比(1:6、1:8、1:10、1:12、1:14)对PEO产率的影响见图1(b)。可以观察得出,在一定范围内,伴随着料液比的增大,PEO产率先增加,在料液比为1:10时,产率最高,不断增大料液比后,产率逐步趋于平稳。合理的增加料液比,可以增大反应溶剂和提取物之间的接触面积,过多溶剂也会增加回收溶剂成本,过大料液比不利于PEO的回收处理,因此选择料液比为1:10 g/mL作为最佳提取料液比。
3.1.3. 提取温度对PEO产率影响
同样在固定乙醇浓度95%、料液比1:10、提取时间4 h,评价不同提取温度(60℃、70℃、80℃、90℃、100℃)对PEO产率的影响见图1(c)。可以观察得出,PEO产率与温度呈正相关趋势,即温度越高,产率越大,90℃时达到峰值,100℃时趋于稳定。高温条件下更有利于传质,但提取温度超过乙醇溶液的沸点时,传质无明显变化。因此,提取温度选择为90℃。
3.1.4. 提取时间对PEO产率的影响
固定浓度95%,料液比1:10,提取温度90℃,评价不同提取时间(2、3、4、5、6 h)对PEO产率的影响见图1(d)。可以观察得出,在2~4 h,PEO产率与时间呈正相关趋势,在4 h时达到最大值,继续增加提取时间,产率不在继续增加。过长的提取时间,增加了溶质与氧的接触,导致更多氧化反应的发生,不利于PEO的提取。故提取时间设为4 h。
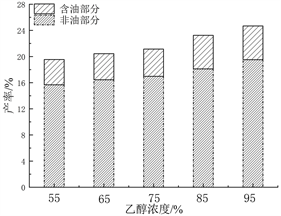 (a)
(a) 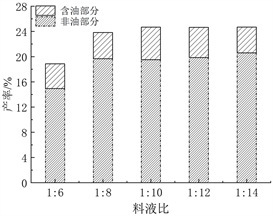 (b)
(b) 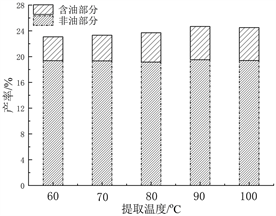 (c)
(c) 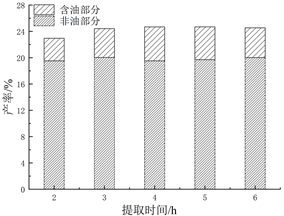 (d)
(d)
Figure 1. (a) The influence of ethanol concentration on the yield of PEO; (b) The influence of material-to-liquid ratio on the yield of PEO; (c) The influence of extraction temperature on the yield of PEO; (d) Effect of extraction time on the yield of PEO
图1. (a) 乙醇浓度对PEO产率的影响;(b) 料液比对PEO产率的影响;(c) 提取温度对PEO产率的影响;(d) 提取时间对PEO产率的影响
3.2. 正交实验结果
本研究采用L16(45)正交实验对实验条件进行了优化。表2为正交实验结果。每个影响因素对PEO产率影响表现为极差(R)值的大小,R值的大小与PEO的产率呈正相关趋势,R越小,表明影响因素对PEO产率的影响越小,各影响因素对PEO产率的影响顺序由高到低依次为:A > B > C > D。根据(表3)方差结果分析观察得到,四个反应因素中影响最大的因子是乙醇浓度(因素A),第二位是固液比(因素B),其次为提取温度(因素C),最后为提取时间(因素D)。提取PEO的最佳工艺分别为:A4,B3,C3和D3 (乙醇浓度为95%,固液比为1:10 g/mL,提取温度为90℃,提取时间为4 h)。在此条件下,PEO产率为24.68 ± 1.27% (n = 3),油脂和非油脂部分产率分别为5.16和19.52%。PEO中油脂部分的产率与SEO基本相同(4.77%)。PEO中多糖、总酚和总黄酮含量分别为8.72、5.85和10.19%。

Table 2. PEO L16(45) orthogonal experiment results
表2. PEO L16(45)正交实验结果

Table 3. Orthogonal experiment analysis of variance
表3. 正交实验方差分析
3.3. 形态分析
图2(a)~(d)为牡丹籽壳原料、提取剩余物的实物照片和SEM扫描电镜照片。从图可以看出,它们的表面形态存在明显的差异,其中牡丹籽壳原料表面呈现光滑的块状结构,而提取剩余物表面则呈现多孔隙的片层结构。对比观察得出,乙醇溶液对牡丹籽壳的提取效果作用比较明显。
 (a)
(a)  (b)
(b)  (c)
(c)  (d)
(d)
Figure 2. (a) Peony seed husk raw materials; (b) Peony seed husk raw material extraction residue; (c) Electron microscope picture of peony seed shell raw material (1000×); (d) Electron microscope picture of the residue of peony seed hull extraction (1000×)
图2. (a) 牡丹籽壳原料;(b) 牡丹籽壳原料提取剩余物;(c) 牡丹籽壳原料电镜图片(1000×);(d) 牡丹籽壳提取剩余物电镜图片(1000×)
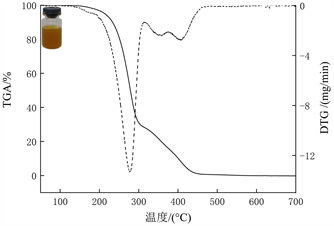
3.4. 热重结果
图3(a)和图3(b)分别为SEO和PEO的热重图。DTG曲线上的峰值代表在该温度范围的最大失重率 [16] [17]。从图中观察到,SEO和PEO低分子量组分分解峰分别在259℃和277℃处,SEO和PEO高分子量组分分解峰在367℃和406℃处。由于PEO中含有较多的多糖和其他活性成分,导致PEO的分解温度低于SEO。
 (a)
(a)  (b)
(b)
Figure 3. (a) SEO thermogram; (b) PEO thermogram
图3. (a) SEO热重图;(b) PEO热重图
3.5. 芍药苷与白藜芦醇含量分析
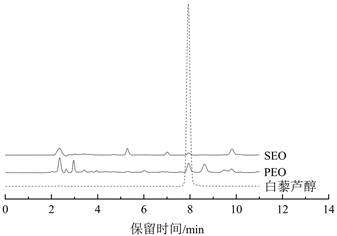
HPLC检测分析结果(见图4)可得PEO样品中提取的活性成分含量与SEO样品相比,其含量更高,PEO中白藜芦醇含量为0.014%,对比SEO中白藜芦醇的含量仅为0.0011%,PEO中白藜芦醇含量为SEO的12.72倍。此外,在PEO样品中,含有芍药苷成分,其芍药苷含量为1.40%,而SEO样品中不含有芍药苷成分。
 (a)
(a) 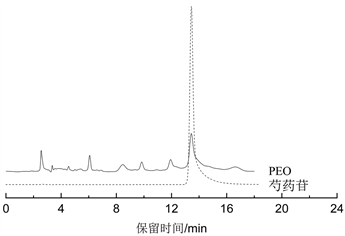 (b)
(b)
Figure 4. (a) Resveratrol, PEO, SEO liquid chromatogram; (b) PEO, paeoniflorin liquid chromatogram
图4. (a) 白藜芦醇、PEO、SEO液相色谱图;(b) PEO、芍药苷液相色谱图
3.6. 红外光谱分析
白藜芦醇、角鲨烯、芍药苷、PEO、SEO、EPA红外谱图如图5。观察得出,芍药苷在3420 cm−1处有明显的羟基振动吸收峰,PEO在3420 cm−1也有了明显的羟基振动吸收峰,对比SEO在3420 cm−1处没有振动吸收峰,三者说明PEO中含有芍药苷成分,在SEO中没有芍药苷。角鲨烯、EPA、PEO和SEO在3009、2925和2854 cm−1处的峰分别为顺式双键(-C=C)上的-CH伸缩振动 [18]、亚甲基(-CH2)和甲基(-CH3)伸缩振动,这表明PEO和SEO均含有角鲨烯和EPA。白藜芦醇、PEO和SEO在3293和1147 cm−1处有明显的羟基和醚键振动吸收峰,这一结果表明SEO和PEO两者中皆含有白藜芦醇。波数为938 cm−1处的吸收峰,代表双键 [19] 上的-CH平面外变形振动。苯环特征吸收峰的波数在1604~1450 cm−1之间。另外,在1712 cm−1的峰被和酮(-C=O)的振动相关,红外光谱结果表明PEO富含活性成分,包括白藜芦醇、芍药苷、EPA和角鲨烯,这结果也被HPLC和GS结果所证实。

Figure 5. Infrared spectra of paeoniflorin, resveratrol, squalene, EPA, SEO, PEO
图5. 芍药苷、白藜芦醇、角鲨烯、EPA、SEO、PEO红外谱图
3.7. 脂肪酸成分分析
SEO和PEO油脂部分的脂肪酸组成见图6,观察得出,SEO和PEO脂肪酸组成成分比较相似。此次实验SEO油脂部分中的油酸含量(27.0%),亚油酸的含量(22.9%)和PEO油脂部分中的油酸含量(28.2%),亚油酸的含量(23.0%)均与文献 [20] 已经报道的牡丹籽油中含有油酸含量(27.73%)和亚油酸的含量(21.4%)基本一致。而PEO油脂部分中的α-亚麻酸含量(39.8%)和棕榈酸的含量(5.8%)和SEO油脂部分中的α-亚麻酸含量(41.8%)和棕榈酸的含量(5.2%),与已报道牡丹籽油中α-亚麻酸含量(33.87%)和棕榈酸的含量(0.54%)相比数值高一些。此外,首次在PEO的油脂部分中中发现角鲨烯和EPA,其含量经计算分别为0.007%和0.0526%,在SEO中的含量分别为0.0397%和0.0134%。PEO油脂部分中所包含的肉豆蔻酸、十七烷酸、油酸、γ-亚麻酸、二十碳三烯酸和二十碳五烯酸的量比SEO包含的量要高。这可以说明乙醇作为提取物的溶剂对比石油醚作为提取溶剂具有一定的优势,可以将更多的活性成分提取出来。
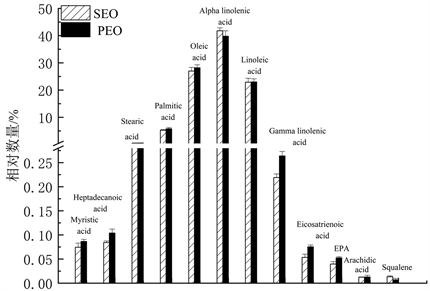
Figure 6. Fatty acid composition of PEO and SEO oil
图6. PEO和SEO油脂部分的脂肪酸组成
3.8. 体外抗氧化活性分析
SEO与PEO对DPPH自由基清除能力见图7(a)。观察得出,样品浓度与DPPH自由基清除能力呈正相关趋势,即浓度越大,DPPH自由基清除能力越强。清除能力,Vc高于PEO,PEO高于SEO。SEO与PEO的DPPH自由基清除IC50值分别为13.393与0.209 mg/mL。
SEO与PEO对羟自由基的清除能力见图7(b)。观察得出,Vc的羟自由基清除能力比SEO和PEO强。PEO的羟自由基清除能力比SEO要强,SEO与PEO的羟基自由基清除IC50值分别为9.195与12.347 mg/mL。
SEO与PEO对ABTS自由基的清除能力见图7(c)。观察得出,PEO的ABTS自由基清除能力高于SEO,比Vc的清除能力也略强一些。SEO与PEO的ABTS自由基清除IC50值分别为1.294与0.003 mg/mL。
SEO与PEO对超氧阴离子自由基的抑制能力见图7(d)。PEO对超氧阴离子自由基的抑制能力明显高于SEO,与Vc相比的抑制能力弱一些。SEO与PEO的超氧阴离子自由基清除IC50值分别为51.680与1.493 mg/mL。
自由基介导的链式反应的结果是脂质过氧化,其终产物直接或间接造成DNA损伤 [21]。SEO与PEO抗脂质过氧化的能力见图7(e)。SEO与PEO的抗脂质过氧化能力IC50值分别为19.024与7.997 mg/mL。结果显示,PEO抗脂质过氧化的能力比SEO强。
综上所述,牡丹籽壳提取物PEO由于富含活性成分,包括多糖和活性小分子物质,具有很强的综合抗氧化活性。
3.9. 毒性实验结果分析
在本研究PEO的给药范围内(0.05~0.8 g/kg),大鼠连续灌胃45天后,未发现PEO具有毒性。MDA通常被用于氧化应激的标记物 [22] [23]。另外,细胞中存在多种抗氧化机制阻止细胞内活性氧的产生和氧化损伤,CAT和SOD为其中两种常见的细胞抗氧化酶,它们可以有效减少过氧化氢的产生和脂质过氧化 [24] [25]。本研究通过对大鼠血清中CAD、SOD和MDA含量与对照组含量进行比对分析。实验结果表明,大鼠血清中CAD (见图8(a))和SOD (见图8(b))的值随着PEO口服灌胃剂量的增加而升高,而MDA却呈现降低的趋势(见图8(c))。与对照组(盐水–羧甲基纤维素钠盐)相比,PEO能有效抑制体内MDA的产生,促进大鼠血清中CAT和SOD的升高。该实验结果也与PEO体外抗氧化活性相契合。
 (a)
(a) 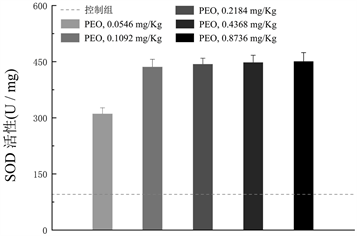 (b)
(b) 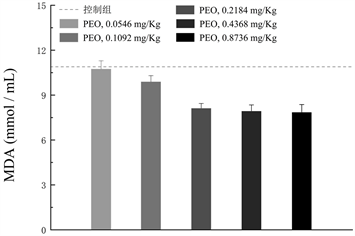 (c)
(c)
Figure 8. (a) CAT activity and PEO dose change graph; (b) SOD activity and PEO dose change graph; (c) MDA activity and PEO dose change graph
图8. (a) CAT活性与PEO剂量变化图;(b) SOD活性与PEO剂量变化图;(c) MDA活性与PEO剂量变化图
4. 结论
本研究,以油用牡丹“凤丹”加工剩余物籽壳为原料,乙醇为溶剂,提取物产率为响应值,通过单因素和正交实验制备最优提取工艺,最优工艺为:乙醇浓度95%、提取温度90℃、料液比1:10,提取时间4 h。在最优提取工艺条件下,PEO产率为24.68% ± 1.27%,其中油和非油部分产率分别为5.16%和19.52%。经HPLC检测,比对分析,牡丹籽壳乙醇提取物(PEO)内含有白藜芦醇和芍药苷,在传统石油醚索氏提取法(SEO)中含有白藜芦醇,不含有芍药苷,且白藜芦醇含量仅有PEO的1/12.72。通过GC油脂组成分析,首次在PEO的油脂部分中发现到角鲨烯(0.007%)和EPA (0.0526%)。并且经过计算PEO油脂部分中所含有的棕榈酸和α-亚麻酸含量比牡丹籽油中的含量数值大一些,另外,PEO油脂部分中所包含的肉豆蔻酸、十七烷酸、油酸、γ-亚麻酸、二十碳三烯酸和二十碳五烯酸的量比SEO包含的量要高。从体外抗氧化实验分析得出,牡丹籽壳乙醇提取物(PEO)具有很强的综合抗氧化活性。鼠持续灌胃45天后,未发现PEO具有毒性,大鼠血清检测发现PEO可以促进CAT和SOD的升高,并且抑制MDA的产生。
综上所述,以新资源食品牡丹“凤丹”加工剩余物籽壳为原料,采用乙醇为提取溶剂,获得籽壳乙醇提取物的研究,将为油用牡丹“凤丹”企业深加工,以及牡丹籽壳提取物的广阔的应用前景提供基础数据支撑,为资源合理开发利用做出相应贡献。
基金项目
感谢黑龙江省基金面上项目(C2018003)的资助。
NOTES
*通讯作者。