摘要:
通过烛缸法培养、富集、分离,获得4株具有较高脱氮除磷效率的反硝化聚磷菌N-1、N-2、N-3和N-4。4株菌剂和混合菌的脱氮率均大于60%,除磷率均大于70%。采用16S rDNA结合生理生化特性的方法确定了4株分别为善变副球菌属Paracoccus versutus和Paracoccus sp.,假单胞菌属Pseudomonas sp.,枯草杆菌Bacillus sp.。混合菌与吸附填料粉煤灰、微生物营养剂等物质混合组成微生物复合制剂,投加0.8 g/m3最佳投加量到模拟河道水体中,氨氮、硝氮、总氮、总磷以及COD降解率分别为84.6%、83.4%、81.4%、87%和42.2%。水质明显得到改善,达到GB 3838-2002中V类地表水水质指标。
Abstract:
Enriched and isolated by Candle Jar Culture method and screened based on phosphate reval test, nitrate reduction test together with metachromatic granules and PHB granules test, three DNPAOs strains with high efficiency of nitrogen and phosphate removal rates were obtained, which were strain N-1, N-2, N-3 and N-4. When every strain was cultured for 48 h in nitrogen-rich and phos-phate-rich liquid media, the nitrogen removal rates were more than 60% and the phosphate re-moval rates were more than 70%. Based on morphological, physiological and biochemical charac-teristics combined with phylogenic analysis of 16S rDNA sequences, 4 strains were identified as Paracoccus versutus, Paracoccus sp., Pseudomonas sp. and Bacillus sp. Mixed bacteria and adsorbed filler such as, fly ash, microbial nutrients and other substances were mixed to form microbial compound preparation. The optimal dosage of 0.8 g/m3 of microbial compound preparation was added to the simulated river water body. The degradation rates of ammonia nitrogen, nitrate nitrogen, total nitrogen, total phosphorus and COD were 84.6%, 83.4%, 81.4%, 87% and 42.2%, respectively. Water quality improved obviously. The water quality stably met V class of surface water quality index (GB 3838-2002).
1. 引言
随着工业的高速发展,水体富营养化已经成为日趋严重的问题,而引起众多湿地湖库等水体富营养化的主要因素就是氮、磷污染物,N、P污染物的去除是生态修复的主要目标。反硝化聚磷菌(Denitrifying Phosphate Accumulating Organisms, PAOs)在1993年由Kuba [1] 成功分离筛选出,随后,国内外学者开始对DPAOs进行研究,马放等 [2] 在实验室通过分离、筛选得到4株理想的高效反硝化聚磷菌。李勇智 [3] 研究发现反硝化聚磷菌的生长与环境温度、pH值、DO浓度、碳氮比等因素有关。张超 [4] 通过人工配水确认了最佳脱氮除磷的条件。与传统脱氮除磷技术相比,DPAOs能够在氧或者硝酸盐等物质作为电子受体的条件下,同步完成反硝化(脱氮)和过量吸磷(除磷)作用,将废水中的磷聚集在细胞内以聚磷酸盐的形式储存 [5],因而,反硝化除磷技术具有反硝化脱氮时无需碳源、吸磷时无需曝气且排泥量少等优点 [6] [7],已成为当前废水生物处理技术领域的研究热点。到目前为止,国内对于DPAOs、尤其是利用其菌制剂和特殊填料质复合材料用于水体生态修复方面的研究鲜有报道。本文以天津大沽排污河底泥、清净湖底泥作为种泥,培养筛选高效脱氮除磷菌株,通过菌落形态观察、生理生化特性研究和16S rDNA鉴定及序列测定确定该菌的分类地位。将混合菌菌体、粉煤灰、炉渣、矿渣、沸石粉以及微生物营养剂组合形成微生物复合剂应用于水体中氮磷的去除 [8]。
2. 材料和方法
2.1. 河道模拟反应器
自行设计加工的小试实验装置,各箱体为有机玻璃材质,包括进水泵、蠕动泵、搅拌器、软管等配件,如图1所示。A、B、C、D 4个相同大小的河道模拟装置反应器,每个反应器大小为:0.7 * 0.4 * 0.5 m,有效水深为0.45 m,水流量设置为15 L/h,水力停留时间7 d。通过两个相同大小的反应器模拟河道废水脱氮除磷对比实验。A、B、C、D四套装置中,A、B、C、D分别投加微生物复合剂为0.4 g/m3、0.6 g/m3、0.8 g/m3、1 g/m3。每套装置前端有一个反应室,微生物复合剂投入反应室,里面设置搅拌器,将微生物复合剂与河水搅拌均匀,水体在反应室中通过溢流进入水槽中。
2.2. 分离培养基
反硝化菌培养基;缺磷培养基;富磷培养基;富集培养基:LB培养基,微量元素成分配制见文献 [9]。异染粒染色剂,PHB (聚-B-羟基丁酸)染色试剂配制及方法见文献 [7]。
2.3. 方法
2.3.1. 反硝化聚磷菌的分离与筛选
取10 g底泥样品,加入90 mL反硝化分离培养基,混匀后置于缺氧条件中28℃富集培养5 d后转接于另一含有反硝化培养基的烧瓶中,5 d后,从反硝化分离培养基中选取菌液,以最佳稀释浓度10−3~10−5倍稀释涂布于富集培养基上,稀释涂布进行分离,28℃烛缸法 [10] 培养7 d后挑菌。挑取平皿中不同形态特征的单菌落进行平板划线分离,重复多次划线,得到单个菌株。同时以好氧培养作对照,28℃培养3~5 d。
2.3.2. 聚磷菌的分离与筛选
按照微生物实验报道的方法 [2],通过吸磷试验、硝酸盐还原产气试验及异染颗粒和PHB颗粒染色辅助检验相结合的方法进行分离菌株的筛选。PHB颗粒和异染颗粒染色观察分别根据文献 [11] 所述的方法进行。
2.3.3. 脱氮除磷效率的测定
向富磷培养基中加入KNO3,使
含量为100 mg/L,配成富氮富磷培养基。接种培养48 h后测定,
N和
含量变化,计算脱氮率和除磷率。
、
、总磷(TP)、总氮(TN)和氨氮(NH3-N)等水质指标按《水和废水监测分析方法》第4版进行检测 [12]。各个数据均为平行样品取平均值得到。
2.3.4. 菌落形态观察及生理生化特性研究
在富集培养基上观察入选菌株的菌落特征,并对菌株进行一系列常规的生理生化实验 [13],初步确定菌株的分类地位。
2.3.5. 细菌16S rDNA鉴定及序列测定
细菌DNA提取采用北京百泰克公司的基因组DNA小提试剂盒。使用细菌16S rDNA通用引物上游引物(5’-AGAGTTTGATCTGGCTCAG-3’)和下游引物(5’-AAGGAGGTGATCCAGCC-3’)扩增菌株的16S rDNA。PCR扩增体系(50 mL):5 mL 10 × Buffer (含Mg2+)、4 mL 10 mmol/L dNTP、1 mL 5 U/mL Taq酶、2.5 mL 10 mmol/mL上游引物、2.5 mL 10 mmol/mL下游引物、34 mL ddH2O、1 mL模板DNA。PCR反应条件为:95℃ 5 min;95℃ 30 s;55℃ 30 s;72℃ 90 s,30个循环;72℃ 10 min。扩增后的16S rDNA纯化后PCR产物连接到pGEM2T载体上,产物送北京奥科生物技术公司测序。测得的序列提交到GenBank并在国际生物技术信息网中心(NCBI)数据库(http://www.ncbi.nlm.nih.gov/)中进行序列同源性分析,使用ClustalX1.8软件与从GenBank数据库中获得的16S rDNA序列进行多序列比较,确定该菌的分类地位 [14]。
2.3.6. 微生物复合剂的制作
将筛选获得的菌种进行培养(LB培养基)后收集菌体,菌体、炉渣、矿渣、粉煤灰、沸石粉按照1:2:2:2:1重量比混合均匀,混合剂与微量元素(镁,铁,锰、锌、钙和钼元素)、有机酸盐(柠檬酸钠)、细胞分裂素和维生素等微生物营养剂混合形成微生物复合微生物复合剂 [15]。
3. 结果与讨论
3.1. 菌株分离及筛选
3.1.1. 反硝化菌株的分离和筛选
用大沽排污河底泥,清净湖底泥作为种泥加入反硝化培养基于28℃厌氧培养5 d后,转接于另一含反硝化培养基中5 d,直至产生气泡为止,稀释涂布进行分离,28℃烛缸法培养7 d后挑菌,挑取平皿中不同形态特征的单菌落进行平板划线分离,重复多次划线,直至分纯。得到4株菌。对4株菌做进一步研究。
3.1.2. 聚磷菌的分离与筛选
通过硝酸盐还原产气试验及异染颗粒和PHB颗粒染色辅助检验相结合的方法和吸磷试验得到HN-1、N-2、N-3和N-4 4株脱氮除磷菌株。在显微镜下可以看到4株菌既含有异染色颗粒也含有PHB颗粒。
3.1.3. 菌落形态及生理生化实验鉴定结果
N-1菌落:小圆形,透明边缘整齐,光滑稍凸起,无核,湿润,浅黄色,圆形边缘完整,菌体发粘。N-2菌落:小圆形,透明,无核,边缘整齐,光滑稍凸起,圆形边缘完整,白色。N-3菌落:无核,小圆形,透明边缘整齐,中间有突起,圆形边缘完整,白色,革兰氏染色阴性。N-4接触酶反应、氧化酶反应、葡萄糖发酵、淀粉水解等呈阳性,而吲哚反应、柠檬酸反应、硫化氢反应等呈阴性,菌落很大,灰白色或者略带一些黄色,表面典型的粗糙不规则,有很多隆起、皱褶生理生化实验结果见表1。

Table 1. Physiological and biochemical characteristics of the strain
表1. 4菌株的生理生化特征
3.1.4. 菌株的16S rDNA基因序列以及菌种鉴定
以菌株N-1、N-2、N-3和N-4的DNA为模版,扩增菌株的16S rDNA基因序列,分别得到长约1376 bp,1379 bp、1478 bp和1452 bp左右的16S rDNA片段。将其序列已经上传GenBank,数据库,并与数据库中序列进行Blast比对,其N-1、N-2序列与善变副球菌Paracoccus versutus和Paracoccus sp.同源性达99%。N-3序列与假单胞菌属Pseudomonas sp.同源性达99%。N-4序列与枯草杆菌Bacillus sp.同源性达99%。
根据细菌的菌落形态以及生理生化实验结果,结合《常见细菌系统鉴定手册》 [16] 以及《伯杰细菌鉴定手册》(第8版) [10] 中相关描述,N-1和N-2为Paracoccus versutus和Paracoccus sp.,属于善变副球菌属,N-3为Pseudomonas sp.属于假单胞菌属,N-4为Bacillus sp.属于枯草杆菌。
3.2. 脱氮除磷效率的测定
四株菌剂混合菌分别接种于LB培养基中,在30℃、140 rpm/min的摇床上过夜培养,收集菌体后用蒸馏水洗涤离心,重悬于1.1中富氮富磷培养基中,在30℃,摇床中扩大培养。起始
含量为100 mg/L,
含量为13.65 mg/L。实验测得菌株N-1、N-2、N-3、N-4和混合菌在24 h、48 h和72 h的OD值见图2。在48 h微生物OD值最高,同时测定脱氮除磷能力,4株菌和混合菌的脱氮率分别为73%、78%、69%、68.9%和84.3%,均大于60%,除磷率分别为78%、81%、72%、73%和86.3%,均大于70% (见图3)。可见这4株菌及混合菌均有较强的脱氮除磷作用,其中混合菌的降解效果最好,对氨氮和磷的去除率均大于84%以上。

Figure 2. Concentration of denitrifying phosphorus-accumulating bacteria over time
图2. 反硝化聚磷菌的菌体浓度随时间变化
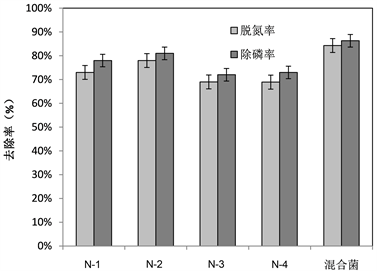
Figure 3. Nitrogen and phosphorus removal efficiency of denitrifying phosphorus-accumulating bacteria
图3. 反硝化聚磷菌的脱氮除磷效率
3.3. 微生物复合剂对河道水体污染物去除效果
连续运行1个月,对河道水体氨氮、硝氮、TN、TP和COD进行检测,由图4可以看出,随着微生物复合剂投加量由0.4 g/m3到0.8 g/m3的增加,氨氮、TN、硝氮、TP和COD去除效率提高,但是提高到0.8 g/m3时,降解率几乎不再提高。因此每吨水体投加0.8 g/m3为最佳投加量。微生物复合剂对氨氮、硝氮、TN、TP以及COD去除率分别为84.6%、83.4%、81.4%、87%和42.3%。氨氮、硝氮、TN、TP以及COD由初始的3.2 mg/L、6.4 mg/L、3.1 mg/L、1.2 mg/L和57.5 mg/L分别降到0.49 mg/L、1.06 mg/L、0.58 mg/L、0.16 mg/L和31.2 mg/L。水质明显得到改善,主要水质指标达到地表水V类标准 [12]。该研究结果为污水治理中的脱氮除磷提供了有效的方法。
4. 结论
本研究通过分离筛选得到了具有较高脱氮除磷效率的反硝化聚磷菌;利用多项分类技术鉴定:为善变副球菌属Paracoccus versutus、Paracoccus sp.,假单胞菌Pseudomonas sp.和枯草杆菌Bacillus sp.。混合菌与多种吸附填料粉煤灰、炉渣、矿渣以及微生物营养剂等物质混合组成微生物复合制剂,实验表明,投加0.8 g/m3最佳投加量的微生物复合制剂到模拟河道水体中,氨氮、硝氮、总氮、总磷以及COD去除率分别为84.6%、83.4%、81.4%、87%和42.2%。水质明显得到改善,达到GB3838-2002中V类地表水水质指标。
基金项目
国家水体污染控制与治理科技重大专项(2017ZX07107-001-004)。
NOTES
*通讯作者。