1. 引言
外泌体(Exosome)是一类内含核酸和蛋白质、直径约40~100 nm的微小囊泡 [1],多种细胞在正常及病理状态下均可特异性分泌外泌体。外泌体的内含物复杂 [2] [3] [4],包含一些核酸,如miRNA、非编码的RNA及mRNA等,它们都可作为肿瘤诊断和检测的疾病标志物 [5]。此外,外泌体还可用于制备药物载体、联合抗癌药治疗癌症等。因此分离纯化外泌体以获得高纯度的外泌体对后续研究至关重要。目前分离外泌体方法主要有超速离心法、密度梯度离心法、超滤离心法、磁珠免疫法、沉淀法、试剂盒提取等方法,但是这些分离方法存在一些缺点,如超速离心法比较耗时,密度梯度离心法步骤繁琐,沉淀法会破坏外泌体活性,试剂盒提取法特异性低 [6] [7] [8] [9],这些缺点限制外泌体的应用。因此需要研发一种耗时短、操作简单、特异性强、对外泌体破坏小的外泌体分离策略。
二氧化钛(TiO2)是一种应用广泛、无毒、稳定且抗腐蚀性能良好的材料,具有独特的特性效应和优异性能。二氧化钛主要有金红石、锐钛矿和板钛矿三种晶型,其中板钛矿型在自然界稀少,结构不稳定,没有工业价值。表面结构和微观形貌对二氧化钛的性能有重大影响,目前科研人员制备的特殊形貌二氧化钛主要包括球状 [10]、棒状 [11]、纤维状 [12]、片状 [13]、花状 [14] 等。其中,二氧化钛微球具有不易凝聚、比表面积大、扩展性能优良等优点,备受研究者的青睐。
TiO2表面Lewis酸位点与磷酸根具有很强的结合力,可以特异性结合具有完整生物膜的物质,因此被广泛应用于富集具有生物膜结构的物质 [15] [16]。利用TiO2微球对外泌体进行分离,效率明显优于传统的分离方法,不仅样品处理时间短,而且分离特异性强 [17]。本论文成功合成分散性好、颗粒均匀、表面光滑的TiO2微球用于外泌体的分离。采用溶剂热法在含聚四氟乙烯内胆的反应釜中合成TiO2微球,利用EDTA作为包覆剂减少TiO2微球表面的粗糙度,通过使用异丙醇作为反应溶剂减缓钛酸四异丙酯的水解速度,以制备出颗粒均匀的TiO2微球。利用制备的TiO2微球对含杂质蛋白的外泌体进行分离。结果表明,TiO2微球可以特异性的吸附外泌体,将外泌体从杂质蛋白中分离出来。利用TiO2微球分离外泌体的方法具有操作简单、特异性强、对外泌体破坏小等优点,可以弥补传统分离方法的不足,促进外泌体在医学检测领域中的应用。
2. 实验部分
2.1. 主要试剂
达尔伯克必需基本培养基(不含酚红,英国Gibco公司),实验配液用蒸馏水(双蒸水,上海亚荣生化仪器厂),醋酸双氧铀(AR,湖北楚盛威化工有限公司),乙二胺四乙酸(生工生物工程上海股份有限公司),戊二醛(北京索莱宝科技有限公司),PBS缓冲液(通用电气医疗集团生命科学部),异丙醇(AR,国药集团化学试剂有限公司),乙醇(AR,西陇科学股份有限公司),钛酸四异丙酯(上海麦克林生化科技有限公司)
2.2. 仪器表征
采用X-射线粉末衍射仪(MiniFlex600,日本Riguka公司,以Cu靶,Kα射线进行扫描,λ = 0.15406 nm,扫描范围5˚~80˚)研究煅烧前后TiO2微球的构型及结晶度;采用环境扫描电子显微镜(QUANTA 450,美国FEI公司)表征TiO2微球的表面形貌、尺寸;采用红外光谱仪(Perkin Elmer Spectrum2000, PerkinElmer)表征TiO2微球表面分子结构;利用透射电子显微镜(Tecnai G2,美国FEI公司)观察微球形貌和结构以及外泌体;采用纳米粒度及Zeta电位分析仪(LitesizerTM 500,安东帕上海商贸有限公司)表征微球和外泌体的粒径分布。
2.3. 实验方法
2.3.1. TiO2微球的制备
根据采用不同浓度的钛酸四异丙酯作为前驱物合成TiO2微球,其中前驱物浓度为0.0720 mol/L时制备过程如下:称取0.0220 g EDTA置于50 mL烧杯中,放入磁力搅拌子,加入32 mL异丙醇,用封口膜裹住,然后利用磁力搅拌器搅拌12 h;用移液枪吸取0.660 mL钛酸四异丙酯逐滴加入到烧杯中并继续用磁力搅拌器搅拌10 min,将反应物移入含聚四氟乙烯内衬的不锈钢反应釜内,在200℃条件下反应24 h;将产物用无水乙醇进行洗涤,在60℃条件下干燥8 h,然后在450℃下煅烧2 h。
2.3.2. 外泌体的离心分离
从人乳腺癌细胞(MDA-MB231)获得外泌体,将处于对数生长期的乳腺癌细胞经过一系列预处理之后,利用差速离心法进行处理,即利用300× g离心10 min以去除死细胞;2000× g离心20 min以去除细胞碎片;11,000× g离心45 min以去除大分子蛋白;100,000× g离心70 min得到沉淀;然后将所得沉淀重悬于PBS中,以消除污染蛋白质。所有离心过程均在4℃下进行,获得的外泌体保存于−20℃备用。
2.3.3. 利用TiO2微球对外泌体的吸脱附
取约2 μg外泌体,利用不含酚红的DMEM培养液(英国,GIBCO)稀释到最终体积为50 μL。将样品与2 mg TiO2微球混合,在4℃的温度下恒温孵育5 min,使样品有足够的附着力。简单离心后,弃去上清液,用PBS彻底冲洗沉淀三次,以除去微球表面吸附的非特异性分子。利用透射电镜(TEM)观察TiO2吸附外泌体的情况。
用碱性洗脱液对吸附在TiO2微球表面的外泌体进行洗脱,首先用10% NH3·H2O在4℃温度下与表面吸附外泌体的TiO2微球孵育10 min,用摇瓶进行洗脱。在10,000 × g离心3 min后,用PBS溶液将上清液用微孔滤膜(30 kDa)进行过滤,再用PBS溶液洗涤3次。
3. 结果与讨论
3.1. TiO2微球合成原理
为避免因使用无机钛醇盐引入的杂质阴离子,实验中使用钛酸四异丙酯作为前驱物,采用异丙醇作为溶剂减缓前驱物的水解速度,添加EDTA使微球表面更加光滑。溶剂热法反应完成之后使用乙醇进行清洗以除去溶液中残留的钛酸四异丙酯。充分干燥之后对TiO2微球进行煅烧,以提高TiO2的结晶度及除去残留的有机物。
溶剂热法反应中TiO2微球的形成过程如下(图1):
1) TiO2晶核的形成:钛酸四异丙酯首先在异丙醇溶液中析出一批极细微的颗粒作为晶核中心,晶核大小与钛酸四异丙酯浓度有关。随着反应温度和气压的不断上升,钛酸四异丙酯水解程度逐渐增大,晶核中心逐步长大,形成TiO2纳米颗粒并从溶液中析出。
2) TiO2微球的形成:随着越来越多的TiO2纳米颗粒从溶液中析出,原溶液水解平衡被打破,反应速度加快,溶液中TiO2组分不断转为固相,在EDTA的作用下有序排列生长,最终变为TiO2微球并沉淀下来。

Figure 1. Formation process of TiO2 microspheres
图1. TiO2微球的形成过程
3.2. TiO2微球的合成及条件优化
参考Yu [18] 等人的做法制备TiO2微球,采用溶剂热法在200℃条件下于含聚四氟乙烯内衬的不锈钢反应釜内反应制备TiO2微球。利用环境扫描电子显微镜进行表征,结果如图2所示。从图中可以看出制备的TiO2微球存在粒径不均匀、形状不规则、表面粗糙、黏连团聚严重、球形颗粒占比低等问题。

Figure 2. SEM image of TiO2 microspheres
图2. TiO2微球的SEM图
3.2.1. 探究包裹剂EDTA对TiO2微球表面形貌的影响
在溶剂热反应过程中,加入EDTA对TiO2微球表面结构进行修饰。在TiO2纳米颗粒形成之后,EDTA被吸附在颗粒表面,在EDTA的作用下纳米颗粒有序的在晶核表面堆积长大,形成TiO2微球。此外,若控制EDTA浓度使其能完整包覆TiO2微球,则能在微球之间产生空间位阻作用,避免颗粒聚集,从而提高TiO2微球的分散性和均匀性 [19]。将未添加EDTA制备的TiO2微球(图3(A))与加入EDTA制备TiO2微球(图3(B))进行对比,结果如图3所示。通过对比分析可知加入EDTA后,制得的TiO2微球表面更加光滑,表面毛刺明显减少。

Figure 3. SEM images of TiO2 microspheres, (A) Prepared without and (B) with EDTA
图3. TiO2微球的SEM图,(A) 未添加EDTA和(B) 添加EDTA
3.2.2. 差速离心法处理TiO2微球
首先尝试利用离心方法分离不同粒径的TiO2微球,溶剂热法反应之后,将TiO2微球溶解于EP管中,利用超声波震荡使其充分分散,然后在500 r/min下离心5 min,沉淀进行充分干燥。剩余上清液用1000 r/min进行离心5 min,将不同转速得到的产品进行干燥,并将离心处理后的TiO2微球进行SEM表征,结果如图4所示。与未进行离心处理的微球(图4(A))进行对比,500 r/min离心处理后的TiO2微球(图4(B))平均粒径增大,但仍存在许多小颗粒,并且TiO2团聚物也会被沉淀下来。1000 r/min离心处理的TiO2微球(图4(C))粒径几乎都小于1 μm。可以得出结论,采用离心法不能完全去除小颗粒TiO2,且会把团聚物一起分离出来,但是离心法可以在一定程度上将大粒径的TiO2微球筛选出来。

Figure 4. SEM images of TiO2 microspheres. (A) Uncentrifuged; (B) 500 r/min centrifugal treatment; (C) 1000 r/min centrifugal treatment after 500 r/min centrifugal treatment
图4. TiO2微球SEM图。(A) 未离心;(B) 500 r/min离心处理;(C) 500 r/min离心之后的上清液1000 r/min离心
3.2.3. 微孔滤膜分离TiO2微球
离心处理不能完全除去纳米尺寸的颗粒,因此尝试采用0.8 μm的微孔滤膜对TiO2进行过滤。将TiO2微球溶解在EP管中,并通过超声波震荡使其充分分散,然后利用微孔滤膜对溶液进行抽滤,用乙醇清洗三次。对过滤前后的TiO2微球进行SEM表征,结果如图5所示。可以看到未过滤时TiO2微球(图5(A))存在许多纳米级别的颗粒,而用微孔滤膜过滤之后(图5(B))几乎无小于800 nm的颗粒。因此,利用微孔滤膜对TiO2微球进行处理可以有效除去纳米级别的TiO2颗粒。

Figure 5. SEM images of TiO2 microspheres, filtrated. (A) Without microporous membrane and (B) By 0.8 μm microporous membrane
图5. TiO2微球SEM图。(A) 未用微孔滤膜过滤和(B) 0.8 μm微孔滤膜过滤
3.2.4. 钛酸四异丙酯的用量对TiO2微球形貌的影响
为了研究溶剂热法反应中前驱物的浓度对TiO2微球形貌的影响,以初始用量1.1 mL (3.8 mM)为对照组,分别增设60% (2.3 mM)、80% (3.0 mM)、120% (4.6 mM)作为实验组。对制备的TiO2进行扫描表征,结果如图6所示。钛酸四异丙酯用量为120% (4.6 mM)时(图6(A)),TiO2微球出现非常严重的硬团聚,颗粒形状非常不规则;用量为100% (3.8 mM)时(图6(B)),存在由多个TiO2微球构成硬团聚;用量为80% (3.0 mM)时(图6(C)),软团聚基本发生在两个或三个TiO2微球之间,可以看见许多未团聚TiO2微球,但有较多的微球呈不规则形状;用量为60% (2.3 mM)时(图6(D)),TiO2微球几乎不发生团聚,且分散均匀,形状都呈圆形或椭圆形。


Figure 6. SEM images of TiO2 microspheres prepared by different dosage of tetraisopropyltitanate. (A) 4.6 mM; (B) 3.8 mM; (C) 3.0 mM; (D) 2.3 mM
图6. 不同用量钛酸四异丙酯制备的TiO2微球的SEM图。(A) 4.6 mM;(B) 3.8 mM;(C) 3.0 mM;(D) 2.3 mM
因此可以得出结论,前驱物钛酸四异丙酯的用量在一定范围内时(2.3 mM~4.6 mM),随着前驱物浓度增加,TiO2微球硬团聚程度增加,颗粒愈不规则,当用量达4.6 mM时,几乎无单颗粒的TiO2微球,TiO2微球都团聚在一起。因此本实验制备TiO2微球采用钛酸四异丙酯的用量为2.3 mM。
优化合成条件制备微球,使用2.3 mM的钛酸四异丙酯作为前驱物,0.0220 g EDTA作为包裹剂,使用微孔滤膜对TiO2微球进行过滤,用玛瑙磨对煅烧后的TiO2微球进行研磨。如图7(D)所示,优化条件之后合成的TiO2微球颗粒规则、分散性好、表面无毛刺、无团聚现象,粒径较均匀,约0.8~3 μm左右。
3.3. TiO2微球的表征
使用透射电子显微镜(TEM)对TiO2微球进行表征,观察TiO2微球的亚显微结构,结果如图7所示。从图7(A)中可以看到制备的TiO2微球粒径约为0.8~1.6 μm左右,制备的二氧化钛球形度较佳。从图7(B)中可以看出二氧化钛微球是由许多二氧化钛纳米颗粒堆积而成的。图7(B)中FFT插图显示为衍射环,也表明微球是有纳米颗粒堆积而成。
采用纳米粒度及Zeta电位分析仪对TiO2微球的粒径分布进行表征,图7(C)为优化合成条件之后制备的TiO2微球的粒径分布图。三条曲线分别表示同一溶液样品间隔一分钟测一次所得到的结果。从图中可以看出TiO2微球粒径分布为1.1~2.3 μm左右,多数TiO2微球粒径为1.5 μm左右,随着时间推移,粒径分布峰位置不变,但峰高变低,峰型变宽,这是由于微米颗粒在溶液中聚沉引起的。
在溶剂热法反应完成之后对TiO2微球进行清洗、干燥之后取部分留样待测,剩余TiO2微球进行煅烧,对煅烧前后的TiO2微球进行表征,结果如图7(D)所示。从图中可知,衍射角2θ在25.36˚、37.94˚、48.14˚、54.02˚、55.22˚、62.72˚分别对应TiO2的(101)、(004)、(200)、(105)、(211)和(204)衍射面。将各衍射面对应的衍射峰与锐钛矿型TiO2的标准PDF卡(JCPDS 21-1272)进行对比,煅烧前后的TiO2微球均为锐钛矿型。对比衍射角为25.36˚的衍射峰,可以看到煅烧后的TiO2微球衍射峰强度增大,即煅烧后TiO2微球的结晶度更高。
对煅烧前后的TiO2微球进行红外光谱表征,检查有无有机物残留、及分析合成的二氧化钛的晶型结构,结果如图7(E)所示。钛酸四异丙酯富含甲基,然而2960 cm−1与2876 cm−1附近未出现吸收峰,可确定TiO2微球中没有钛酸四异丙酯残留;700~400 cm−1宽峰为峰锐钛矿型二氧化钛的特征峰;1300~1000 cm−1内无吸收峰,说明无醇的C-O的伸缩振动,即无乙醇或异丙醇残留;1600 cm−1附近的吸收峰为C=O伸缩振动峰,3500~2000 cm−1宽而散的峰为氢键缔合的羧基的O-H的吸收振动峰,1400 cm−1处的峰是O-H 面内弯曲振动峰,综合上述条件可知煅烧前TiO2粉体中有EDTA残留。煅烧后1400 cm−1处的吸收峰与1600 cm−1附近的吸收峰消失,3500~2000 cm−1的吸收峰变窄,推测为经过煅烧EDTA转化为CO2而除去,煅烧后的样品中3500~3000 cm−1的吸收振动峰为TiO2微球表面的O-H所产生的。2345 cm−1的峰是CO2弱吸收峰,产生的原因有两种,第一种原因是测量时仪器样品光路和参与光路不平衡而导致的,另一种是高温煅烧时EDTA分解产生CO2吸附在TiO2微球表面 [20]。通过红外光谱表征图谱可知,本次制备的二氧化钛为锐钛矿构型,经过450℃煅烧可以有效去除TiO2粉末中残留的微量EDTA。

Figure 7. (A, B) TEM images; (C) Dynamic light scattering; (D) XRD patterns; (E) Infrared spectra of TiO2 microspheres. The insert of B is the FFT image
图7. TiO2微球的(A、B)TEM图;(C) 动态光散射图;(D) XRD图;(E) 红外光谱图。B中的插图为傅里叶变换图
3.4. TiO2微球吸附和洗脱外泌体
一些金属氧化物可以可逆地与磷酸盐基团结合,具有较高的特异性 [17]。而在外泌体囊泡膜上,磷脂的亲水性磷头暴露在脂质双层的外表面。TiO2表面Ti3+具有悬挂键,可以与磷酸根形成化学键合。利用这一特性,TiO2可有效捕获外泌体,并进行富集。
碱性溶剂(pH 10~12)通常被用来破坏磷酸基团和TiO2之间的结合作用 [21]。在碱性溶液中,TiO2微球表面带负电,与磷酸根带相同电荷,产生电荷互斥,外泌体从TiO2微球表面脱落,但溶液pH过高时,会导致膜上的通道蛋白、转运蛋白以及信号通路蛋白等组分失去正常功能,使外泌体膜失去选择性透过功能,发生不可逆破坏。因此实验采用10% NH3·H2O洗脱吸附在TiO2微球表面的外泌体。
利用TiO2微球对外泌体进行分离,经过一系列前处理之后,利用透射电镜观察在80 kV下TiO2微球对外泌体吸附情况,表征结果如图8所示。从图8(A)和图8(B)中可以看出外泌体成功的被吸附在TiO2微球的表面,透射电镜下被吸附的外泌体呈球形或扁球状,膜状结构明显。然后使用10% NH3·H2O作为洗脱液洗脱外泌体,溶液进行一系列前处理后进行透射电镜表征(图8(C)),可以观察到粒径约80~100 nm、呈球形或扁球形、单分散的外泌体,且膜结构完整。采用纳米粒度及Zeta电位分析仪(LitesizerTM 500)对外泌体的粒径分布进行表征,结果图8(D)所示,外泌体粒径分布约为80~280 nm左右。
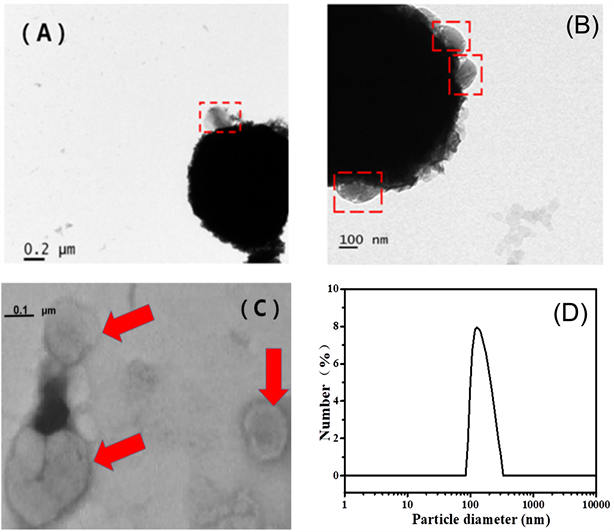
Figure 8. TEM image of (A, B) Exosome adsorbed on the surface of TiO2 and (C) Single exosome; (D) DLS of exosome
图8. (A、B)外泌体吸附在TiO2表面和(C)单独外泌体的TEM图;(D) 外泌体的动态光散射图
4. 总结
本文构建一种基于TiO2微球纯化外泌体的方法。利用溶剂热法制备TiO2微球,以EDTA作为包裹剂,并通过离心、过滤等方法筛选微球粒径,最后通过煅烧除去残留的有机物,提高微球结晶度,制得粒径均匀、分散性好、表面光滑的TiO2微球。通过差速离心的方法从人乳腺癌细胞(MDA-MB231细胞)分离出含杂蛋白的外泌体,利用二氧化钛与磷酸基团的亲和作用将TiO2微球与外泌体共同孵育,使外泌体与杂蛋白分离开来,最后利用10% NH3·H2O将外泌体从TiO2微球表面洗脱下来,达到纯化外泌体的目的。该方法分离外泌体具有特异性强、操作简单、成本低、快速高效等优点,进一步促进外泌体在医学检测领域中的应用。
致谢
感谢陈敬华教授和夏垚坤博士对外泌体相关实验提供的帮助。
基金项目
本项目研究由国家自然科学基金项目(51602053),福建医科大学大学生创新创业训练资助项目(C20142)资助。
NOTES
*第一作者。
#通讯作者。