1. 前言
河豚毒素(tetrodotoxin, TTX)作为豚毒鱼类体内含有的一种生物碱,是毒性很强的一种非蛋白生物毒素,是一种典型的选择性极高的快速可逆的钠离通道阻断剂,可阻止钠离子进入细胞从而影响细胞膜动作电位产生 [1] [2] [3] [4]。神经细胞之间通过释放神经递质进行信号传导与输出,诱发释放神经递质是在细胞去极化刺激条件下由大量囊泡释放的。通过给神经细胞一个电刺激,可以诱发神经细胞释放神经递质,产生eEPSC或者eIPSC [5] [6]。
实验中TTX常被使用于阻断钠离子通道,为了研究TTX在抑制阻断神经递质的诱发释放的两种不同电流中是否存在差异,以及探求TTX的最低完全阻断的工作浓度,本实验分别采用不同浓度的TTX作用于原代小鼠大脑皮层神经元细胞,记录不同浓度TTX存在下的eIPSC与eEPSC。实验结果显示,TTX对诱发的兴奋性突触前电流与突触后电流作用效果不同,半抑制浓度(IC50)前者远小于后者,即TTX对诱发的兴奋性突触后的神经递质释作用效果更明显;以及完全阻断钠离子通道的TTX工作浓度需大于0.2 μM。
2. 材料与方法
2.1. 材料
葡萄糖(Glucose)、乙二醇双四乙酸(EGTA)、4-羟乙基哌嗪乙磺酸(HEPES)、阿糖胞苷(Ara-C)、胰岛素(Insulin)、多聚-L-赖氨酸(Poly-L-lysine)、NaCl、CaCl2、MgCl2, CsCl、KCl、NaHCO3、Na2GTP、Na2ATP、平衡盐溶液(Hanks)均采购于Sigma公司;B-27、转铁蛋白(Transferrin,Gibco)、MEM (Gibco公司)、牛血清(FBS,Gibco公司)、胰蛋白酶(Gibco公司);印防己毒素(PTX,Tocris公司)、6-氰基-7-硝基喹喔啉-2,3-二酮(CNQX,Tocris公司)、利多卡因N-乙基溴(QX-314,Tocris公司);河豚毒素(TTX,上海玉博生物科技有限公司)。
2.2. 仪器
倒置显微镜,全自动膜片钳放大器系统,微电极拉制仪,CO2恒温细胞培养箱,超净工作台,高压灭菌锅分别购于奥林巴斯,HEKA,普升科技,世尔科技,Thermo,苏州Air Tech,上海博讯有限公司。
2.3. 方法
2.3.1. 实验溶液配制
配制神经元细胞培养基(2% B-27,0.5% Glucose,100 mg/L Transferrin,5% FBS和2 μM Ara-C);外液(140 mM NaCl, 5 mM KCl, 2 mM MgCl2, 2 mM CaCl2, 10 mM HEPES, 10 mM Glucose);电极内液(120 mM CsCl, 5 mM NaCl, 1 mM MgCl2, 10 mM HEPES, 10 mM EGTA, 3 mM Na-ATP, 0.3 mM Na-GTP);HBS解剖液(0.5 mM Hanks, 0.283 mM HEPES, 0.35 mM NaHCO3) [7] [8]。
2.3.2. 原代小鼠大脑皮层神经元细胞的获取与培养
取新生24小时内的野生型小鼠,将新生鼠消毒后放入超净工作台中,断头处死,分离出大脑皮层,放入提前预冷的HBS缓冲液中。将HBS缓冲液倒掉,加入1 mL 0.25%的胰酶,放入37℃培养箱中消化,倒计时12~13分钟,消化完成后将胰酶吸干净,加入3 mL plating溶液,清洗三遍防止胰酶残留,加入2 mL plating溶液轻轻吹打8~12次,将细胞吹散。接下来用70 µm的细胞筛滤去组织块,加入一定体积的plating溶液定容(按一只老鼠种植12个孔的比例定容),上下颠倒混匀后每个孔加入1 mL细胞悬浮液。最后将细胞悬液滴于玻片上进行培养。培养的第一天换上无Ara-C培养基,在培养的第四天和第九天换上含4 μM的Ara-C培养基,培养13~14天至细胞成熟后进行电生理实验记录 [9]。
2.3.3. 全细胞膜片钳实验
拉制硼硅酸玻璃管电极,电阻约为3~5 MΩ。钳制电压设定为−70 mV [10],在浴槽中加入2~3 mL外液,地线接入浴槽中,在显微镜下挑选一个状态良好的神经元细胞,调至视野中央,使用双极胞外刺激电极对其进行全细胞膜片钳实验 [11],选择全细胞电压钳模式记录。记录eIPSC时在外液中加入20 μM AMPA-受体阻断剂CNQX及50 μM NMDA-受体阻断剂APV阻断其他电流,实验时在外液中分别加入0 μM,0.0008 μM,0.0016 μM,0.008 μM,0.04 μM,0.2 μM,1 μM的TTX阻断通道。记录eEPSC时,在外液中加入100 μM GABA-受体阻断剂PTX和50 mM NMDA-受体阻断剂APV用于阻断其他电流,同时在电极内液中加入5 mM的QX-314以阻断Na+通道,以消除细胞发放动作电位的干扰,其余实验操作与上述相同。
2.4. 数据处理
数据用HEKA EPC10记录完成后,然后通过软件Clampfit处理,统计幅值。再用Graphpad prism 7.00,Igor Pro完成分析。
3. 结果
3.1. 不同浓度TTX对神经元细胞eIPSC的阻断作用
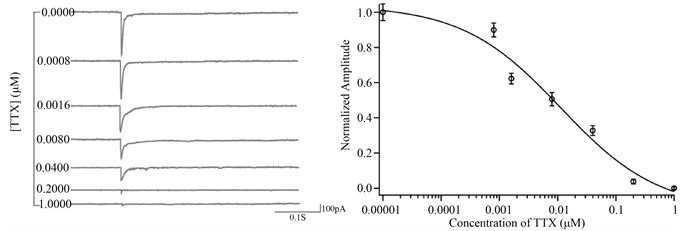
为探究TTX在阻断eIPSC的浓度效率如何,使用成熟(培养13~14天)的新生鼠大脑皮层神经元细胞,电生理实验记录两种细胞突触后电流,分别重复3次独立实验,分析处理所得的实验数据。结果如下图1所示,外液中加入CNQX和APV,且内液中含有QX-314的条件下,分别加入0 μM,0.0008 μM,0.0016 μM,0.008 μM,0.04 μM,0.2 μM,1 μM的TTX,随着TTX的浓度增高,记录到的eIPSC幅值降低,使用Hill方程拟合记录到的各TTX浓度下的eIPSC幅值归一化后的数据,得到IC50为0.030055 μM。图1的结果说明,TTX能有效抑制阻断eIPSC,在TTX 0.2 μM的浓度下几乎可以阻断全部的eIPSC,因此在使用TTX阻断钠离子通道时,有效的工作浓度选择应在0.2 μM以上。
 (a) (b)
(a) (b)
Figure 1. The efficiency of TTX at different concentrations to block eIPSC in cerebral cortex neurons. (a) When the concentration of TTX is 0 μM, 0.0008 μM, 0.0016 μM, 0.008 μM, 0.04 μM, 0.2 μM, 1 μM, the surface curve of eIPSC generation of cerebrum cortex was recorded. (b) It is recorded in (a) that the normalized value of each piece is fitted by Hill equation, and the curve is tested for four times alone. The total sample size of each concentration group is 11~15
图1. 不同浓度TTX阻断大脑皮层神经细胞eIPSC的效率。(a) 在TTX浓度为0 μM,0.0008 μM,0.0016 μM,0.008 μM,0.04 μM,0.2 μM,1 μM时,记录大脑皮层神经细胞eIPSC代表曲线;(b) (a)中记录到各条件数据归一化的值用Hill方程拟合后的曲线,四次独立实验,每个浓度组总样本量为11~15个
3.2. 不同浓度TTX对神经元细胞eEPSC的阻断作用
同样的,为探究不同浓度TTX对eEPSC阻断作用,重复上述实验,使用培养13~14天的小鼠大脑皮层神经元,内液中加入QX-314,且在外液中加入PTX和APV时,分别加入0 μM,0.0008 μM,0.0016 μM,0.008 μM,0.04 μM,0.2 μM,1 μM的TTX,记录eEPSC。结果与eIPSC组相似,伴随着TTX浓度的升高,记录到的eEPSC幅值随之降低。通过Hill方程进行拟合,将记录到的各TTX浓度下的eEPSC幅值归一化后做出拟合曲线,并求出IC50为0.011208 μM。结果如图2所示,在有TTX存在的情况下,随TTX浓度的增加eEPSC得到有效抑制,在TTX浓度为0.2 μM时,已能阻断极大部分的eEPSC,只有极小部分的电流有残余,由此可知,为完全抑制Na+通道电流,TTX的工作浓度应该选择高于0.2 μM的浓度。
 (a) (b)
(a) (b)
Figure 2. The efficiency of TTX at different concentrations to block eEPSC in cerebral cortex neurons. (a) When the concentration of TTX is 0 μM, 0.0008 μM, 0.0016 μM, 0.008 μM, 0.04 μM, 0.2 μM, 1 μM, the surface curve of eEPSC generation of cerebrum cortex was recorded. (b) It is recorded in (a) that the normalized value of each piece is fitted by Hill equation, and the curve is tested for four times alone. The total sample size of each concentration group is 11~15
图2. 不同浓度TTX阻断大脑皮层神经细胞eEPSC的效率。(a) 在TTX浓度为0 μM,0.0008 μM,0.0016 μM,0.008 μM,0.04 μM,0.2 μM,1 μM时,记录大脑皮层神经细胞eEPSC代表曲线;(b) Hill方程拟合(a)中记录到各条件数据归一化的值,四次独立实验,每个浓度组总样本量为11~15个
3.3. eEPSC比eIPSC对TTX的浓度变化更为敏感
IC50是指待测拮抗剂的半抑制浓度,它是衡量拮抗剂作用的一种方式,反映的是物质在抑制某些生物程序时所需的半量 [12]。将记录到的eIPSC组和eEPSC组的幅值进行归一化,所得值再通过Hill方程进行拟得到曲线如上图1,图2所示,获取该曲线的IC50。通过数据分析软件计算可得到eIPSC组和eEPSC组的TTX的半抑制浓度分别是0.030055 μM和0.011208 μM。可以看出eIPSC组的IC50值远大于eEPSC组,说明TTX作用于eEPSC所需的半抑制浓度低于eIPSC的半抑制浓度,这就意味着诱发神经信号释放兴奋性电流的机制对于TTX的浓度变化更为敏感。
4. 讨论
在神经细胞分泌神经递质这一过程中,钙离子起到了重要的作用,钙离子的浓度升高会促进神经递质的释放 [13] [14],突触后电流就是由于释放的神经递质与相应的突触后受体结合后产生的。神经细胞的突触后电流由兴奋性突触后电流EPSC和抑制性突触后电流IPSC两种成分组成。兴奋性氨基酸递质谷氨酸和天冬氨酸会引起EPSC,IPSC则与抑制性氨基酸递质γ-氨基丁酸有关 [15] [16]。
神经递质的释放又可以分为自发释放与诱发释放,两者的主要区别在于神经递质的释放是否需要动作电位的触发,诱发释放是需要动作电位的触发的,而自发释放不需要 [17]。
本实验将关注点侧重于TTX抑制阻断eIPSC与eEPSC是否有区别以及不同浓度对于两者之间的影响趋势。
本实验通过使用大脑皮层神经元细胞在不同浓度TTX存在的条件下进行电生理实验来验证,可以从最后的实验结果中发现,随着TTX浓度的增加,它对诱发的突触后电流的抑制作用逐步增强,呈现出一种浓度依赖性关系。将eIPSC组与eEPSC组相比较,eEPSC组的IC50明显大于eIPSC组,这意味着诱发的突触后兴奋性神经递质的释放会对TTX的浓度变化更为敏感。
突触传递是一种突触前膜释放兴奋性或抑制性递质引起突触后膜产生兴奋性突触后电位或抑制性突触后电位的过程。至今尚未发现兴奋性突触与抑制性突触在精细结构上的特征性区别 [18],因此eEPSC比eIPSC对TTX的浓度变化更为敏感大概率不会是因为受突触结构的影响。突触前膜释放兴奋性递质,作用突触后膜上的受体,引起细胞膜对Na+、K+等离子的通透性,主要是Na+通透性增加,因而Na+内流,出现局部去极化电位产生EPSC。可以推测eEPSC对于河豚毒素浓度变化更敏感或许是TTX直接特异性作用于Na+通道的原因,eEPSC的出现必须有Na+内流这一行为发生,TTX阻断Na+通道以至于eEPSC直接无法产生;而IPSC是突触前膜释放抑制性递质,导致突触后膜主要对Cl−通透性增加,Cl−内流产生局部超极化电位,此外IPSC的形成也可能与突触后膜K+通道的开放或Na+、Ca2+通道的关闭有关。所以eIPSC的产生主要是通过改变突触后膜上Cl-通道的通透性,TTX能够特异性得作用于Na+通道,对K+、Ca2+等其它离子通道却无直接影响 [19],因此它对eIPSC的作用并不是影响主要通路Cl−通道,这是一种间接性的旁路影响行为,因此在作用效率上eEPSC组会更高。至于TTX对于不同类型的神经递质是否会有不同的作用,例如兴奋性递质的释放效率在受到TTX的影响,更快得作用于突触后的受体,或是在TTX影响下突触后受体与兴奋性递质结合速度比抑制性递质更快都还尚未可知,仍需要进一步的研究进行探讨论证。
作为一种强效特异性的Na+通道阻断剂,TTX具有活性极高,使用剂量极低的特点 [20],因此,探求阻断钠离子通道电流的最低有效的TTX工作浓度也显示出一定重要性,从本实验的结果也可以看出,0.2 μM是TTX在细胞层面上的一个浓度节点,实验中至少要使用高于0.2 μM的TTX,突触后电流才能被完全阻断。已有的研究结果中,河豚毒素处理实验已明确的工作浓度是0.5 μM或1 μM [3] [4],是远高于本实验结论0.2 μM的,这些浓度都可以完全抑制Na+通道信号的产生。在Na+通道电流对实验影响较大时选择较高浓度例如0.5 μM或1 μM的TTX进行实验,以尽可能排除其干扰;而在进行一些Na+通道电流对实验影响因素较小但仍需要阻断其信号时,或者实验对Na+通道信号的抑制条件并不苛刻之时选择0.2 μM浓度的TTX可节约实验成本;或是在实验细胞对于TTX毒性较为敏感时,选取较低的工作浓度来抑制Na+通道可以在维持细胞充分活性时完成对Na+通道的阻断。
综上所述,河豚毒素对不同类型的突触后电流影响不同,且诱发的兴奋性突触后电流对河豚毒素浓度变化更敏感。
基金项目
湖北省自然科学基金(2020CFA025)、中南民族大学科学基金引进人才科研启动基金自科项目 (ZZ13002)。
NOTES
*通讯作者。