摘要:
建立NaNO2-Al(NO3)3-NaOH比色法,测定乳苣不同部位及其全草总黄酮含量。一定量样品液加5% NaNO2溶液2.00 ml,摇匀,放置6 min,10% Al(NO3)3溶液2.00 ml,摇匀,放置6 min,加4% NaOH溶液12.00 ml,蒸馏水定容至刻度,摇匀,静置15 min,于522 nm下测定吸光度,黄酮含量在0.0080~0.0720 mg/ml范围内与吸光度具有良好的线性关系。精密度和稳定性试验RSD分别为1.5%和2.9%,平均回收率93.61%,有较好的的精密度和准确度。本试验测得乳苣根、茎、叶及全草总黄酮提取率依次为:叶(105.4 mg/g) > 全草(77.63 mg/g) > 茎(12.60 mg/g) > 根(11.64 mg/g),由此可知乳苣总黄酮主要集中在地上部分。
Abstract:
A NaNO2-Al(NO3)3-NaOH colorimetric method was established to
determine the total flavonoids content in different parts of Mulgedium
tataricum L and its whole grass. A certain amount of sample solution was added
with 2.00 ml of 5% NaNO2 solution, shaken, and placed for 6 minutes,
added with 12.00 ml of 4% NaOH solution, and
distilled water to determine Volume up to the mark, shake well, stand for 15
min, measure the absorbance at 522 nm, the flavonoid content in the range of
0.0080~0.0720 mg/ml has a good linear relationship with the absorbance.
The RSD of the precision and stability tests were 1.5% and 2.9%,
respectively, and the average recovery rate was 93.61%, with good precision and
accuracy. In this experiment, the extraction rate of total flavonoids from the
roots, stems, leaves, and whole plants of Nicotiana officinalis was as follows:
leaves (105.4 mg/g) > whole plants (77.63 mg/g) > stems (12.60 mg/g) >
roots (11.64 mg/g), it can be seen that the total flavonoids of Mulgedium tataricum L. are mainly
concentrated in the above-ground part.
1. 引言
乳苣(Mulgedium tataricum L.),又名紫花山莴苣、苦菜等,为菊科(Compositae)苦苣菜属(Sonchus)植物,我国新疆、甘肃、陕西、内蒙古等均有分布,资源丰富 [1]。乳苣全草可入药,有消炎、止痛、抗菌、抗氧化、抗肿瘤等功效,是一种药食同源的多年生草本植物。
乳苣主要成分为黄酮类 [2]、多酚 [3]、萜类 [4]、多糖、多种氨基酸等。黄酮类化合物可清除自由基、超氧化物,因而具有抗氧化、抗衰老作用 [5];另外还有抗心脑血管疾病、抗病毒、抗癌 [6]、抗菌 [7]、抗糖尿病,调节血脂等作用。国内外关于乳苣的研究主要集中在其化学成分的提取、富集纯化及活性方面,有少部分研究了乳苣氨基酸含量的动态变化 [8],对乳苣黄酮含量测定具体方法及乳苣不同部位总黄酮的含量测定未见相关报道。天然产物中黄酮含量测定方法有很多,如紫外分光光度法直接法、比色法、薄层扫描法、高效液相色谱法、荧光光度法、超临界流体色谱法、毛细管电泳法等 [9] - [16],比色法由于其方法简便、快速,使用仪器简单、便于推广应用等特点,常用于天然产物中黄酮含量测定。
本实验采取乙醇回流提取法提取乳苣根、茎、叶及全草总黄酮,石油醚萃取,以芦丁作对照品,用紫外可见分光光度计,建立NaNO2-Al(NO3)3-NaOH比色法测定乳苣不同部位总黄酮的含量,为乳苣的药用部位和资源合理利用提供依据。
2. 仪器与试剂
2.1. 仪器
紫外可见分光光度计(UV1801G,天津冠泽科技有限公司)、电子天平(LE204E,梅特勒–托利多仪器(上海)有限公司)、旋转蒸发仪(N-1300,上海爱朗仪器有限公司)、电热恒温水浴锅(DK-98-Ⅱ,天津市泰斯特仪器有限公司)、电热鼓风干燥箱(BGZ-140,上海博迅实业有限公司医疗设备厂)、中草药粉碎机(FW135,天津市泰斯特仪器有限公司)、尼龙筛(40目)。
2.2. 药品与试剂
乳苣(采自新疆医科大学厚博学院院内);芦丁(纯度:HPLC ≥ 98%,北京索莱宝科技有限公司、亚硝酸钠(分析纯,天津市盛奥化学试剂有限公司)、硝酸铝(分析纯,天津市盛奥化学试剂有限公司)、氢氧化钠(分析纯,天津市盛奥化学试剂有限公司)、石油醚(分析纯,天津市富宇精细化工有限公司)、无水乙醇(分析纯,天津永晟精细化工有限公司)。
3. 方法与结果
3.1. 乳苣不同部位提取液的制备
取新鲜乳苣全草洗净,根、茎、叶分离,分别阴干,备用。实验前,根、茎、叶、全草分别粉碎,过40目筛。分别称取乳苣根、茎、叶及全草粉末各10.0025 g、10.0003 g、10.0005 g、10.0025 g,置500 ml圆底烧瓶中,加30倍70%乙醇,90℃水浴回流2 h,抽滤,滤渣加30倍70%乙醇重复提取2次,合并3次滤液,减压浓缩至干,加蒸馏水溶解并定容至100 ml,石油醚萃取至醚层无色,取下层溶液浓缩至干,70%乙醇复溶并定容至100 ml,摇匀,得乳苣不同部位总黄酮提取液,备用。
3.2. 芦丁对照品溶液配制
称取于120℃下干燥至恒重的芦丁对照品0.0200 g,置100 ml量瓶中,70%乙醇溶解并定容至刻度,摇匀,备用(C = 0.2000 mg/ml)。
3.3. 乳苣总黄酮含量测定条件筛选
3.3.1. 最佳波长的选择
分别精密移取蒸馏水、芦丁对照品溶液和以70%乙醇准确稀释100倍的乳苣全草总黄酮提取液各5.00 ml,置25 ml量瓶中,依次加5% NaNO2溶液3.00 ml,摇匀,放置6 min,10% Al(NO3)3溶液1.50 ml,摇匀,放置6 min,加4% NaOH溶液8.00 ml,蒸馏水定容至刻度,摇匀,静置15 min,用紫外可见分光光度计,在350~700 nm范围内进行全波长扫描(图1、图2)。由图可知:芦丁对照品溶液和乳苣全草提取液均在522 nm处有较强吸收,因此确定最佳检测波长为522 nm。
Figure 1. Full-wavelength scan of rutin reference solution
图1. 芦丁对照品溶液全波长扫描图

Figure 2. Full-wavelength scan of the whole extract of Mulgedium tataricum L.
图2. 乳苣全草提取液全波长扫描图
3.3.2. 显色剂用量考察
移取3.00 ml乳苣全草提取液,置100 ml量瓶中,加70%乙醇定容至刻度,摇匀,分别移取3.00 ml置5个25 ml量瓶中,依次考察5% NaNO2溶液(1.50、2.00、2.50、3.00、3.50 ml),10% Al(NO3)3溶液(1.00、1.50、2.00、2.50、3.00 ml),4% NaOH溶液(6.00、8.00、10.00、12.00、14.00 ml)用量(图3~5)。结果5% NaNO2溶液、10% Al(NO3)3溶液、4% NaOH溶液最佳用量分别为2 ml、2 ml、12 ml。
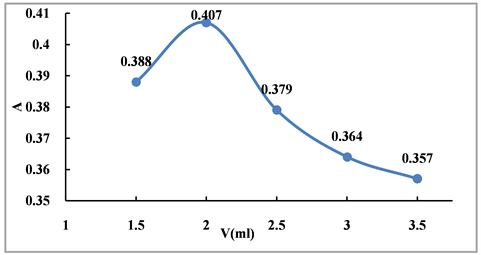
Figure 3. Investigation on the dosage of 5% NaNO2 solution
图3. 5% NaNO2溶液用量考察

Figure 4. Investigation on the dosage of 10% Al(NO3)3 solution
图4. 10% Al(NO3)3溶液用量考察

Figure 5. Investigation on the dosage of 4% NaOH solution
图5. 4% NaOH溶液用量考察
3.4. 标准曲线绘制
分别移取芦丁对照品溶液0.00 ml、1.00 ml、3.00 ml、5.00 ml、7.00 ml和9.00 ml置25 ml量瓶中,依次加5% NaNO2溶液2.00 ml,摇匀,放置6 min,10% Al(NO3)3溶液2.00 ml,摇匀,放置6 min,加4% NaOH溶液12.00 ml,蒸馏水定容至刻度,摇匀,静置15 min,于522 nm下测定吸光度,以系列芦丁对照品溶液浓度(C)为横坐标,以吸光度(A)为纵坐标绘制标准曲线(图6),得线性回归方程y = 11.075x − 0.005 (R2 = 0.9989),说明芦丁对照品溶液在0.0080~0.0720 mg/ml范围内线性关系良好。

Figure 6. Standard curve of series concentration rutin reference substance
图6. 系列浓度芦丁对照品标准曲线
3.5. 分析方法的评价
3.5.1. 精密度考察
移取3.00 ml乳苣全草提取液,置100 ml量瓶中,加70%乙醇定容至刻度,摇匀,分别移取3.00 ml置6个25 ml量瓶中,依次加5% NaNO2溶液2.00 ml,摇匀,放置6 min,10% Al(NO3)3溶液2.00 ml,摇匀,放置6 min,加4% NaOH溶液12.00 ml,蒸馏水定容至刻度,摇匀,静置15 min,于522 nm下测定吸光度,求RSD值,如表1所示,精密度RSD值为1.5%,表明本实验具有较高精密度。
3.5.2. 稳定性考察
移取3.00 ml乳苣全草提取液,置100 ml量瓶中,加70%乙醇定容至刻度,摇匀,移取3.00 ml置25 ml量瓶中,依次加5% NaNO2溶液2.00 ml,摇匀,放置6 min,10% Al(NO3)3溶液2.00 ml,摇匀,放置6 min,加4% NaOH溶液12.00 ml,蒸馏水定容至刻度,摇匀,静置0 min,15 min,30 min,45 min,60 min时分别于522nm下测定吸光度,RSD为2.9% (n=5),说明显色后溶液在60 min内基本稳定。如表2所示,30分钟以内随时间延长,吸光度略有减小,RSD为0.41% (n=3),表明反应液在30min内比较稳定,30~45min吸光度减小幅度较大,45~60min吸光度值又趋于稳定。

Table 2. Stability investigation results
表2. 稳定性考察结果
3.5.3. 加标回收率考察
移取3.00 ml乳苣全草提取液,置100 ml量瓶中,加70%乙醇定容至刻度,摇匀,分别移取3.00 ml置7个25 ml量瓶中,1~6号瓶加芦丁对照品溶液4.25 ml,依次加5% NaNO2溶液2.00 ml,摇匀,放置6 min,10% Al(NO3)3溶液2.00 ml,摇匀,放置6 min,加4% NaOH溶液12.00 ml,蒸馏水定容至刻度,摇匀,静置15 min,于522nm下测定吸光度,以加标测得量减原样测得量,除以加标量计算回收率,如表3所示,加标回收率为93.61%,RSD为2.9%,符合要求。

Table 3. Inspection results of standard addition recovery rate
表3. 加标回收率考察结果
3.6. 乳苣不同部位及全草的含量测定
移取1.00 ml根和茎提取液、0.10 ml叶和全草样品溶液,分别置25 ml量瓶中,依次加5% NaNO2溶液2.00 ml,摇匀,放置6 min,10% Al(NO3)3溶液2.00 ml,摇匀,放置6 min,加4% NaOH溶液12.00 ml,蒸馏水定容至刻度,摇匀,静置15 min,于522nm下测定吸光度,按公式1计算,如表4所示,得乳苣根、茎、叶、全草中总黄酮提取率依次为11.64 mg/g、12.60 mg/g、105.4 mg/g、77.63 mg/g。
公式1

Table 4. Content determination of Mulgedium tataricum L. root, stem, leaf and whole plant
表4. 乳苣根、茎、叶和全草的含量测定
4. 讨论
本试验对NaNO2-Al(NO3)3-NaOH比色法测定乳苣黄酮的含量方法进行考察,获得较优测定条件为一定量样品液加5% NaNO2溶液2.00 ml,摇匀,放置6 min,10% Al(NO3)3溶液2.00 ml,摇匀,放置6 min,加4% NaOH溶液12.00 ml,蒸馏水定容至刻度,摇匀,静置15 min,于522 nm下测定吸光度,黄酮含量在0.0080~0.0720 mg/ml范围内与吸光度具有良好的线性关系。精密度和稳定性试验RSD分别为1.5%和2.9%,平均回收率93.61%,由此可见,本试验对NaNO2-Al(NO3)3-NaOH比色法测定条件进行改进后,使该法具有精密度高、操作简单、灵敏度高、稳定性好等优点,适用于乳苣黄酮含量的测定。
本试验测得乳苣根、茎、叶及全草总黄酮提取率依次为:叶(105.4 mg/g) > 全草(77.63 mg/g) > 茎(12.60 mg/g) > 根(11.64 mg/g),由此可知乳苣总黄酮主要集中在地上部分。文献报道,乳苣总黄酮含量与其生长的地理位置、地质条件、环境气候及采收季节等有关,3~4月总黄酮含量逐渐升高,5月之后总黄酮含量则逐渐下降 [17],本试验所用乳苣采于8~9月,因此测得的根、茎含量可能相对较低。
基金项目
克拉玛依市创新环境建设(创新人才)项目(2020CXRC0066)资助。
NOTES
*通讯作者。