1. 前言
前列腺癌是男性泌尿生殖系统最为常见的恶性肿瘤之一,而前列腺黏液肿瘤(mucinous tumors of prostate)是一类较为罕见的前列腺肿瘤亚型的集合。由于前列腺黏液肿瘤总体发病率低,其恶性程度及临床治疗策略存在一定争议并缺乏统一标准,阻碍了我们对其临床危险因素和预后的理解。本研究总结我院7例前列腺黏液肿瘤患者的临床特征及病理学特点(本研究已获得患者及家属的知情同意和伦理许可),并分析近20年相关文献,讨论这类罕见疾病的临床特点、诊断、病理特征以及治疗和预后,旨在提高对于前列腺黏液肿瘤的认知,明确治疗策略。
2. 原发性前列腺黏液肿瘤
2.1. 前列腺黏液腺癌
例1:患者66岁,因“确诊前列腺癌5月”于2020-04-13入院,患者5月前查体发现PSA高达45.810 ng/ml (正常值0~4 ng/mL),于外院行前列腺穿刺活检示:前列腺癌,全身骨显像示骨转移瘤征象,遂给予前列腺肿瘤新辅助治疗(亮丙瑞林1支,皮下注射1次/月;比卡鲁胺片口服1片/日);药物治疗期间,患者诉既往尿频、尿不净症状缓解;既往肝癌术后5年,乙型肝炎病史10年。入院PSA:0.181 ng/ml,前列腺MR示:前列腺左侧外周带异常信号,符合前列腺癌表现;双侧髂骨、左侧坐骨转移瘤可能性大;双侧髂血管区淋巴结轻度肿大(图1)。遂行机器人辅助腹腔镜下前列腺癌根治术 + 盆腔淋巴结切除术,术后病理示:前列腺黏液腺癌,Gleason评分:4 + 5 = 9分,5组,肿瘤于前列腺内多灶浸润生长,未累及前列腺被膜,未累及尖切缘、底切缘、双侧精囊腺及双侧输精管断端;未见确切神经侵犯及脉管癌栓;左盆腔(0/6)及右盆腔(0/7)淋巴结内未见癌转移(图2~4)。免疫组化结果:CK7(−),CK20(−),P504S(+),MUC5AC(−),P63及CK34βE12示基底细胞缺失,PSA少数(+) (图5)。术后随访4月,患者未出现生化复发。

Figure 1. MR image of patient 1: Patchy long T1 short T2 signal shadow was observed in the left peripheral band, and high signal shadow was observed in DWI, with unclear demarcation from the left central band
图1. 例1患者MR图像:左侧外周带见斑片样长T1短T2信号影,DWI呈高信号影,与左侧中央带分界不清

Figure 2. Pathological images of patient 1 (HE, 5.0×) showed adenoid, cribriform or cord-like tumor cells floating in the mucous lake with obvious “cherry red” nucleoli
图2. 例1患者病理图片(HE, 5.0×)示:腺样、筛状或条索状的肿瘤细胞漂浮在黏液湖中,具有明显的“樱桃红”核仁

Figure 3. Pathological images of patient 1 (HE, 20.0×) showed adenoid, cribriform or cord-like tumor cells floating in the mucous lake with obvious “cherry red” nucleoli
图3. 例1患者病理图片(HE, 20.0×)示:腺样、筛状或条索状的肿瘤细胞漂浮在黏液湖中,具有明显的“樱桃红”核仁

Figure 4. Pathological images of patient 1 (IHC 20.0×) showed positive P504S tumor cells, negative P63 and 34βE12 suggesting basal cell loss
图4. 例1患者病理图片(IHC三染20.0×)示:肿瘤细胞P504S阳性,P63、34βE12阴性提示基底细胞缺失

Figure 5. IHC images of patient 1 (IHC 20.0×) showed partial positive PSA
图5. 例1患者免疫组化(IHC三染20.0×)示:PSA部分阳性
前列腺黏液腺癌(mucinous adenocarcinoma of the prostate)是前列腺癌中最少见的形态学类型之一,其发病率仅占前列腺癌的0.2%~0.5% [1]。早期前列腺黏液腺癌通常没有显著症状,若肿瘤侵犯尿路、膀胱颈口时,会发生下尿路梗阻、刺激症状,部分患者可出现血尿 [2] (表1)。本组统计20例前列腺黏液腺癌患者,年龄(67.75 ± 7.261)岁(56~82岁),中位PSA为3.20 ng/ml,其中10例(10/20)行根治性前列腺切除术。
前列腺黏液腺癌可根据血清PSA水平、前列腺MR进行初步诊断,在影像学检查方面,各种形式的磁共振成像(MRI)广泛用于前列腺癌的诊断,但有研究表明,在MRI检查中,前列腺黏液腺癌很难与经典型前列腺癌区分开来 [19],所以其确诊仍依靠病理学及免疫组化特征。
前列腺黏液腺癌的病理学特点是肿瘤细胞产生丰富的黏液,显微镜下可见细胞外由大量黏液构成的黏液湖,不规则的筛状、条索状或腺泡状癌细胞漂浮在黏液湖中,肿瘤细胞类似经典的前列腺腺泡腺癌,具有明显的“樱桃红”核仁,胞浆嗜双色性,肿瘤性腺体周围缺乏基底细胞,周围可伴有经典型前列腺腺泡腺癌 [6],其确诊依据为:① 腺样、筛状或条索状的肿瘤细胞漂浮于周围黏液所形成的黏液湖中;② 前列腺黏液腺癌多与经典型的腺泡腺癌并存,且在切除的肿瘤中,黏液成分至少占到肿瘤的25%;③ 排除其它类型的黏液性肿瘤 [5] [6] [20]。满足以上三点可诊断为前列腺黏液腺癌,但需要注意的是,由于需要判断瘤体和黏液成分比例,前列腺黏液腺癌的诊断只能在根治性前列腺切除术后的标本中做出,而在前列腺穿刺及TURP术后标本中存在的带腔外黏液的前列腺腺癌,应诊断为“具有黏液性特征的前列腺癌” [20] [21]。此外,先前的研究对于是否应该赋予前列腺黏液腺癌Gleason评分系统及是否应该给予更高的Gleason评分尚存争议,2014国际泌尿病理学会ISUP统一明确了前列腺黏液腺癌可用Gleason评分进行分级,目前病理学家认为前列腺黏液腺癌的分级应基于其潜在的生长方式,忽略其黏液成分,按照肿瘤结构进行分级,而不是将其全部分级为Gleason4级 [22]。

Table 1. Clinical features of mucinous adenocarcinoma of the prostate
表1. 前列腺黏液腺癌的临床特点
前列腺黏液腺癌中分泌的大量细胞外黏蛋白可能会产生边缘性基质反应,称为黏液性纤维增生(也称为微胶原结节),由嗜酸性、细纤维状、疏松的球形聚集体组成,紧邻腺上皮 [23]。在前列腺腺癌中黏液性纤维增生很少见,而相对于典型的前列腺腺癌,前列腺黏液腺癌中黏液性纤维增生出现的概率更大,Osunkoya等人 [24] 在47例前列腺黏液性腺癌中的30例(64%)观察到了黏液性纤维增生,并推测其可能与癌症进展有关。
免疫组化是确诊前列腺黏液腺癌的重要诊断依据,我们统计了相关数据(表2),提示前列腺黏液腺癌免疫组化中PSA呈阳性(7/9),PSAP和P504s (3/9)可阳性,CDX2、CEA、CA125、34βE12阴性,CK7、CK19、CK20呈可变表达,AB或PAS黏液染色可显示黏液主要位于细胞外 [5] [6] [8] [9] [10] [15]。例1患者免疫组化特征为:CK7(−),CK20(−),P504S(+),MUC5AC(−),P63及CK34βE12示基底细胞缺失,PSA少数(+),与报道大体一致。另外,研究发现杯状细胞标志物黏蛋白2 (MUC2)在前列腺黏液腺癌中呈现高表达,其导致的黏液分化可与基质形成牢固结合,并且MUC2与黏液癌相关的细胞外黏液可积聚在基质中围绕肿瘤细胞,以上两点干扰了肿瘤细胞的扩散能力,可能会抑制肿瘤的生长,具有重要的病理和预后意义 [25]。MUC2高度表达在其他器官(如胰腺,乳腺,皮肤和卵巢)的黏液腺癌中也有报道,因此不同器官的黏液腺癌可能存在共同的基因改变 [26]。Mucino对25例前列腺黏液腺癌和25例经典型前列腺癌进行了对比,发现所有前列腺黏液腺癌病例均为MUC2阳性,而25例经典型前列腺癌中表达MUC2的只有6例 [25]。抑癌基因磷酸酶-张力蛋白基因(PTEN)在侵袭性高级别前列腺癌中常发生表达缺失,其与不良预后和高侵袭性有关,而在前列腺黏液腺癌中PTEN高表达,提示前列腺黏液腺癌可能比没有相关黏液成分的经典型前列腺腺癌具有更低的侵袭性 [27]。因此,MUC2及PTEN高表达,对诊断前列腺黏液腺癌也具有重要意义。

Table 2. Immunohistochemical characteristics of mucinous adenocarcinoma of the prostate
表2. 前列腺黏液腺癌的免疫组化特点
在先前的研究中,由于病理学及免疫组化技术尚不完善,将前列腺黏液腺癌与前列腺印戎细胞癌、含印戎细胞的黏液癌相混淆,产生了前列腺黏液腺癌恶性程度高、预后较差、容易转移且对内分泌治疗不敏感的结论,而近年来二者已不再共同研究 [28]。相反的是,最近的研究表明,前列腺黏液腺癌与前列腺腺癌预后相似,在Lane等人的研究中,他们分析了14例黏液性前列腺癌患者的临床病理和预后特征,平均随访时间为6.4年,前列腺黏液腺癌患者中没有出现死亡病例,其中11/12 (91.7%)患者未出现生化复发,提示前列腺黏液腺癌患者与匹配组的经典型前列腺癌患者在总生存率或生化复发方面无显著差异,表明前列腺黏液腺癌并不会带来不良的预后 [29]。同样,在Osunkoya等人的研究中,经根治性前列腺切除治疗的黏液性前列腺癌患者的分级和分期比常规前列腺癌患者的预后更好 [25]。
在远处转移方面,骨是该病最常见的转移部位,其次是淋巴结和肺,所以该病患者应常规行胸部CT、全身骨扫描等相关检查,判断其是否有远处转移 [25]。
在鉴别诊断方面,前列腺黏液腺癌应该与前列腺印戎细胞癌、含印戎细胞的黏液癌区分开来。研究表明,该病黏液成分的比例与预后无关,而印戒细胞是具有强侵袭性的表现,其易于穿透相邻组织,导致广泛的侵袭和转移,所以印戒细胞是后两者具有高侵袭性、预后差的标志,其3年生存率仅为27.3% [25] [30]。同时,含印戒细胞的黏液性癌对内分泌治疗不敏感,Saito等报告了28例含有印戎细胞的前列腺癌,均对内分泌治疗无反应 [30]。
治疗方面,作为最常用的对于非转移性前列腺黏液腺癌的治疗方式,早期行根治性前列腺切除术可改善患者生存期,提高预后,仍是该病首选治疗方法,而高龄和高等级的Gleason评分与较差的生存率有关 [23]。在内分泌治疗方面,有研究显示前列腺黏液腺癌较为敏感,而疗效可能因肿瘤分级而异,Saito等研究表明内分泌治疗有效反应率为77.8% [30]。Nagakura等人报道了一例手术去势成功治疗前列腺黏液腺癌的患者 [31]。由于总体数据较少,内分泌治疗该病疗效及预后仍缺乏大量研究。
另外,近年来免疫治疗在肿瘤治疗方面取得了突破性的进展,而高频微卫星不稳定性(MSI-H)是免疫治疗获益的正相关标志物,Wullich B报道了一例前列腺黏液腺癌的高频微卫星不稳定性(MSI-H) [17],因此,前列腺黏液腺癌在遗传上可能具有变异性,其能否从免疫治疗中获益,仍需要大量研究证实。
2.2. 具有黏液性特征的前列腺癌
例2:患者71岁,2018-11-27因排尿困难3月,加重5天入院,患者3月前无明显诱因出现排尿困难,无尿频,夜尿约1~2次,后段尿尿痛,尿道有烧灼感,有间歇性肉眼血尿。既往:胃根治术后40年。其余无明显阳性体征。入院PSA:55.050 ng/ml,前列腺MR示:前列腺增大,横径约57 mm,中央带及周围带分界不清,其内信号不均匀,可见局限性DWI高信号影,边界不清(图6)。遂在超声引导下行前列腺穿刺活检,术后病理示:具有黏液性特征的前列腺癌(Gleason评分:4 + 4 = 8分,WHO/ISUP分级分组:4组),免疫组化结果:CK7(−),CK20(−),CDX-2(+/−),SATB2(−),Villin(−),P63和CK(34βE12)示基底细胞缺失,P504S(+),PSA弱(+),Ki-67约40%(+)。后行比卡鲁胺+抑那通治疗1年后,PSA降至0.088 ng/ml,随访2年未出现复发。
例3:患者49岁,2019-03-12因查体发现PSA升高3天入院,平日无明显症状,既往无特殊病史。入院PSA:78.160 ng/ml,在超声引导下行前列腺穿刺活检,术后病理示:具有黏液性特征的前列腺癌(Gleason评分:4 + 4 = 8分,4组) (图7),患者拒绝接受治疗出院后失访。
具有黏液性特征的前列腺腺癌(prostatic adenocarcinoma with mucinous features)报道较少,我们认为,其可定义为:① 肿瘤细胞与周围黏液共存;② 腺体和管腔外粘蛋白成分比例不固定;③ 排除其它来源的黏液性肿瘤;④ 在前列腺穿刺活检或TURP术后获得的标本中取得。因此,在尚未完全确定根治性前列腺切除术后标本中黏蛋白成分比例时,若出现具有黏液性质的前列腺癌,只能将其定义为具有黏液性特征的前列腺腺癌,而黏液性纤维化同样可以出现在具有黏液性特征的前列腺腺癌中 [20]。其镜下特点与前列腺黏液腺癌大体相似,可见细胞外由大量黏液构成的黏液湖,不同形状的癌细胞散发分布在黏液湖周围,周围可伴有一般类型的前列腺癌。与经典型前列腺癌相比,在免疫组化方面诸如PSA,PAP,PSMA,ERG,P501S,P504S,PTEN等在具有黏液性特征的前列腺腺癌中呈可变表达 [21] [23]。
治疗方面,根治性前列腺切除术仍是首选治疗,腹腔镜手术具有创伤小、易于恢复等特点,近年来已逐渐取代传统开放手术。机器人手术能提高手术精准度,减少术者操作失误,避免前列腺周围神经过多离断,极大降低了阳痿等术后并发症的出现,已逐渐成为新趋势 [32]。

Figure 6. The MR image of patient 2 showed unclear demarcation between the central band and surrounding band, uneven internal signal, and high signal shadow on localized DWI
图6. 例2患者MR图片,可见中央带及周围带分界不清,其内信号不均匀,可见局限性DWI高信号影
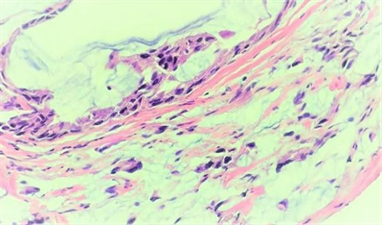
Figure 7. Pathological image of patient 3 (HE, 400.0×) showed adenoid and cordlike tumor cells with abundant mucus around
图7. 例3患者病理图片(HE,400.0×)示:肿瘤细胞腺样、条索状,周围见大量黏液
2.3. 前列腺尿道黏液腺癌(产粘蛋白的尿路上皮型前列腺腺癌)
前列腺尿道黏液腺癌又称产粘蛋白的尿路上皮型前列腺腺癌(mucinous adenocarcinoma of the prostatic urethra, mucin-producing urothelial-type adenocarcinoma of the prostate)是一种很罕见的恶性肿瘤,目前国内外文献报道较少。前列腺内尿道是前列腺的重要组成部分,其主要由尿路上皮覆盖,该部分尿路上皮可发生尿道上皮化生并伴有恶性转化,继而发生前列腺尿道黏液腺癌,所以该病并非源于前列腺的腺泡或导管 [33]。由于同为尿路上皮型癌,所以其与膀胱来源的黏液腺癌易混淆。
前列腺尿道黏液腺癌常无显著的临床表现,部分患者可伴有下尿路刺激症状(表3),而其特有的临床症状为黏液尿,表现为排尿后伴有黏液状物质,膀胱镜下前列腺部尿道中可见许多白色絮状物,极少数患者可在射精后出现明显缓解排尿困难的症状 [34]。由于原发于前列腺的尿道黏液腺癌临床表现缺乏特异性,且血清PSA常常无升高,影像学亦无特征性的表现,临床多误诊为BPH等良性前列腺疾病。

Table 3. Mucinous adenocarcinoma of the prostatic urethra
表3. 产黏蛋白的尿路上皮型前列腺癌
病理学方面,文献报道中的病例具有相似的组织学特点,其癌细胞呈腺状、筛状或立方状,伴有肿瘤细胞外大量黏液。在肿瘤细胞的排列方式上,除腺状及筛状结构最为多见外,可伴有其它的组织学结构,例如绒毛状腺瘤、局灶鳞状上皮化生、坏死、神经周围浸润和肉芽肿性炎性反应等 [21] [33]。但是对该病诊断有重要意义的病理学特点为前列腺部尿道的腺性化生及原位腺癌与黏液腺癌呈现移行过渡的表现,出现该特点可高度提示该病可能性 [33]。尽管前列腺尿道黏液腺癌是累及前列腺的腺癌,但病理学家认为不应该为其分配Gleason评分系统,因为其并非源于前列腺的导管或腺体。
免疫组化方面,我们统计了相关文献报道(表4),CK7阳性率为88.9% (8/9),CK20阳性率为77.8% (7/9),34βE12阳性率为66.7% (6/9),CEA阳性率为66.7% (6/9),均为强阳性表达,而所有病例PSA、PASP均为阴性表达,因此,在前列腺尿道黏液腺癌的诊断中,CK7、CK20、34βE12及CEA的阳性表达有助于证明其尿路上皮来源,而PSA及PASP 阴性则可排除传统的前列腺黏液腺癌的诊断。此外,CDX2通常为阴性,这有助于将其与消化道来源的黏液腺癌相鉴别 [23]。P504S是传统前列腺癌高度敏感和特异的标志物,其在前列腺黏液腺癌中呈阳性表达,而在尿路上皮癌中阴性表达,因此P504S阴性表达支持该肿瘤为尿路上皮来源,而不支持其为前列腺腺泡来源,有助于鉴别诊断 [35]。
前列腺尿道黏液腺癌与来源于膀胱和消化道的黏液腺癌在组织形态学上具有很大的相似性,肿瘤细胞均呈高柱状或立方状,排列成腺状或筛状,伴有大量的细胞外黏液湖形成。临床上可通过影像学检查、膀胱镜、消化系统内镜检查排除其膀胱或消化道来源,在此基础上结合免疫组化表达可做出正确诊断。前列腺尿道黏液腺癌的诊断及鉴别诊断较为困难,因此推荐病理充分取材,多处比较。
该肿瘤具有高侵袭性并且预后相对较差,杨静等 [33] 研究病例中随访期限从2个月到161个月,其中10例死亡,死亡率达50%,最短于术后两月死亡,死亡病例中有5例出现了疾病进展。该病骨转移并不常见,但更易发生盆腔的浸润及肝、肺等器官转移 [39]。治疗方面,内分泌治疗不是前列腺尿道黏液腺癌的治疗选择,该病患者可能需要行膀胱前列腺根治性切除术。但由于本病报道数量较少,其治疗及预后仍缺乏大宗数据支持。

Table 4. Immunohistochemical characteristics of mucinous adenocarcinoma of the prostatic urethra
表4. 前列腺尿道黏液腺癌免疫组化特点
3. 继发性前列腺黏液肿瘤
继发性前列腺黏液肿瘤世界范围内几无报道,根据其来源不同可分为膀胱来源的前列腺黏液肿瘤、消化道来源的前列腺黏液肿瘤和其他特殊器官来源的前列腺黏液肿瘤等,最常见的继发于邻近器官并扩散至前列腺的继发性肿瘤包括膀胱癌和直肠癌。本文中我们报道了4例继发性前列腺黏液肿瘤,旨在加强对继发性前列腺黏液肿瘤的认识,指导其临床治疗。
3.1. 膀胱来源的前列腺黏液肿瘤
例4:患者66岁,2020-06-08因确诊前列腺癌、膀胱癌3个月入院,患者3个月前因排尿困难就诊于外院,行手术治疗后病理提示:膀胱癌、前列腺癌,伴尿线变细、尿频、尿急,偶伴尿痛,夜尿约8次。既往高血压病史、吸烟史。入院后盆腔CT示:膀胱充盈不佳,壁增厚、边缘毛糙,前列腺未见明显增大,其内见多个点状高密度影(图8)。入院PSA:1.210 ng/ml,CEA (癌胚抗原):60.43 ng/ml,糖类抗原724:13.64 IU/ml。遂行腹腔镜下膀胱前列腺根治性切除术 + 盆腔淋巴结清扫术+输尿管皮肤造口术,术中见前列腺侵及直肠,加行直肠切除 + 乙状结肠造口术,术后大体标本示:膀胱大小8*7*5 cm,于膀胱三角区见黏液胶冻样区,范围4*2 cm,部分侵及前列腺组织,前列腺大小6*5*5 cm,切面灰白质韧,周围脂肪组织内未见特殊;直肠长8 cm,最大径2.4 cm,距一侧切缘4 cm、另一侧切缘11 cm见一粘膜切口,切口处粘膜光滑,其余粘膜皱襞粗糙,未见肿物,肠周脂肪组织部分区域质稍韧。病理示:(膀胱、前列腺)黏液腺癌(范围4*2 cm),肿瘤累及膀胱壁全层及前列腺组织,(直肠)肠周脂肪组织内见癌累及,未累及两侧手术切缘(图9)。送检左盆腔(2/4)及右盆腔(1/1)淋巴结内见癌累及,淋巴结周围脂肪脉管组织内见癌累及。免疫组化:CK7(−),CK20(+),GATA3(−),UroplakinII(−),Pax-8(−),p16(−),p53(−),CD31及D2-40示脉管癌栓(+),S100示神经侵犯(−),Ki-67(+,约70%),CDX-2(+),PD-L1-22C3(CPS: 0),β-Catenin (膜+),p63(−),ERG(−),P504S(−) (图10~13)。患者术后恢复良好,随访2月未出现复发及转移。

Figure 8. Pelvic CT of patient 4 showed multiple punctured high-density shadows in the prostate gland
图8. 例4患者盆腔CT示:前列腺内见多个点状高密度影

Figure 9. Pathologic image of patient 4 (HE, 10.0×) showed sig-ring appearance of tumor cells with abundant extracellular mucus around
图9. 例4患者病理图片(HE, 10.0×)示:肿瘤细胞呈印戒样,周围伴大量细胞外黏液
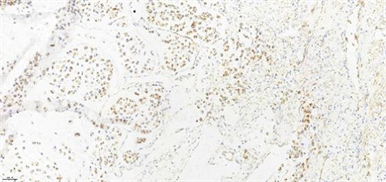
Figure 10. Immunohistochemistry (IHC, 20.0×) of patient 4 showed positive cytoplasm of tumor cells β-catenin
图10. 例4患者免疫组化(IHC, 20.0×)示:肿瘤细胞β-catenin胞浆阳性
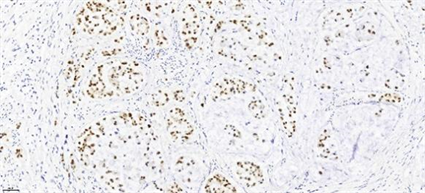
Figure 11. Immunohistochemistry (IHC, 20.0×) of patient 4: Tumor cells CDX-2(+)
图11. 例4患者免疫组化(IHC, 20.0×)示:肿瘤细胞CDX-2(+)
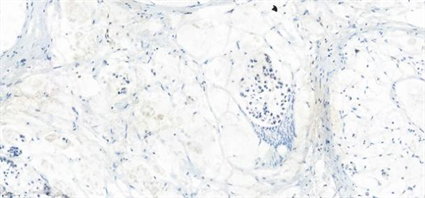
Figure 12. ERG(−) of patient 4 (IHC, 20.0×)
图12. 例4患者肿瘤细胞ERG阴性(IHC, 20.0×)

Figure 13. PSA(−) of patient 4 (IHC, 20.0×)
图13. 例4患者肿瘤细胞PSA阴性(IHC, 20.0×)
由于同为泌尿系统器官,膀胱来源的前列腺黏液肿瘤(urothelial carcinoma of the bladder with involvement of the prostate)在继发性前列腺黏液肿瘤中较为多见,膀胱肿瘤可通过多种机制及方式累及前列腺,如发生于前列腺尿道的原位尿路上皮癌,前列腺导管的种植扩散,前列腺尿道上皮下结缔组织的侵袭以及直接通过膀胱壁侵袭等 [40] [41] [42]。在前列腺穿刺活检,TURP,根治性前列腺切除术或根治性膀胱前列腺切除术标本中,均可以检测到累及前列腺的尿路上皮癌,但在没有已知膀胱尿路上皮癌病史的情况下,在前列腺穿刺活检或TURP术后的标本上,确定肿瘤的原发灶及其转移方式极为困难。因此在这种情况下,病理标本充分取材多次采样进行镜下分析至关重要。
膀胱来源的前列腺黏液肿瘤可有排尿困难并下尿路刺激症状,后期可出现肉眼无痛性血尿,亦可无明显临床症状。对于前列腺黏液肿瘤怀疑膀胱来源时,应该行膀胱内镜检查,明确膀胱内有无占位性病变。由于需要警惕通过膀胱内壁的直接侵袭,应该使用膀胱镜的窄谱光成像(narrowbandimaging, NBI)模式,其有助于发现微小病灶的浸润。部分有膀胱肿瘤病史的患者若于膀胱镜下发现黏液样物质,特别是膀胱三角区的黏性物质,应考虑该病可能性,本例患者术后大体标本即观察到膀胱三角区黏液样胶冻区。
病理学及免疫组化特征有助于鉴别诊断。研究表明,膀胱前列腺根治性切除术标本中膀胱癌累及前列腺的发生率在12%至48%之间,若膀胱肿瘤通过直接侵袭的方式突破膀胱逼尿肌层,侵入前列腺基质被归类为pT4a期,而前列腺尿道部起源的尿路上皮癌侵入前列腺基质则被归为pT2期,因此不同的转移方式病理分期并不相同,可能会有不同的结局及预后 [43] [44] [45]。该病组织学特征表现为细胞外黏液湖,但是黏液湖内及周边的肿瘤细胞呈肠型,假复层高柱状上皮细胞排列成腺腔样,细胞具有不同程度的异型性,可见相当数量的杯状细胞,邻近良性尿路上皮常伴有腺性膀胱炎 [6] [44],以上特点有助于该病和前列腺尿道黏液腺癌相鉴别。
本例患者免疫组化结果:PSA、ERG、P504S阴性证明继发性黏液腺癌,结合肿瘤部位及β-Catenin膜阳性表达,支持原发于膀胱。值得一提的是,近年来以PD-1/PD-L1抑制剂为代表的免疫治疗方法在肿瘤治疗中取得了一定的疗效,本例患者首次对前列腺黏液肿瘤进行了PD-L1表达的免疫组化检测,结果提示PD-L1表达为阴性,因此PD-1/PD-L1免疫抑制剂治疗可能并不适用于该类疾病,但PD-1/PD-L1抑制剂联合其他药物能否应用于晚期前列腺黏液肿瘤的治疗仍有待于进一步的临床研究。
治疗方面,该病早期应综合评估肿瘤周围侵袭情况,综合考虑年龄、合并症等方面,选择行手术治疗或姑息疗法,早期行根治性膀胱前列腺切除术有助于提高患者预后。内分泌治疗方面,国内外尚无文献报道,缺乏数据支持。
总之,膀胱来源的前列腺黏液肿瘤较为复杂,其机制和治疗仍需大量数据观察,早期手术切除是首选的治疗方法,术后仍存在复发及转移可能性,需要密切随访。
3.2. 消化道来源的前列腺黏液肿瘤
例5:患者61岁,2020-03-10因进行性排尿困难1年余入院,患者1年前无明显诱因出现排尿困难,表现为排尿等待、尿线变细,伴尿频,夜尿约3次,偶有尿急、尿痛,无肉眼血尿,并进行性加重。既往史:1年前因“结肠肿瘤”行手术切除及改道术。外院超声提示前列腺增生(5.9*3.9 cm)。入院后盆腔CT示:膀胱充盈欠佳,壁厚,前列腺增大,其内见斑点状钙质密度影。双侧精囊腺见多发点状钙质密度影,乙状结肠部分缺如。直肠壁增厚,周围脂肪间隙模糊,直肠系膜及骶前软组织增厚(图14)入院PSA:0.212 ng/ml,CEA (癌胚抗原):3.27 ng/ml,糖类抗原724:27.46 IU/ml,行TURP术,术中见前列腺周围白色粘状物质,膀胱内呈梗阻表现,小梁、小房多见,膀胱内弥漫出血灶,呈点状或片状。术后病理示:前列腺黏液肿瘤,结合病史及免疫组化结果,考虑为转移性(图15)。免疫组化:CK20局部(+),CDX-2(+),SATB2(+),Villin(+),PSA(−),P504S(−),Ki-67(+,约60%),VENTANA PD-L1(SP263) (−),出院后随访5个月患者已出现转移症状。
例6:患者63岁,2019-03-11因排尿困难3个月,加重20天入院,患者3个月前无明显诱因出现排尿困难,为排尿踌躇,伴尿频,夜尿约7~8次,无尿急、尿痛,无肉眼血尿,无腰背部疼痛不适。20天前出现排尿困难症状加重,7天前患者于我院就诊,行泌尿系超声检查,提示:前列腺增大并钙化灶。既往史:4年因“胃癌”行胃大部切除术,术后接受化疗。家族史:母亲患胃癌;父亲患肺癌;大舅患前列腺癌。入院PSA:0.403 ng/ml,行TURP术,术后病理示:前列腺黏液肿瘤,结合临床病史及免疫组化结果,考虑为转移性,来自胃肠道可能。免疫组化结果:PSA(−),P504S(部分+),CK7(−),CK20(部分+),CDX-2(+),SATB2(+),Ki-67阳性率约50% (图16~18)。后患者转入肿瘤科治疗,行盆腔MR示:直肠中下段管壁明显增厚、管腔狭窄,呈等T1混杂长T2信号,与前列腺分界欠清,左侧髂血管区见肿大淋巴结,骨盆、腰椎信号改变(图19)。PET/CT提示直肠癌侵及前列腺及右侧精囊腺,并淋巴结转移瘤。行胃镜及肠镜病理显示:胃(窦)黏液腺癌伴印戒细胞癌(溃疡型,范围8.5*5 cm,Laurens分型:弥漫型),(直肠)低分化腺癌(图20)。后患者行新辅助XELOX方案化疗:奥沙利铂200 mg + 卡培他滨1.5 g bid,期间接受放疗,目前伊立替康+阿帕替尼治疗中。
例7:患者56岁,2019-03-19因排尿困难3月入院,患者3个月前出现排尿困难,无尿急、尿痛,无肉眼血尿。既往史:右半结肠术后8年。于我院行CTU检查:前列腺区见不规则团块状软组织密度影,内见多发点状钙质密度影,增强扫描呈不均匀延迟强化,与膀胱后壁及输尿管下段分界欠清,腹膜后见多发小淋巴结影(图21)。前列腺MR示:前列腺区见长T1等长T2混杂信号影,DWI信号略高,形态不规则,边界不清,局部与双侧精囊、膀胱后壁及输尿管下段、直肠分界欠清。前列腺下部另见一结节状DWI高信号影。盆腔见多发增大淋巴结影,转移瘤可能性大(图22)。胸部CT示:双肺见多发大小不等结节状高密度影,转移瘤可能。入院PSA:1.870 ng/ml,行超声引导下前列腺穿刺活检术,术后病理示:前列腺黏液肿瘤,结合形态学、免疫组化及病史,支持源自肠道的转移性癌,神经侵犯(−)。免疫组化:CDX-2(+),Villin(+),PSA(−),TTF-1(−),NapsinA(−),S-100(−),P504S(−)。患者未行手术治疗,出院后失访。

Figure 14. Pelvic CT of patient 5 showed thick bladder wall, speckled calcareous density shadow in prostate, and thickening of mesentery and presacral soft tissue
图14. 例5患者盆腔CT示:膀胱壁厚,前列腺内见斑点状钙质密度影,直肠系膜及骶前软组织增厚

Figure 15. Pathological images of patient 5 (HE, 10.0×) showed that tumor cells were scattered and adenoid in prostate tissue, accompanied by a large amount of extracellular mucus
图15. 例5患者病理图片(HE, 10.0×)示:前列腺组织内见肿瘤细胞散在、腺样排列,伴大量细胞外黏液

Figure 16. CDX-2(+) of patient 6 (IHC, 20.0×)
图16. 例6患者肿瘤细胞CDX-2阳性(IHC, 20.0×)

Figure 17. PSA(−) of patient 6 (IHC, 20.0×)
图17. 例6患者肿瘤细胞PSA阴性(IHC, 20.0×)
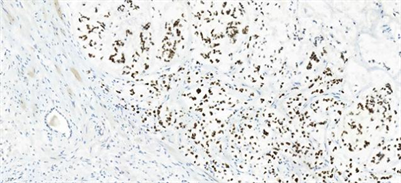
Figure 18. SATB2(+) of patient 6 (IHC, 20.0×)
图18. 例6患者肿瘤细胞SATB2阳性(IHC, 20.0×)
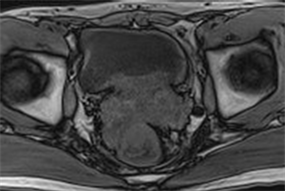
Figure 19. Pelvic MR of patient 6 showed that the wall of the middle and lower rectum was significantly thickened, the lumen was narrow, and the boundary with the prostate was not clear
图19. 例6患者盆腔MR示:直肠中下段管壁明显增厚、管腔狭窄,与前列腺分界欠清

Figure 20. Colonic space occupying lesion in patient 6
图20. 例6患者结肠内占位性病变

Figure 21. Urological CTU of patient 7 showed irregular mass density shadow in the prostate region, uneven delayed enhancement on enhanced scan, and unclear boundary with the posterior wall of the bladder
图21. 例7患者泌尿系CTU示:前列腺区见不规则团块状密度影,增强扫描呈不均匀延迟强化,与膀胱后壁分界欠清

Figure 22. MR of prostate in patient 7 showed that the prostate region was irregular in shape and ill-defined, with poorly defined boundaries with bilateral seminal vesicles, posterior wall of bladder and rectum
图22. 例7患者前列腺MR示:前列腺区形态不规则,边界不清,局部与双侧精囊、膀胱后壁及直肠分界欠清
由于解剖关系的临近,结直肠来源的前列腺黏液肿瘤(colorectal adenocarcinoma with involvement of the prostate)较为多见,大多数患者都有消化系统肿瘤病史,但由于累及前列腺,患者可能会出现阻塞性尿道疾病,因此大部分患者初次就诊主诉为排尿困难,其诊断源于TURP术后标本。因此,临床工作中应格外警惕有结直肠癌病史的前列腺疾病患者,尤其血清PSA水平为正常值的情况下,应高度联想到该病可能性。
结、直肠癌的前列腺继发受累可通过直接扩散或散在转移发生,直接侵袭前列腺的直肠癌可由多种方式造成。迪氏筋膜(Denonvillier筋膜)又称直肠前筋膜,位于膀胱、前列腺和直肠之间,是阻碍直肠肿瘤向前侵犯的天然屏障,在阻止肿瘤向前列腺的扩散中起关键作用。直肠癌患者可能由于Denonvillier筋膜狭窄或破裂,使得局部肿瘤细胞更容易扩散到前列腺 [46]。
从组织学上看,消化道来源的前列腺黏液肿瘤与其他类型黏液肿瘤形态特点相似,较难鉴别,而免疫组化有助于鉴别诊断,本报道3例患者CDX-2(+),PSA(−),均支持其为来源于消化道的前列腺黏液肿瘤,Villin(+),SATB2(+),P504S(−)也有助于其与其他类型黏液肿瘤的鉴别诊断。癌胚抗原(CEA)作为诊断结直肠癌的特异性标志物,也可呈弥漫阳性。
值得注意的是,直肠指诊(DRE)作为前列腺、直肠疾病的重要查体方式,其重要性正在被影像学检查所替代,但临床医生应高度重视该项检查,对前列腺疾病患者常规行DRE,不仅可触摸到前列腺大小、质地、硬度,判断前列腺疾病程度,更可以发现直肠相关病变。应注意PSA检查应该在DRE、膀胱镜检查48小时后采集,对于有结直肠肿瘤病史的前列腺疾病患者,应行CEA等肿瘤标志物检查,并推荐行结直肠内镜检查,如有可疑病变,建议行病理活检,排除消化道病变。
治疗方面,泌尿科医生可与胃肠外科医生协作,做姑息性手术切除。尿流改道方式选择上,不推荐行回肠代膀胱术等原位膀胱术式,输尿管皮肤造口术是一种简单、有效且安全的术式。例6患者术后行新辅助XELOX方案化疗:奥沙利铂200 mg + 卡培他滨1.5 g bid,期间接受放疗,目前伊立替康 + 阿帕替尼治疗中,对于放疗及化疗,仍缺乏大量数据支持。
4. 总结
本研究报道了我院7例前列腺黏液肿瘤患者的临床特征及病理学特点,首次详细报道了膀胱及消化道来源的前列腺黏液肿瘤,并分析了近20年相关文献,更新了对前列腺黏液肿瘤的认识,为前列腺黏液肿瘤的诊疗提供了一定的数据。前列腺黏液肿瘤是一类较为罕见的前列腺肿瘤亚型的集合,各亚型之间具有不同的临床特点及治疗方式,临床上除了这几种亚型之间的互相鉴别外,还应与其他诸如前列腺印戎细胞癌等疾病相区分,病理学及免疫组化特征是诊断的关键。根治性手术切除仍是治疗首选,内分泌治疗尚缺乏更多研究,临床能否获益需要更多数据支持。
NOTES
*通讯作者Email: zhangxuezhou1128@163.com