摘要: 目的:通过观察小鼠低剂量脾脏照射、低剂量全身照射与空白对照组小鼠脾脏指数、脾脏T淋巴细胞亚群变化,探讨其差异变化的意义。方法:经不同辐射剂量照射小鼠脾区或全身后,建立小鼠模型。处死小鼠取脾脏组织计算各组小鼠脾脏指数改变、采用流式细胞术分析脾脏T淋巴细胞亚群改变。结果:与空白对照组相比,低剂量脾区照射组与低剂量全身照射组小鼠脾脏指数均升高,而低剂量脾区照射组小鼠升高更为明显;低剂量脾区照射组、低剂量全身照射组小鼠脾脏CD3+ T淋巴细胞、CD4+ T淋巴细胞较空白对照组比例升高,低剂量脾区照射组升高更为明显。结论:经低低剂量脾区照射、低剂量全身照射小鼠后,脾脏T淋巴细胞亚群发生改变,使CD3+ T淋巴细胞、CD4+ T淋巴细胞表达比例升高,而低剂量脾区照射刺激作用更强。
Abstract:
Objective: To observe the changes of spleen index and T lymphocyte subsets in mice with low dose spleen irradiation, low dose total body irradiation and blank control group, and to explore the significance of the difference. Method: The mouse model was established by irradiating the spleen or the whole body with different doses of radiation. The spleen tissues of the mice were taken to calculate the changes of spleen index and the changes of T lymphocyte subsets in spleen were analyzed by flow cytometry. Result: Compared with blank control group, spleen index of mice in low dose splenic area irradiation group and low dose total body irradiation group increased, but the increase of mice in low dose splenic area irradiation group was more obvious. Compared with blank control group, the proportion of CD3+ T lymphocytes and CD4+ T lymphocytes in spleen of mice in low dose splenic area irradiation group and low dose total body irradiation group increased, and the increase was more obvious in low dose splenic area irradiation group. Conclusion: The spleen T lymphocyte subsets of mice were changed after low and low dose splenic irradiation and low dose total body irradiation, and the expression proportion of CD3+ T lymphocyte and CD4+ T lymphocyte increased, while the stimulation effect of low dose splenic irradiation was stronger.
1. 引言
提起辐射对人体的作用,大多数学者支持线性阈值概念,是指所有剂量水平的长时间的辐射对机体都是有害的 [1]。然而研究者也曾指出,低剂量辐射在某些情况可以引起机体免疫反应的积极作用。80年代初,美国Luchey首次提出了“辐射刺激作用(Radiation Hormesis)”的假说 [2],联合国原子辐射效应科学委员会于1986年提出,低剂量照射是指<0.2 Gy的低线性能量转移辐射或<0.05 Gy的高线性能量转移辐射,同时剂量率<0.05 mGy/min [3],有关研究观察到低剂量电离辐射可以诱导免疫兴奋,它可以增强免疫反应,提高机体自身适应能力,加速损伤的修复。相关研究显示,低剂量辐射还可以提高个体对肿瘤的抵抗能力,减轻放疗和化疗的副作用。有关研究还发现,用低剂量照射预处理后,可以减轻高剂量照射对机体的损伤 [4] [5]。低剂量辐射同时能够抑制细胞的衰老过程,延缓癌症的发展 [6]。而脾脏作为机体的重要的免疫器官之一,是多种免疫细胞产生、增殖和进行免疫表达的场所。日本学者栗原涛之分别采用低剂量辐射照射小鼠全身、单纯照射脾脏、遮避脾区照射全身、只照射肿瘤局部,去观察抗肿瘤效果,结果表明前二者效果相似,而后二者未出现抗肿瘤作用,证实只要脾脏组织未受到低剂量照射,抗肿瘤效果就不会产生,只有免疫功能受到低剂量辐射后激活,才会具有抗肿瘤的作用 [7]。有关实验也已证明,低剂量脾区照射可以对人体产生有益影响 [8]。低剂量照射能刺激脾脏产生IL-2和IFN-γ分泌,激活自然杀伤细胞和抗原依赖性细胞介导的细胞毒作用,增加脾脏免疫细胞的增殖 [9]。某些研究也证实通过低剂量脾区照射刺激脾脏功能可以对肿瘤等疾病的治疗产生积极的作用 [10]。所以,本研究选择脾脏作为照射靶区。本研究为确定低剂量脾区照射及全身照射对机体免疫系统的具体影响,将正常健康未经照射小鼠作为对照,利用流式细胞术检测对照组及不同实验组小鼠脾脏T淋巴细胞亚群变化,来明确低剂量脾区、全身照射对于机体免疫系统的影响。
2. 实验方法
2.1. 实验动物
本4~6周龄昆明小鼠模型(饲养环境:SPF级),雌雄各半,由济南鹏越提供,体重为17 ± 2 g。常规饲养1周后体重增加至20 ± 2 g进行实验。
2.2. 实验器械
本23EX直线加速器,美国Varian medical systems产品;流式细胞仪,英国APOGEE公司产品;其他器械:超净工作台、低速离心机、微量移液器和常规手术器械及其他常规器械。
2.3. 药品及试剂
PBS (1X),4%多聚甲醛,溶血素红细胞裂解液,CD3+ APC,CD4+ FITC,CD8+ PE荧光标记单克隆抗体均购自BD公司。
2.4. 实验设计及照射方法
建立不同照射条件3组:1) 空白对照组(n = 10):适龄雄性/雌性小鼠模型;2) 实验组1 (n = 10):适龄雄性/雌性小鼠模型 + 低剂量(LDR)脾脏照射;3) 实验组2 (n = 10):适龄雄性/雌性小鼠模型 + 低剂量分割(多次分割LDR)脾脏照射;照射组均使用自制纸盒盛装固定小鼠,低剂量(LDR)脾照射与低剂量全身照射均调整剂量率为5 cGy/min,总量为75 mGy (7.5 cGy),低剂量脾区照射视野固定为小鼠脾区(左上腹部),范围2*2 cm。低剂量全身照射视野固定为小鼠全身,范围15*5 cm。
2.5. 小鼠脾脏指数表达
空白对照组小鼠模型及照射组小鼠模型成模后,称重小鼠体重,后经二氧化碳窒息法人道主义处死小鼠后取脾脏组织,去除脂肪及结缔组织后称重,计算各组小鼠脾脏指数。
2.6. 小鼠脾脏组织CD3+ T淋巴细胞、CD4+ T淋巴细胞、CD8+ T淋巴细胞表达测定
空白对照小鼠模型及照射小鼠模型成模后,经二氧化碳窒息法后人道主义处死,取小鼠外周血抗凝处理;取脾脏组织过200目筛网,得脾脏单细胞悬液,另分别取200 μl脾脏细胞悬液按照1:10比例加入1X红细胞裂解液,摇匀后全血及脾脏细胞分别裂解15 min和5 min,250 xg离心5 min后重悬,按照1:100稀释比例将标记抗体分别加入200 μl脾脏细胞混合均匀,避光染色30 min后,用PBS洗去非特异结合,然后进行流式细胞分析,并比对分析其检测结果。
2.7. 小鼠脾脏组织CD3+ T淋巴细胞、CD4+ T淋巴细胞、CD8+ T淋巴细胞表达测定
所有的实验操作重复3次,实验结果统计学分析采用SPSS21.0版本。定量统计结果若符合正态分布,以M ± SD表示,**代表P < 0.01、*代表P < 0.05认为有统计学意义上的差别。两组样本间比较采用T检验,多样本间比较采用单因素方差分析法。
3. 结果
3.1. 小鼠脾脏指数
脾脏指数变化:低剂量脾区照射组较低剂量全身照射组,脾脏指数未见明显改变(P > 0.05);低剂量脾区照射组及低剂量全身照射组较空白对照组脾脏指数有明显增加(*P < 0.05)。见表1。

Table 1. Spleen index data of mice
表1. 小鼠脾脏指数结果数据
3.2. 对照组及照射组小鼠脾脏CD3+ T淋巴细胞流式分析
经流式细胞术上机检测后,低剂量脾区照射组、低剂量全身照射组小鼠脾脏CD3+ T淋巴细胞较空白对照组比例升高(**P < 0.05),低剂量脾区照射组CD3+ T淋巴细胞比例升高更明显(*P < 0.01);流式细胞图见图1~3,统计结果见图4。
Figure 1. CD3+ T lymphocytes in blank control group
图1. 空白对照组CD3+ T淋巴细胞
Figure 2. CD3+ T lymphocytes in low dose splenic irradiation group
图2. 低剂量脾区照射组CD3+ T淋巴细胞
Figure 3. CD3+ T lymphocytes in low dose total body irradiation
图3. 低剂量全身照射组CD3+ T淋巴细胞
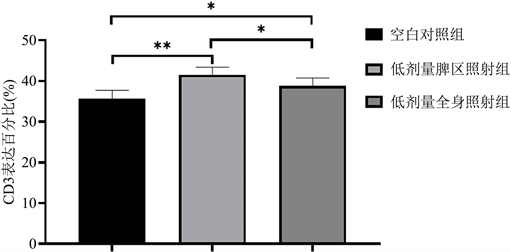
Figure 4. Flow cytometry analysis of CD3+ T lymphocytes in mouse spleen
图4. 小鼠脾脏CD3+ T淋巴细胞流式分析
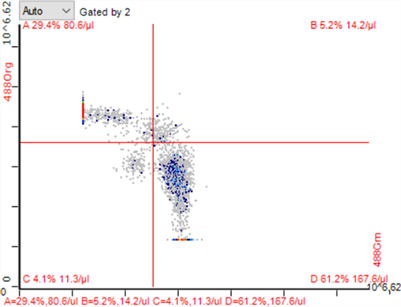
Figure 5. CD4+/CD8+ T lymphocytes in blank control group
图5. 空白对照组CD4+/CD8+ T淋巴细胞
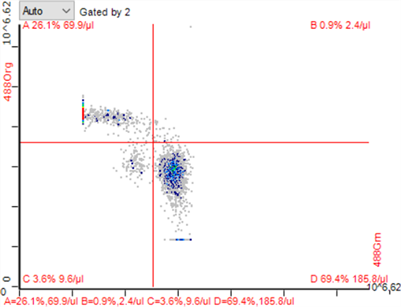
Figure 6. CD4+/CD8+ T lymphocytes in low dose splenic irradiation group
图6. 低剂量脾区照射组CD4+/CD8+ T淋巴细胞
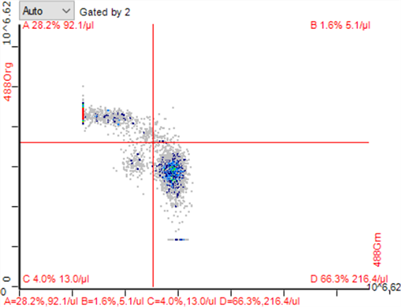
Figure 7. CD4+/CD8+ T lymphocytes in low dose total body irradiation group
图7. 低剂量全身照射组CD4+/CD8+ T淋巴细胞
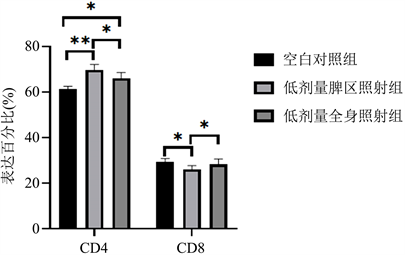
Figure 8. Flow cytometry analysis of CD4+/CD8+ T lymphocytes in mouse spleen
图8. 小鼠脾脏CD4+/CD8+ T淋巴细胞流式分析
3.3. 对照组及照射组小鼠脾脏CD4+/CD8+ T淋巴细胞流式分析
低剂量脾区照射组、低剂量全身照射组小鼠脾脏CD4+ T淋巴细胞较空白对照组升高(*P < 0.05),低剂量脾区照射组CD4+ T淋巴细胞比例升高更明显(*P < 0.01);低剂量脾区照射组脾脏CD8+ T淋巴细胞较空白对照组及低剂量全身照射组比例均有降低(*P < 0.05)。流式细胞图见图5~7,统计结果见图8。
4. 讨论
论脾脏作为机体最重要的免疫器官之一,与细胞免疫及体液免疫密切相关,对脾内及外周血中的T淋巴细胞的量和比例有重要的调节作用 [11],T淋巴细胞亚群又可以分CD3+ T细胞、CD4+ T细胞(辅助/诱导性T淋巴细胞)和CD8+ T细胞(抑制性/细胞毒T淋巴细胞)。CD3+ T淋巴细胞几乎存在于所有的T细胞表面,CD4+ T淋巴细胞可协助B细胞分泌抗体和调节其他T细胞的免疫应答,CD8+ T淋巴细胞常表现细胞毒活性,是主要的细胞毒效应细胞。在机体内起到抗肿瘤效应的细胞主要包括抗体、T淋巴细胞和自然杀伤细胞 [12],T淋巴细胞则主要通过抗原特异性反应来准确识别肿瘤细胞,可表达识别肿瘤特异性抗原的受体,并分化成效应性或记忆性T淋巴细胞,从而发挥识别并杀伤肿瘤的作用 [13]。T淋巴细胞可以通过识别机体内“非自我”的抗原而杀灭肿瘤细胞 [14]。T淋巴细胞也能够穿过复杂的血脑屏障(BBB) [15],这种穿透特性使得T淋巴细胞能够杀灭一般药物难以到达的病灶脑转移部位,例如原发性脑肿瘤及脑转移瘤 [16]。根据本实验结论证实,低剂量脾区照射后对于机体产生的适应性改变可以通过调节T淋巴细胞亚群所产生的,李德锐教授通过对鼻咽癌患者脾区接受低剂量照射后外后外周血T淋巴细胞亚群的变化研究中,观察到在放射治疗的同时,加入脾区低剂量照射的干预后,CD3+ T淋巴细胞、CD4+ T淋巴细胞较常规照射组增加,CD8+ T淋巴细胞减少,CD4/CD8比率增高 [17]。同时,国外学者发现,多次低剂量照射后的抗肿瘤作用较一次照射后效果更好 [18],这可能与多次低剂量照射较一次低剂量照射所引起的免疫效应更强有关。同时,早期研究发现胃癌随着病期进展,脾脏中CD8+ T淋巴细胞的活性较外周血明显增高,而CD4+ T淋巴细胞活性却明显降低 [19]。这说明随着肿瘤的发展,会使得脾脏的免疫功能受到抑制。
综上所述,利用低剂量辐射对小鼠脾脏及全身进行照射,通过流式细胞术观察脾脏T淋巴细胞亚型的变化、脾脏指数的改变,可以发现低剂量脾区照射后会导致机体免疫兴奋及其对脾脏和T淋巴细胞的表达所产生的具体影响,为放射治疗及免疫治疗未来的研究提供了新的想法。