1. 引言
肺癌是全球最常见的恶性肿瘤之一,发病率高,预后差,全球每年死于肺癌的患者超过100万例,其已成为恶性肿瘤死亡原因的第1位 [1]。非小细胞肺癌(non-small cell lung cancer, NSCLC)是肺癌的主要病理类型,占所有肺癌的80%左右,其病因并不单一且具备较高的侵袭性 [2]。非小细胞肺癌早期没有显著的临床表现,约75%的NSCLC患者诊断时已为中晚期,化疗5年生存率不超过5% [3] [4]。因此,研究肺癌相关的重要基因及关键信号通路,有助于进一步揭示肺癌的发病机制,对肺癌的防治意义重大。
程序性细胞死亡因子4 (PDCD4)是一种细胞凋亡相关基因,研究发现其在肾脏、肺脏、乳腺等肿瘤细胞系中表达降低或缺失,且在肺癌组织中缺失率高达83% [5] [6]。但PDCD4在肺癌中的确切功能和具体分子机制目前尚不清楚。激活蛋白-1 (activator protein-1, AP-1)是具有广泛作用的早期基因编码核转录因子 [7]。Jun蛋白(c-Jun、JunB、JunD)和Fos蛋白(c-Fos、FosB、Fra-1、Fra-2)构成的同异源二聚体是最为典型的AP-1 [8]。AP-1的活化不仅与细胞的增殖、分化、肿瘤转化有关,还可以从多个环节上促进肿瘤的浸润转移 [9]。
MicroRNA (miRNA)是一类内源性非编码单链RNA,参与细胞生长、发育和凋亡等重要生物过程。miR-21是普遍存在的致癌基因,在许多肿瘤包括肺癌、肝癌中都检测出较高表达 [10]。研究发现,PDCD4是miR-21的直接靶基因,肺小细胞肺癌中miR-21的表达与PDCD4呈负相关 [11]。并且AP-1活化能够上调miR-21表达,而miR-21介导的PDCD4下调是AP-1活化的必要条件 [12]。因此,猜想PDCD4/AP-1形成的自我调节环路在肺癌的发展、侵袭、转移中可能发挥重要作用。所以本研究旨在体外细胞水平观察非小细胞肺癌细胞PDCD4与AP-1表达情况及其与细胞迁移能力的相关性。
2. 材料和方法
2.1. 细胞系与主要试剂
人非小细胞肺癌细胞株A549 (批号:9S6LY48FOY)、H520 (货号:CL-0402)购自武汉普诺赛生命科技有限公司,胎牛血清(fetal bovine serum, FBS) (批号:2130209)、DMEM/F12 (1:1)培养基(批号:2203019)、RPMI1640培养基(批号:2208047)、购自BI公司,RIPA、PMSF蛋白裂解液(增强型) (批号:20211104)、SDS-PAGE凝胶快速配制试剂盒(批号:121821211221)购自碧云天,PDCD4 (批号:5)、c-Fos (批号:11)、JunB (批号:2)一抗购自美国CST公司,β-actin (批号:10021293)一抗、HRP标记的抗鼠(批号:20000487)、抗兔二抗(批号:20000455)购自Proteintech公司。
2.2. 细胞培养
将A549细胞和H520细胞复苏后,分别转入含10% FBS、体积比为1%的青–链霉素溶液的DMEM/F12培养基和RPMI1640培养基中,于37℃、5% CO2培养箱内培养并观察细胞形态。A549细胞每1~2 d传代一次,H520细胞每2~3 d传代一次,取对数生长期细胞用于实验。
2.3. 细胞划痕实验
将A549细胞按3.5 × 105/孔、H520细胞按5 × 105/孔接种于6孔板中,每孔2 mL,于37℃、5% CO2培养箱内培养24 h,待细胞生长至100%基本融合时,用100 μL枪头在6孔板细胞表面划1条平行线,并用磷酸盐缓冲液(PBS)洗涤以去除漂浮细胞,细胞分组为A549正常组和H520正常组,每个细胞设3个副孔,分别于0,24,48 h时采用倒置相差显微镜观察各组细胞迁移情况,并在100倍条件下拍照,照片使用ImageJ软件处理,计算空白区域面积并计算细胞迁移率,细胞。
2.4. Western Blot检测PDCD4、c-Fos、JunB相关蛋白的表达
将A549和H520细胞分别按2 × 105/孔接种于六孔板,每孔2 ml,待细胞铺满六孔板90%左右,RIPA裂解液提取细胞总蛋白,用BCA法测定蛋白浓度后,取一定量细胞上清和5 × 蛋白上样缓冲液按4:1混合,100℃水浴变性10 min;按20 μg蛋白统一上样量,电泳,浓缩胶恒压80 V 25 min,分离胶恒压120 V 90 min;采用湿转法转膜,恒流300 mA电转90 min;
10%脱脂奶粉室温封闭2 h,一抗(1:1000)及β-actin鼠抗人单克隆抗体(1:5000),4℃孵育过夜,TBST洗膜(3次,每次10 min);次日二抗室温孵育1.5 h,TBST洗膜(3次,每次10 min),用ECL化学发光液显影。
2.5. 统计学方法
本次实验数据均采用SPSS22.0统计分析软件进行统计学分析,计量资料均以均数 ± 标准差表示,组间比较采用t检验,以P < 0.05为差异有统计学意义。
3. 结果
3.1. 肺腺癌细胞A549和肺鳞癌细胞H520细胞形态
肺腺癌细胞A549和肺鳞癌细胞H520均为贴壁细胞,A549为长梭形或鹅卵石样多边形的上皮细胞,排列整齐规则;而H520为类圆形、长圆形或多边形上皮细胞,细胞排列紧密,聚集成团生长。(图1)
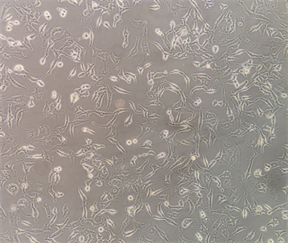 (a) 肺腺癌细胞A549 ´ 100
(a) 肺腺癌细胞A549 ´ 100 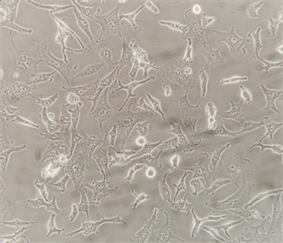 (b) 肺腺癌细胞A549 ´ 200
(b) 肺腺癌细胞A549 ´ 200
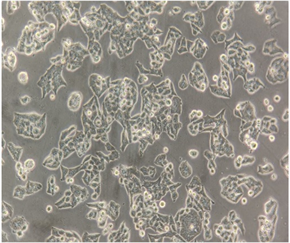 (c) 肺鳞癌细胞H520 ´ 100 (d) 肺鳞癌细胞H520 ´ 200(a) (b) A549细胞呈长梭形或鹅卵石样多边形,细胞排列规则;(c) (d) H520细胞呈类圆形、长圆形或多边形,细胞排列紧密,聚集成团生长。
(c) 肺鳞癌细胞H520 ´ 100 (d) 肺鳞癌细胞H520 ´ 200(a) (b) A549细胞呈长梭形或鹅卵石样多边形,细胞排列规则;(c) (d) H520细胞呈类圆形、长圆形或多边形,细胞排列紧密,聚集成团生长。
Figure 1. Morphology of non-small cell lung cancer cells A549 and H520
图1. 非小细胞肺癌A549和H520细胞形态
3.2. 非小细胞肺癌A549和H520细胞迁移情况
通过细胞划痕实验来比较非小细胞肺癌A549和H520细胞迁移情况。结果如图2、图3、表1所示,随着时间的推移,肺腺癌细胞A549和肺鳞癌细胞H520的细胞迁移率均呈增长趋势,且在划痕后24小时和48小时,腺癌细胞A549的迁移率明显高于鳞癌细胞H520,差异有统计学意义(P < 0.05),表明腺癌细胞的迁移能力明显强于鳞癌细胞。
3.3. PDCD4、AP-1蛋白表达情况
如图4、图5所示,肺鳞癌细胞H520中PDCD4蛋白表达水平明显高于肺腺癌细胞A549,而AP-1 (JunB和c-Fos)蛋白表达水平明显低于肺鳞癌细胞H520,差异有统计学意义(P < 0.001)。

Table 1. Migration rate of non-small cell lung cancer cells A549 and H520
表1. 非小细胞肺癌A549和H520细胞迁移率
与A549组比较,*P < 0.05,***P < 0.001。
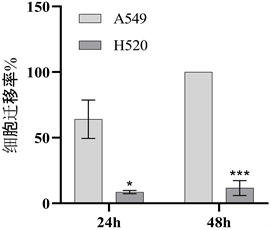 与A549组比较,*P < 0.05,***P < 0.001。
与A549组比较,*P < 0.05,***P < 0.001。
Figure 3. Migration rate of non-small cell lung cancer cells A549 and H520
图3. 非小细胞肺癌A549和H520细胞迁移率

Figure 4. Expression of PDCD4 and AP-1 (c-Fos and JunB) in non-small cell lung cancer cells A549 and H520
图4. 非小细胞肺癌A549和H520细胞PDCD4和AP-1 (c-Fos和JunB)表达情况
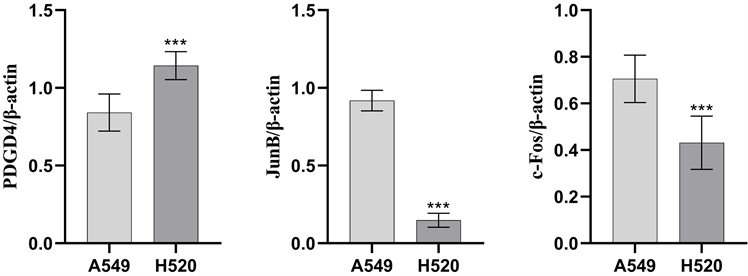 与A549组比较, ***P < 0.001。
与A549组比较, ***P < 0.001。
Figure 5. Expression levels of PDCD4 and AP-1(c-Fos and JunB) in non-small cell lung cancer cells A549 and H520
图5. 非小细胞肺癌A549和H520细胞PDCD4和AP-1表达水平
4. 讨论
目前非小细胞肺癌的发病率和死亡率仍呈上升趋势,其治疗是世界范围内亟待解决的难题 [13]。非小细胞肺癌临床上多采用化疗疗法,而长期服用化学药物,一些患者不可避免地会出现多种不良反应及耐药性,使得患者生命健康及生存质量下降 [14]。所以,发现肺癌早期标志物和新的干预靶点能够为肺癌治疗提供新的策略。
腺癌和鳞癌是两类主要的非小细胞肺癌,单从细胞生长特性而言,腺癌细胞生长速度快,鳞癌细胞生长速度相对较慢。腺癌浸润和转移能力强,一般原发病灶较小时即可出现转移,肺腺癌常常伴随有癌性淋巴管炎和远处转移,而鳞癌发生远处转移的时间相对较晚。本研究通过划痕实验也证实了腺癌细胞A549的细胞迁移率明显高于鳞癌细胞H520细胞。
PDCD4是一种抑癌基因,其表达水平与肿瘤细胞增殖、侵袭和迁移呈负相关。研究发现,miR-21能够靶向抑制PDCD4表达,促进肺腺癌细胞A549细胞的增殖与迁移能力,表明PDCD4是miR-21的负性调控基因,PDCD4表达水平与肺腺癌细胞A549细胞的增殖与迁移能力呈负相关 [15]。本研究发现,与鳞癌细胞H520细胞比较,肺腺癌细胞A549细胞中PDCD4蛋白表达水平较低,这与其较高的细胞迁移率呈负相关。
AP-1是一类型原癌基因,主要是由Jun蛋白(c-Jun、JunB、JunD)和Fos蛋白(c-Fos、FosB、Fra-1、Fra-2)构成的同源或异源二聚体。JUN及FOS蛋白高表达为肺癌频发早期事件,可诱导癌基因表达,参与细胞恶性转化 [16]。同时,AP-1也是miR-21/PDCD4/AP-1反馈环路中的关键环节,参与肺癌的发生发展。研究发现,在非小细胞肺癌组织中c-Fos/AP-1表达阳性率明显高于癌旁组织,与肺癌淋巴结转移有关 [17]。上皮–间质转化(EMT)是指上皮细胞在特定的生理或病理状况下向间质细胞表型转变的过程。研究发现,EMT与肺癌的侵袭、转移及化疗耐药相关 [18]。JunB/AP-1是上皮–间质转化(EMT)重要转录调节因子之一,m6A甲基转移酶METTL3可通过调节JunB/AP-1,促进TGF-β诱导的肺癌细胞EMT [19]。本研究发现,肺腺癌细胞A549细胞中AP-1 (JunB和c-Fos)蛋白表达水平均明显高于肺鳞癌细胞H520细胞,AP-1 (JunB和c-Fos)高表达与其高细胞迁移率呈正相关。
总之,我们发现肺腺癌细胞PDCD4蛋白表达低于肺鳞癌细胞,AP-1 (JunB和c-Fos)蛋白表达高于肺鳞癌细胞,腺癌细胞迁移能力高于鳞癌细胞,表明细胞迁移能力与PDCD4表达呈负相关,与AP-1表达呈正相关。但miR-21/PDCD4/AP-1反馈环路如何调节非小细胞肺癌的增殖、迁移和侵袭有待进一步深入研究。
5. 研究局限性
本研究仅是选择了AP-1家族中具有代表性的两个蛋白JunB和c-Fos来探讨非小细胞肺癌A549和H520细胞中AP-1表达差异及其与细胞迁移的相关性,下一步将研究AP-1其他蛋白表达差异,并采用相关抑制剂来阻断miR-21/PDCD4/AP-1反馈环路,深入探讨miR-21/PDCD4/AP-1反馈环路影响非小细胞肺癌增殖、迁移和侵袭的作用机制。
基金项目
云南省科技厅——昆明医科大学应用基础研究面上基金资助项目(2019FE001-220);云南省教育厅科学基金资助项目(2018JS202)。
NOTES
*共一作者。
#通讯作者。