1. 引言
新型冠状病毒肺炎(Corona Virus Disease 2019, COVID-19)是由新型冠状病毒(Severe Acute Respiratory Syndrome Coronavirus 2, SARS-CoV-2)引起的重大传染性疾病 [1]。COVID-19自2020年爆发以来,严重威胁人类生命健康,制约社会发展 [2]。现有的疫苗能够预防病毒感染,但随着SARS-CoV-2突变株的不断出现,临床亟需安全有效的抗病毒疗法 [3] [4]。目前国内外被批准用于临床治疗COVID-19的小分子化学药物包括Remdesivir、Molnupiravir、Paxlovid、Renmindevir、Baricitinib和Azvudine [5]。它们在降低患者住院死亡率方面发挥了巨大的作用,极大地提升了人们战胜病毒的信心。
SARS-CoV-2主蛋白酶(Main Protease, Mpro, 3CLpro)是胰凝乳蛋白酶样半胱氨酸蛋白酶,能够将病毒新合成的氨基酸片段切割成多个独立起作用的非结构蛋白,在病毒的复制和增殖过程中发挥着重要作用 [6] [7]。2021年9月,Ghosh研究团队报道了一系列吲哚吡啶酯类SARS-CoV-2 3CLpro抑制剂;其中,化合物1具有优异的3CLpro抑制活性(IC50 = 0.25 μM)和细胞水平抗SARS-CoV-2 (EC50 = 2.8 μM in VeroE6 cells)活性 [8],其作用机理为:3CLpro中His41残基夺取Cys145残基上巯基的氢,Cys145残基对化合物1进行亲核进攻形成四面体中间体2,随后氯吡啶基团离去,化合物1与Cys145残基形成共价硫酯加和物,从而抑制3CLpro的生物活性(图1)。当前,COVID-19仍在蔓延,研究与开发出新型、安全、有效且药代动力学良好的SARS-CoV-2 3CLpro抑制剂迫在眉睫 [9]。本研究设计并合成了一系列新型SARS-CoV-2 3CLpro抑制剂,旨在给今后SARS-CoV-2抑制剂的研发提供新思路。
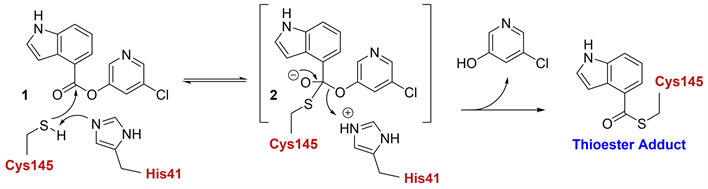
Figure 1. Action mechanism of compound 1
图1. 化合物1的作用机制
2. 目标化合物的分子设计
本研究以化合物1为先导化合物,通过生物电子等排体策略设计了一系列吲哚苯酯衍生物(5a-5f) [10],在离去部分引入吸电子基(卤素、氰基和硝基),增强离去基团的离去能力,以期提高目标化合物的抗SARS-CoV-2活性(图2)。
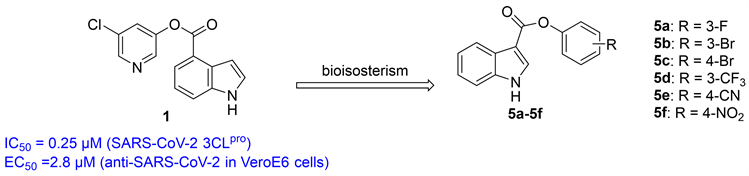
Figure 2. Molecular design of target compounds (5a-5f)
图2. 目标化合物(5a-5f)的分子设计
为了从理论上验证设计的合理性,本研究利用Discovery Studio 2021程序作为分子对接软件,将目标化合物5b对接到1/SARS-CoV-2 3CLpro复合物结构(PDB:7RBZ)中(图3) [8]。结果显示大部分化合物的打分结果高于先导化合物1,其中5b的打分结果最佳(表1),表明吲哚苯酯衍生物(5a-5f)具有优秀的潜在抗SARS-CoV-2活性。5b和1与SARS-CoV-2 3CLpro的分子对接相互作用图分别见图3(a)与图3(b)。对接结果显示,5b和先导化合物1一样,均能与SARS-CoV-2 3CLpro形成多种相互作用力,这对化合物保持活性非常重要。

Table 1. Molecular docking scores
表1. 分子对接打分结果
 (a)
(a)  (b)
(b)
Figure 3. Molecular docking interaction diagrams of 5b(a) and 1(b)
图3. 5b(a)和1(b)的分子对接相互作用图
3. 材料与合成
3.1. 材料
1H NMR和13C NMR谱采用Bruker AVIII-400 MHz型核磁共振仪测定;所用化学试剂除特殊说明外,均为市售分析纯或化学纯,未经特殊处理直接使用。
3.2. 合成方法
以3-吲哚甲酸(3)与取代苯酚(4a-4f)为起始原料,经一步酯化反应得到目标化合物(5a-5f),其合成路线见图4。
3.2.1. 3-氟苯基-3-吲哚甲酸酯(5a)的合成
将3-吲哚甲酸(0.51 g, 3.15 mmol)、3-氟苯酚(0.42 g, 3.72 mmol)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDCI) (0.72 g, 3.73 mmol)和4-二甲氨基吡啶(DMAP) (0.38 g, 3.14 mmol)溶解于20 mL二氯甲烷中,室温反应8 h。减压除去溶剂,残余物经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯 = 4/1,V/V)纯化得白色固体0.68 g,收率86.3%,m.p. 151℃~153℃; 1H NMR (400 MHz, DMSO-d6) δ 12.22 (s, 1H), 8.37 (s, 1H), 8.04 (dd, J = 6.6, 2.5 Hz, 1H), 7.58~7.53 (m, 1H), 7.53~7.46 (m, 1H), 7.30~7.22 (m, 3H), 7.16 (dtd, J = 6.6, 4.7, 2.6 Hz, 2H); 13C NMR (100 MHz, DMSO-d6) δ 162.66, 152.14, 136.98, 134.59, 131.14, 131.04, 126.20, 123.26, 122.24, 120.76, 118.95, 118.92, 113.08, 110.45, 105.43; HR-MS (ESI) m/z: calcd for C15H10FNNaO2 {[M + Na]+} 278.0593 found 278.0585.
3.2.2. 3-溴苯基-3-吲哚甲酸酯(5b)的合成
将3-吲哚甲酸(0.51 g, 3.15 mmol)、3-溴苯酚(0.64 g, 3.72 mmol)、EDCI (0.72 g, 3.73 mmol)和DMAP (0.38 g, 3.14 mmol)溶解于20 mL二氯甲烷中,室温反应8 h。减压除去溶剂,残余物经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯 = 4/1,V/V)纯化得白色固体0.77 g,收率78.5%,m.p. 180℃~181℃; 1H NMR (400 MHz, DMSO-d6) δ 12.23 (s, 1H), 8.37 (d, J = 2.9 Hz, 1H), 8.07~8.01 (m, 1H), 7.65~7.53 (m, 2H), 7.53~7.48 (m, 1H), 7.44 (t, J = 8.0 Hz, 1H), 7.33 (dd, J = 7.4, 1.8 Hz, 1H), 7.26 (tt, J = 7.2, 5.6 Hz, 2H); 13C NMR (100 MHz, DMSO-d6) δ 162.67, 151.98, 137.01, 134.64, 131.58, 128.86, 126.25, 125.83, 123.23, 122.22, 122.00, 121.89, 120.80, 113.08, 105.41; HR-MS (ESI) m/z: calcd for C15H10BrNNaO2 {[M + Na]+} 339.9793 found 339.9762.
3.2.3. 4-溴苯基-3-吲哚甲酸酯(5c)的合成
将3-吲哚甲酸(0.50 g, 3.13 mmol)、4-溴苯酚(0.65 g, 3.76 mmol)、EDCI (0.71 g, 3.71 mmol)和DMAP (0.38 g, 3.14 mmol)溶解于20 mL二氯甲烷中,室温反应8 h。减压除去溶剂,残余物经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯 = 4/1,V/V)纯化得白色固体0.93 g,收率94.8%,m.p. 208℃~209℃; 1H NMR (400 MHz, DMSO-d6) δ 12.29~12.14 (m, 1H), 8.36 (d, J = 2.7 Hz, 1H), 8.03 (dd, J = 6.8, 2.1 Hz, 1H), 7.69~7.60 (m, 2H), 7.59~7.52 (m, 1H), 7.32~7.20 (m, 4H); 13C NMR (100 MHz, DMSO-d6) δ 162.73, 150.45, 136.99, 134.57, 132.72, 126.23, 125.01, 123.22, 122.20, 120.77, 118.09, 113.07, 105.48; HR-MS (ESI) m/z: calcd for C15H10BrNNaO2 {[M + Na]+} 339.9793 found 339.9763.
3.2.4. 3-三氟甲基苯基-3-吲哚甲酸酯(5d)的合成
将3-吲哚甲酸(0.51 g, 3.15 mmol)、3-三氟甲基苯酚(0.60 g, 3.72 mmol)、EDCI (0.72 g, 3.73 mmol)和DMAP (0.39 g, 3.15 mmol)溶解于20 mL二氯甲烷中,室温反应8 h。减压除去溶剂,残余物经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯 = 4/1,V/V)纯化得白色固体0.84 g,收率88.3%,m.p. 147℃~149℃; 1H NMR (400 MHz, DMSO-d6) δ 12.23 (s, 1H), 8.39 (d, J = 3.0 Hz, 1H), 8.08~7.99 (m, 1H), 7.69 (q, J = 7.8 Hz, 3H), 7.65~7.61 (m, 1H), 7.58~7.53 (m, 1H), 7.26 (tt, J = 7.2, 5.5 Hz, 2H); 13C NMR (100 MHz, DMSO-d6) δ162.67, 151.47, 137.01, 134.78, 131.19, 130.80, 127.10, 126.24, 125.57, 123.26, 122.86, 122.62, 122.25, 120.78, 113.09, 105.31; HR-MS (ESI) m/z: calcd for C16H10F3NNaO2 {[M + Na]+} 328.0561 found 328.0555.
3.2.5. 4-氰基苯基-3-吲哚甲酸酯(5e)的合成
将3-吲哚甲酸(0.50 g, 3.13 mmol)、4-羟基苯甲腈(0.45 g, 3.78 mmol)、EDCI (0.71 g, 3.71 mmol)和DMAP (0.38 g, 3.14 mmol)溶解于20 mL二氯甲烷中,室温反应8 h。减压除去溶剂,残余物经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯 = 4/1,V/V)纯化得白色固体0.69 g,收率85.2%,m.p. 202℃~203℃; 1H NMR (400 MHz, DMSO-d6) δ 12.27 (s, 1H), 8.40 (d, J = 3.1 Hz, 1H), 8.03 (dd, J = 6.6, 2.3 Hz, 1H), 7.99~7.94 (m, 2H), 7.55 (tt, J = 9.1, 2.3 Hz, 3H), 7.26 (tt, J = 7.2, 5.6 Hz, 2H); 13C NMR (100 MHz, DMSO-d6) δ 162.24, 154.81, 137.03, 134.96, 134.40, 126.21, 123.99, 123.32, 122.32, 120.75, 118.97, 113.14, 108.66, 105.16; HR-MS (ESI) m/z: calcd for C16H10N2NaO2 {[M + Na]+} 285.0640 found 285.0633.
3.2.6. 4-硝基苯基-3-吲哚甲酸酯(5f)的合成
将3-吲哚甲酸(0.50 g, 3.13 mmol)、4-硝基苯甲腈(0.52 g, 3.78 mmol)、EDCI (0.72 g, 3.73 mmol)和DMAP (0.38 g, 3.14 mmol)溶解于20 mL二氯甲烷中,室温反应8 h。减压除去溶剂,残余物经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯 = 4/1,V/V)纯化得白色固体0.73 g,收率83.7%,m.p. 215℃~216℃; 1H NMR (400 MHz, DMSO-d6) δ 12.31 (s, 1H), 8.44 (d, J = 3.0 Hz, 1H), 8.38~8.32 (m, 2H), 8.09~8.02 (m, 1H), 7.60 (dd, J = 8.9, 6.7 Hz, 3H), 7.28 (tt, J = 7.2, 5.6 Hz, 2H); 13C NMR (100 MHz, DMSO-d6) δ 162.09, 156.33, 145.03, 137.06, 135.08, 126.22, 125.61, 123.69, 123.35, 122.36, 120.75, 113.16, 105.07; HR-MS (ESI) m/z: calcd for C15H10N2NaO4 {[M + Na]+} 305.0538 found 305.0531.
4. 结论
以结构简单且活性优异的SARS-CoV-2 3CLpro抑制剂1为先导化合物,基于生物电子等排体原理设计了一系列新型吲哚苯酯衍生物,采用Discovery Studio 2021程序进行分子对接验证了设计的合理性。5b的分子对接打分结果最佳,这表明5b是潜在的SARS-CoV-2抑制剂。所有化合物均经一步酯化反应制备,采用核磁共振氢谱(1H NMR)、核磁共振碳谱(13C NMR)和高分辨质谱(HR-MS)表征了其结构。所有化合物的抗SARS-CoV-2活性研究将在中国科学院武汉病毒研究所进行。
基金项目
武汉工程大学第十六期大学生校长基金(No. 2021083)。
参考文献
NOTES
*通讯作者。