1. 引言
压水堆一回路运行条件下污垢在燃料棒上的沉积严重影响反应堆运行的经济性和安全性。硅酸盐是燃料污垢的组成成分 [1],由于具有负的溶解温度系数,在压水堆一回路中,铝、钙和镁的硅酸盐将优先沉积在温度最高的位置,即燃料棒上。研究硅酸盐的热力学性质、生成反应和生成条件等有助于深入理解硅酸盐污垢在燃料棒上的沉积行为和机理。
E-pH图常用于推断体系中反应发生的可能性、稳定固相的E-pH范围,判断是否产生沉积。本文根据文献 [2] [3] [4] 确定了在压水堆一回路冷却剂中Al-Ca-Mg-Si-H2O体系中存在的稳定固相,计算了PWR一回路冷却剂温度为553.15 K、583.15 K、613.15 K时各物质的热力学数据 [5] [6],并采用热力学手段绘制了不同体系的高温E-pH图。
2. 热力学数据计算
目前,我国对核电站压水堆一回路水环境中硅酸盐的沉积研究不多,利用热力学方法研究的就更少,且在Al-Ca-Mg-Si-H2O体系中,各物质的高温和常温的热力学数据相差较大。因此为了进一步了解硅酸盐在一回路水环境中的沉积平衡,有必要对比大量材料,获取来源可靠,相似度高的硅酸盐常温热力学数据 [7] [8] [9]。
2.1. 简单金属硅酸盐体系
2.1.1. Si-H2O体系
在Si-H2O体系中,稳定固相为SiO2 [10],在pH < 8时,溶解态固相为Si(OH)4(aq) [11],满足一回路正常运行pH条件,计算出在553.15 K、583.15 K、613.15 K的高温热力学数据见表1。

Table 1. The high temperature thermodynamic data of each substance required for calculation in Si-H2O system
表1. Si-H2O体系中计算所需各物质的高温热力学数据
2.1.2. Al-H2O体系
在Al-H2O体系,根据EPRI报告 [2],Al在一回路的稳定固相有AlOOH [12] [13],不形成含铝硅酸盐,溶解态物相有Al3+,AlOH2+,
,Al(OH)3(aq),
,计算出涉及物质在553.15 K、583.15 K、613.15 K的高温热力学数据见表2。

Table 2. The high temperature thermodynamic data of each substance required for calculation in Al-H2O system
表2. Al-H2O体系中计算所需各物质的高温热力学数据
2.1.3. Ca-Si-H2O体系
在压水堆一回路Ca-Si-H2O体系中,根据EPRI报告 [2],稳定固相为CaSiO3和Ca(OH)2,溶解态物相为Ca2+和CaOH+,计算出体系中物质在553.15 K、583.15 K、613.15 K的高温热力学数据 [8] 见表3。

Table 3. The high temperature thermodynamic data of each substance required for calculation in Ca-Si-H2O system
表3. Ca-Si-H2O体系中计算所需各物质的高温热力学数据
2.1.4. Mg-Si-H2O体系
在压水堆一回路Mg-Si-H2O体系中 [9],涉及的稳定固相有Mg2SiO4,Mg3Si4O10(OH)2和Mg(OH)2,该体系中的溶解态物相为Mg2+,MgOH+ [14] [15] [16]。计算出在553.15 K、583.15 K、613.15 K的高温热力学数据见表4。

Table 4. The high temperature thermodynamic data of each substance required for calculation in Mg-Si-H2O system
表4. Mg-Si-H2O体系中计算所需各物质的高温热力学数据
2.2. 复合金属硅酸盐体系
根据EPRI报告 [2],在一回路中首先会形成镁–铝–硅沉淀Mg5Al(AlSi3)O10(OH)8,之后会形成两种钙–镁–硅沉淀 [17] CaMg(SiO3)2,Ca2Mg5Si8O22(OH)2,因此在复合硅酸盐Al-Mg-Si-H2O体系 [18] 和Ca-Mg-Si-H2O体系中,计算出在553.15 K、583.15 K、613.15 K的高温热力学数据见表5。

Table 5. The high temperature thermodynamic data of each substance required for calculation in composite systems
表5. 复合体系中计算所需各物质的高温热力学数据
3. 高温E-pH图绘制
E-pH图,又称Pourbaix图,若给出体系中可能存在的化合物和热力学数据,即可绘制出E-pH图。从图中可判断在给定条件下电化学反应的平衡关系,进而可判断反应发生的可能性和生成物的稳定性 [19]。比利时著名腐蚀学家M. Pourbaix教授已将多种元素-H2O体系的常温E-pH图绘制成册 [20],现在一回路水环境的高温E-pH图也在逐步完善。
3.1. Si-H2O体系
根据压水堆一回路中Si-H2O体系存在的固态物质和离子态物质,列出绘制E-pH图所需的平衡反应,见表6:

Table 6. The equilibrium reaction equation in Si-H2O system
表6. Si-H2O体系的平衡反应方程
反应方程式根据吉布斯自由能变
与pH值、E的相互关系分为两类,即与E无关的反应和与E有关的反应。前者利用式(1)求出平衡条件;后者利用式(2)和(3)求出平衡条件。计算时,所有的离子态浓度选10−6 mol/L作为固液相反应的临界条件。计算所得的Si-H2O体系反应方程的E与pH的关系式,示于表7。
(1)
(2)
(3)

Table 7. The relationship formula of E and pH in Si-H2O system
表7. Si-H2O体系反应方程的E与pH的关系式
根据表7中E与pH的关系式,绘制出在553.15 K、583.15 K和613.15 K三个温度下的高温E-pH图,如图1所示。高温E-pH图中下虚线a线表示H+/H线,在a线下方是H2的稳定存在区,将会发生析氢反应;上虚线b线表示O2/H2O线,在b线上方表示O2的稳定存在区,将会发生吸氧反应,图中的短黑线为压水堆一回路正常运行的pH范围。后续全部高温E-pH图虚线和短黑线全是如此,不予赘述。
图1中显示了在553.15 K、583.15 K和613.15 K三个温度下Si-H2O体系中稳定固相和溶解态物相的稳定存在区域。结合文献 [11] 可得随温度的升高,SiO2的溶解度增大且远超硅浓度,说明从堆芯入口到堆芯出口,一回路水中硅不以SiO2形式沉积。因此在压水堆一回路正常运行条件下,稳定存在物质主要为溶解态物相
。



Figure 1. The E-pH diagrams of Si-H2O system at different temperatures (a) 553.15 K; (b) 583.15 K; (c) 613.15 K
图1. 不同温度下Si-H2O体系的E-pH图 (a) 553.15 K;(b) 583.15 K;(c) 613.15 K
3.2. Al-H2O体系
在Al-H2O体系主要的固态物质为AlOOH,列出绘制E-pH图所需的平衡反应,示于表8。利用式(1)~(3),对表8中反应方程进行平衡计算,得出E与pH的关系式,其中Al的溶解态离子浓度选取10−6 mol/L,示于表9。

Table 8. The equilibrium reaction equation in Al-H2O system
表8. Al-H2O体系的平衡反应方程

Table 9. The relationship formula of E and pH in Al-H2O system
表9. Al-H2O体系反应方程的E与pH的关系式
绘制出在553.15 K、583.15 K和613.15 K三个温度下的高温E-pH图,如图2所示。
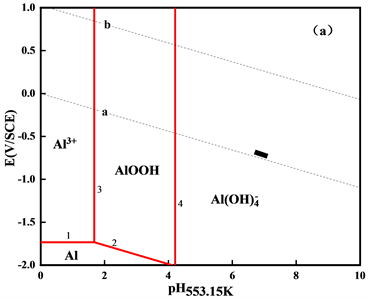

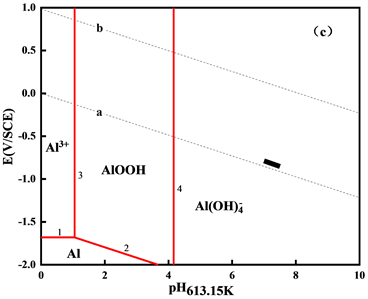
Figure 2. The E-pH diagrams of Al-H2O system at different temperatures (a) 553.15 K; (b) 583.15 K; (c) 613.15 K
图2. 不同温度下Al-H2O体系的E-pH图(a) 553.15 K;(b) 583.15 K;(c) 613.15 K
图2显示了在553.15 K、583.15 K和613.15 K三个温度下Al-H2O体系中稳定固相和溶解态物相的稳定存在区域,稳定固相为AlOOH,随温度的升高,AlOOH的稳定区域有所增大,电位范围基本不变,但其所在的pH约在1~4之间。因此,在一回路中,铝不会以AlOOH的形式沉积。在压水堆一回路正常运行条件下,即短黑线所在区域,主要为溶解态物相
。
3.3. Ca-Si-H2O体系
在一回路Ca-Si-H2O体系中,固态物质为CaSiO3和Ca(OH)2,溶解态物质为Ca2+,该体系中涉及的平衡反应列于表10。计算出反应的E与pH的关系式,其中Ca和Si的溶解态浓度均选用10−6 mol/L,示于表11。

Table 10. The equilibrium reaction equation in Ca-Si-H2O system
表10. Ca-Si-H2O体系的平衡反应方程

Table 11. The relationship formula of E and pH in Ca-Si-H2O system
表11. Ca-Si-H2O体系反应方程的E与pH的关系式
将各反应的高温E-pH图与Si-H2O体系的高温E-pH图汇总,绘制出Ca-Si-H2O体系在553.15 K、583.15 K和613.15 K三个温度下的高温E-pH图,如图3所示。
图3中显示了Ca-Si-H2O体系的稳定固相和溶解态物相的稳定存在区域,可见随温度的升高,稳定固相CaSiO3的存在区域左右pH值略有增大,说明在一回路水中发生CaSiO3沉淀生成反应的倾向性增大。这一结果表明,一回路水中的硅、钙有可能会以CaSiO3的形式在燃料的上部沉积。


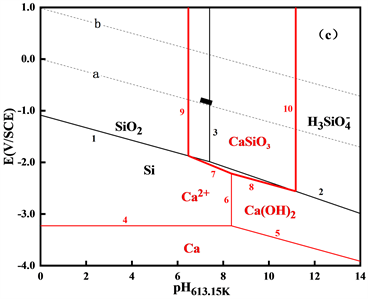
Figure 3. The E-pH diagrams of Ca-Si-H2O system at different temperatures (a) 553.15 K; (b) 583.15 K; (c) 613.15 K
图3. 不同温度下Ca-Si-H2O体系的E-pH图(a) 553.15 K;(b) 583.15 K;(c) 613.15 K
3.4. Mg-Si-H2O体系
在压水堆一回路Mg-Si-H2O体系中,固态物质为Mg2SiO4,Mg3Si4O10(OH)2和Mg(OH)2,溶解态物质为Mg2+,该体系中涉及的平衡反应列于表12。计算出反应的E与pH的关系式,其中Mg和Si的溶解态浓度均选用10−6 mol/L,示于表13。


Table 12. The equilibrium reaction equation in Mg-Si-H2O system
表12. Mg-Si-H2O体系的平衡反应方程

Table 13. The relationship formula of E and pH in Mg-Si-H2O system
表13. Mg-Si-H2O体系反应方程的E与pH的关系式
绘制出Mg-Si-H2O体系在553.15 K、583.15 K和613.15 K三个温度下的高温E-pH图,如图4所示。


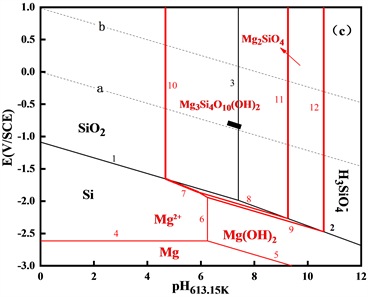
Figure 4. The E-pH diagrams of Mg-Si-H2O system at different temperatures (a) 553.15 K; (b) 583.15 K; (c) 613.15 K
图4. 不同温度下Mg-Si-H2O体系的E-pH图(a) 553.15 K;(b) 583.15 K;(c) 613.15 K
图4中显示了Mg-Si-H2O体系的稳定固相和溶解态物相的稳定存在区域,可见稳定固相Mg2SiO4,Mg3Si4O10(OH)2所占区域较大,随温度的升高,稳定区域有所增加,即pH值的稳定范围有所增加,电位的稳定范围基本不变,进行沉淀生成反应的倾向性增大。
同时,短黑线位于稳定固相区域中间,说明在压水堆一回路正常运行条件下,稳定固相不易发生溶解释放,这一现象与EPRI报告 [2] 中“镁与硅基本完全沉淀为Mg3Si4O10(OH)2”的结论一致。因此,一回路水中的硅、镁有可能会以Mg2SiO4和Mg3Si4O10(OH)2的形式在燃料的上部沉积。
3.5. Al-Mg-Si-H2O体系
对于压水堆一回路Al-Mg-Si-H2O体系,是在单一金属硅酸盐高温E-pH图的基础上,新增的复合硅酸盐固态物质为Mg5Al(AlSi3)O10(OH)8,该体系中涉及的平衡反应方程列于表14。计算出反应的E与pH的关系式,其中Al、Mg和Si的溶解态浓度均选用10−6 mol/L,示于表15,其中表14反应式1~11的E-pH关系在上方有所计算,在此不予赘述。

Table 14. The equilibrium reaction equation in Al-Mg-Si-H2O system
表14. Al-Mg-Si-H2O体系的平衡反应方程

Table 15. The relationship formula of E and pH in Al-Mg-Si-H2O system
表15. Al-Mg-Si-H2O体系反应方程的E与pH的关系式
绘制出Al-Mg-Si-H2O体系在553.15 K、583.15 K和613.15 K三个温度下的高温E-pH图,如图5所示。
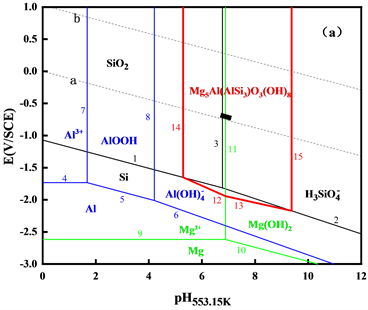


Figure 5. The E-pH diagrams of Al-Mg-Si-H2O system at different temperatures (a) 553.15 K; (b) 583.15 K; (c) 613.15 K
图5. 不同温度下Al-Mg-Si-H2O体系的E-pH图(a) 553.15 K;(b) 583.15 K;(c) 613.15 K
图5显示了Al-Mg-Si-H2O体系中在三个温度下固相和溶解态物相的稳定存在区间,复合硅酸盐Mg5Al(AlSi3)O10(OH)8的稳定区域较大,随温度的升高,Mg5Al(AlSi3)O10(OH)8的稳定区间范围略有增加,说明进行沉淀生成反应的倾向性增大。同时,短黑线位于稳定固相区域中间,说明该硅酸盐沉淀易发生沉积。因此,一回路水中的Si、Mg、Al有可能以Mg5Al(AlSi3)O10(OH)8的形式沉积。
3.6. Ca-Mg-Si-H2O体系
压水堆一回路Ca-Mg-Si-H2O体系在之前单一硅酸盐体系的基础上,新增两个固态物质CaMg(SiO3)2和Ca2Mg5Si8O22(OH)2,涉及的所有反应方程式见表16。计算出反应的E与pH的关系式,其中Ca、Mg和Si的溶解态浓度均选用10−6 mol/L,示于表17,其中单一硅酸盐体系的反应式1~9的E-pH关系在上方有所计算,在此不予赘述。

Table 16. The equilibrium reaction equation in Ca-Mg-Si-H2O system
表16. Ca-Mg-Si-H2O体系的平衡反应方程

Table 17. The relationship formula of E and pH in Ca-Mg-Si-H2O system
表17. Ca-Mg-Si-H2O体系反应方程的E与pH的关系式
绘制出Ca-Mg-Si-H2O体系在553.15 K、583.15 K和613.15 K三个温度下的高温E-pH图,如图6所示。



Figure 6. The E-pH diagrams of Ca-Mg-Si-H2O system at different temperatures (a) 553.15 K; (b) 583.15 K; (c) 613.15 K
图6. 不同温度下Ca-Mg-Si-H2O体系的E-pH图(a) 553.15 K;(b) 583.15 K;(c) 613.15 K
图6中显示了三个温度下Ca-Mg-Si-H2O体系中固相和溶解态相的稳定存在区域,固态物质CaMg(SiO3)2和Ca2Mg5Si8O22(OH)2稳定区域占较大部分。随温度的升高,两个稳定固相区域均有增大,说明固相稳定性较强,进行沉淀生成反应的倾向性增大,在一回路水中两种固相均有可能发生沉积。
同时,短黑线位于固相Ca2Mg5Si8O22(OH)2稳定区域中间,说明在一回路水中Ca2Mg5Si8O22(OH)2比CaMg(SiO3)2更容易沉积。
4. 结论
运用热力学方法绘制出在553.15 K,583.15 K,613.15 K三个温度下、六个体系的高温E-pH图。在压水堆一回路正常运行条件下,Si-H2O和Al-H2O体系中稳定存在的是溶解态物质
和
。其余四个体系在pH = 6.7~7.5时,稳定存在的是固态物质,且随温度从553.15 K升高至613.15 K,各体系的稳定固相区域均有增大,说明温度升高,固态物质的生成反应的倾向性更大,沉淀也更易沉积在燃料棒上。
NOTES
*通讯作者。