1. 引言
金莲花,学名为Trollius chinensis Bunge,是毛茛科金莲花属的植物。有旱地莲、金梅草、金疙瘩以及金芙蓉的别名。是多年生草本。金莲花属植物共25种,其中我国有16种,主要分布在东北、西北、华北、西南和台湾等地 [1]。金莲花以及同属植物短瓣金莲花T. ledebouri Reichb.e、阿尔泰金莲花T. altaicusL.、川陕金莲花T. buddae Schipcz.等有较多资源开发利用的研究。它们是很好的装饰用花卉,也可构成窗景;也具药用功能。其药用功能最早载于《本草纲目拾遗》中,其味苦、性寒、无毒,它主治口疮喉肿、耳痛目痛、浮热牙宣、明目、解岚障 [2];在《山海草函》中,它可以用于治疗疔大毒以及诸风;《河北中药手册》中可用于清热解毒;金莲花的许多传统病症的临床意义还未经过试验得出结论,但是在近代研究中,金莲花通过试验充分证明主要具有抗肿瘤、抗炎、抗氧化以及抗菌、抗病毒的临床意义。
近几年来,通过学者们的研究,金莲花的临床作用范围也在不断扩大。如,在2019年新冠爆发之后,2020年赓迪等学者研究发现金莲花具有抗新型冠状病毒的潜力 [3];2022.05张天泽等学者通过物质基础研究发现金莲花抗EV71病毒(肠道病毒71型) [4] 等。金莲花的临床作用与其化学成分息息相关,金莲花主要化学成分为黄酮类、有机酸类、生物碱类、香豆素类、甾醇类、苯乙素类、多糖类和神经酰胺类等化合物 [5]。其中,黄酮类成分含量最高,约占全花干重的16%,主要为黄酮碳苷。而荭草素和牡荆素是金莲花中最重要的两个黄酮碳苷,连同它们的衍生物约占总黄酮的三分之二 [6]。
学者们不断地剖析金莲花中的有效成分,对其起到了重要的临床意义。为了进一步挖掘其潜在的临床应用和新药开发价值,本文通过将金莲花药理作用以及临床应用方面的近年的相关文献进行整合,以期为促进该药材的临床合理应用和新药研发提供参考。
2. 抗肿瘤
金莲花的成分里主要包含了黄酮类成分、生物碱类以及有机酸类成分,其中黄酮类化合物起到主要的药理作用,抗癌是黄酮类成分其中一个药理作用,它可以抑制大多数癌细胞活跃,例如乳腺癌MCF-7细胞、肝癌HepG2细胞、肠癌细胞等。
2.1. 金莲花对乳腺癌MCF-7细胞的抑制作用
孙黎、刘芳等学者在2008年的一篇探讨金莲花黄酮对人乳腺癌MCF-7细胞增殖及对端粒酶活性的影响的文献 [7] 中,详细探讨了金莲花是如何作用于人体MCF-7细胞,从而抑制乳腺癌细胞增殖的过程。在该实验中,研究者首先将金莲花清洗、烘干,粉碎获得粉末后再经过回流提取的方法得到金莲花黄酮。再在DMEM培养液中培养出MCF-7细胞,采用CCK-8的方法检测金莲花中的黄酮含量有多少,以及不同浓度的金莲花黄酮对MCF-7细胞的影响。结果表明了金莲花黄酮对乳腺癌细胞具有作用,可以抑制人乳腺癌MCF-7细胞的活性,具有临床意义。
在其他学者进一步研究过程 [8] [9] [10] 中,发现金莲花中的黄酮类成分主要是总黄酮通过下调NF-B和bcl-2蛋白表达,激活caspase-3, 9蛋白,后诱导人乳腺癌MCF-7细胞凋亡,抑制其增殖。在这个过程中,PARP-1/p53信号通路在细胞增殖、周期调控及凋亡等过程中发挥重要作用。金莲花总黄酮对乳腺癌MCF-7细胞的抑制效果与时间以及剂量的增长相关联,产生影响。在0.0991~1.5856 mg·mL−1浓度范围内,金莲花总黄酮能够明显抑制乳腺癌MCF-7细胞的增殖,并随药物浓度的增的增加,抑制作用逐渐增强。以发酵大豆异黄酮活性研究中的评价标准为准,抑制率P < 30%为弱效,30% < P < 50%为中等效果抑制率,P > 50%为强效抑制率。本实验中,药物浓度为1.5856 mg·mL−1,作用MCF-7细胞24 h时,细胞的增殖抑制率为59.2%,已经达到强效抑制率,细胞凋亡特征体现较为明显。
2.2. 金莲花对肝癌HepG2细胞的抑制作用
除此之外,金莲花中的总黄酮对处于高浓度葡萄糖环境下肝癌HepG2细胞有一定的作用 [11]。NAFLD非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)的有害影响正成为全球公共卫生日益面临的挑战,NAFLD是西方世界最常见的慢性肝病,其在中国发生率高达29.2%,且呈逐年增加趋势,并出现低龄化趋势,严重威胁人民健康,NAFLD与代谢紊乱密切相关,包括中心型肥胖、血脂异常、高血压、高血糖和肝功能测试的持续异常 [12]。
而高脂可诱导HepG2肝癌细胞的表达 [11] [12] [13]。而在樊锐锋等学者一起开展的关于金莲花总黄酮对高糖诱导下HepG2细胞功能影响的研究中显示了金莲花的总黄酮成分通过影响HepG2能够对该疾病起到一定的疗效。该研究中采用了细胞组培的方法,对比了高浓度葡萄糖和不同剂量的金莲花总黄酮对HepG2细胞的影响,从而得出结论,肝细胞内氧化应激水平及HepG2中的活性氧簇(ROS水平)的代谢平衡与细胞内的脂肪蓄积密切相关,脂类物质积累与ROS水平成正比,脂类物质积累越多则ROS水平越高。高浓度葡萄糖促使ROS水平升高,金莲花总黄酮则会降低其水平,也就是说金莲花总黄酮可以降低体外细胞内的脂类物质积累。从而对NAFLD起到一个较好的疗效。
2.3. 金莲花对人食管癌EC-109抑制作用
2013年,朱登祥、安芳、王书华三位学者进行了研究《金莲花中荭草苷和牡荆苷对人食管癌细胞生长及凋亡的影响》 [14],文中通过以下方法,清晰的讲述了金莲花中的黄酮类荭草苷、牡荆苷是如何作用于人食管癌EC-109细胞。他们三者用不同浓度荭草苷、牡荆苷一一对应作用于对数生长期的EC-109细胞,通过CCK-8法检验其对EC-109细胞体外生长、增殖的抑制作用;后通过凋亡试剂盒Hoechest33258荧光染色细胞形态观察、琼脂糖凝胶电泳检测DNA Ladder、AnnexinV-FITC/PI-FCM检验荭草苷和牡荆苷诱导EC-109细胞凋亡情况。得出结论荭草苷和牡荆苷皆可抗EC-109食管癌细胞生长并诱导凋亡作用,其功效良好,且相同浓度荭草苷的作用强于牡荆苷。
3. 抗炎症
金莲花中的抗炎活性成分主要是黄酮类成分以及酚酸类成分,其作用机制主要通过调节腔道黏膜的免疫状态,从而增加机体的抗感染能力,改善机体的恢复能力及免疫力 [15]。通过比较金莲花总提取物、总黄酮、总酚酸对NO (激活巨噬细胞杀灭病原微生物及肿瘤细胞的效应分子,是重要的炎性介质,过量的NO对宿主细胞产生不良影响,引发炎症)产生的影响得知体外金莲花黄酮类的活性要稍强于酚酸类,但是金莲花酚酸类的机体吸收好于黄酮类,吸收入体内,酚酸类的含量要远远高于黄酮类 [16]。
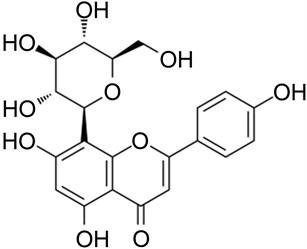

牡荆苷 荭草苷
3.1. 金莲花治疗鼻黏膜炎性疾病的临床研究概况
金莲花除了体内的黄酮类具有抗肿瘤的临床作用,其体内的刺槐素、槲皮素和β-谷甾醇还可以调节呼吸道黏膜的免疫状态,从而增加机体的抗感染能力,改善机体的恢复能力及免疫力。


槲皮素 刺槐素

β-谷甾醇
江燕、张耀军等学者在今年3月份发布的一篇文献 [17] 中讨论了金莲花治疗鼻黏膜炎性症状的几例具体临床试验,以具体的量化结果,即金莲花治疗呼吸道感染的有效率,有效证明金莲花治疗该疾病具有良好疗效,并且为下一步金莲花治疗该炎症的具体病因以及发病机制提供了初步理论基础。目前,国内关于金莲花已有的研究 [18],认为金莲花在治疗包括鼻黏膜炎性疾病在内的上呼吸道感染性疾病时,是通过多成分、多靶点、多通路发挥抗炎机制的,黄酮类化学成分中槲皮素、刺槐素及β-谷甾醇3个活性成分在上呼吸道发炎的情况起到主要的治疗作用,有14个靶标和10条信号通路起作用,分别为MAPK1、AKT1、TP53、TNF、IL6、STAT1、TGFB1、IFNG、NFKBIA、CXCL8、MYC、CASP8、IL10、CASP3靶标,14个靶点中起治疗作用的核心作用靶点是TNF、10条信号通路有癌症因子、乙型肝炎、NTF、肺结核、癌症蛋白聚糖、恰加斯病、弓形虫病、单纯疱疹感染、甲型流感及利什曼病信号通路,而癌症因子通路可能是关键作用通路。不过,国内的研究数据目前还不够完善,难以为金莲花治疗鼻黏膜的作用机制以及靶点提供有效证明。
3.2. 金莲花治疗上呼吸道感染的临床研究概况
以具体的量化结果即金莲花治疗呼吸道感染的有效率,有效证明金莲花治疗该疾病具有良好疗效,并且为下一步金莲花治疗该炎症的具体病因以及发病机制提供了初步理论。
除了治疗鼻黏膜炎症,其体内的槲皮素,针对上呼吸道感染并这个也有较好的疗效 [18]。
在2021年,林琦琪和赵楠等人 [19] 开展了一项关于金莲花对上呼吸道感染的治疗作用的研究。文中主要是采用的方法是通过总结2020年8月以前的所有含金莲花以及上呼吸道感染关键词的文献,并将其做一个归纳总结,提取数据后再RevMan5.3软件进行质量评价和分析。通过文中总结的数据可以看出金莲花中成药对上呼吸道感染的治疗相对于其他药物而言,极有成效。但是目前,国内的文献大多数并没有对金莲花中成药治疗该疾病的不良反应做出解释,实验结果不完善。
4. 抗菌、抗病毒
金莲花的抗病毒机制主要是通过阻断病毒与受体结合、抑制细胞因子/趋化因子的反应等 [20]。起到抗病毒作用的主要有效成分有荭草苷、牡荆素、柳穿鱼黄素、芹菜素、槲皮素、木犀草素、β-谷甾醇、生物碱、藜芦酸、原金莲酸等。
4.1. 金莲花对人冠状病毒体外感染的抑制作用
金莲花除治疗肿瘤、炎症两种临床疾病,它也常用于病毒体,具有抗病毒的临床作用。
2019年12月新冠病毒以不可阻挡之势席卷全球,各国学者纷纷站出来,开展化学实验及临床试验在新冠上为人类献出一份力,全球多个国家相继研发出多种类型的新型冠状病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)疫苗 [21]。
在2022年年终为止,有多种可以感染人类的冠状病毒毒株,其中人冠状病毒OC43感染后可引发人体普通感冒症状。在毛鑫以及古淑尹 [22] 等学者研究中,他们采用噻唑蓝(MTT)法检测JS对HRT-18细胞的安全剂量,以及用反转录的聚合酶链式反应(RT-PCR)法检测JS给药前后对OC43体外感染的抑制作用。最终得出结论,金莲花通过调节Toll样受体(TLRs),发挥抗病毒作用,通过理论以及实验调查得出其主要活性成分可能为牡荆素、荭草素、金莲花碱、藜芦酸、牡荆素-2″-O-β-L-半乳糖苷。本研究初步验证了金莲花软胶囊对于人冠状病毒OC43体外感染的抑制作用。JS可以明显抑制OC43的体外感染。
4.2. 金莲花抗流感病毒的活性研究
2020年王腾宇等学者 [23] 对金莲花汤全方及拆方的抗流感病毒活性进行研究,证明组方的合理性。他们采用噻唑蓝(MTT)法测定金莲花汤全方及各缺味金莲花汤的抗流感病毒有效率。得到结果:金莲花汤具有良好的抗流感病毒活性。金莲花对全方抗流感病毒活性有作用,但影响相对较小,不过金莲花全方的抗病毒贡献必不可少。
在早年,林秋风等学者采用柱层析等色谱分离手段从金莲花中得到3个纯化合物 [24],再通过UV、IR、1H-NMR等现代波谱技术分别鉴定为原金莲酸、牡荆甙和荭草甙,对三种总黄酮样品分别进行抑菌、抗病毒活性研究。其结果表明,总黄酮、牡荆甙和荭草甙对金黄色葡萄球菌和表皮葡萄球菌有很好的抑制效果,对副流感病毒有强的抑制作用。
5. 其他
金莲花的临床治疗范围非常广泛,主要源于它的有效成分。金莲花的主要药效成分为黄酮类和酚酸类成分,尤其是荭草苷、牡荆苷、荭草素-2″-O-半乳糖苷3个单体成分的药效较广且研究较多 [25]。
金莲花体内含有的总黄酮化合物除了可以治疗癌症,如乳腺癌和肝癌以外,总黄酮中含量较高的红草苷和牡荆苷还具有抗氧化、抗衰老的作用 [26];荭草素2″-O-β-L-半乳糖苷也是发挥抗炎作用的物质基础之一 [27]。
在2012年的一篇文章中 [28] 还提及到了该中药材中的总黄酮类成分可能有助于在治疗急性呼吸窘迫综合征等的临床应用。学者们通过对金莲花的乙醇提取物进行研究分离出两种新的黄酮C-糖苷以及10种已知化合物。后在各种光谱分析(包括1D和2D NMR光谱,高分辨率电喷雾电离质谱)和化学基础上,将新化合物的结构确定为6'-(3-羟基-3-甲基谷丙酰基)-2β“-O-β-d-半乳糖吡喃糖基牡丹素和6'-(3-羟基-3-甲基戊六酰基)-2”-O-β-d-半乳糖吡喃糖基牡丹素。最终的生物测定表明,8种类黄酮在体外抑制经典途径上的补体活化,其IC50值范围从0.88到4.02 mM,得出结论该中药材可能有助于在治疗急性呼吸窘迫综合征等的临床应用。
它体内还含有藜芦酸和黄铜碳苷等有机酸类化合物,具有抗炎的作用,在临床上,可联合阿莫西林钠克拉维酸钾用于小儿急性扁桃体炎 [29],起到缩短治疗时间,增加疗效的作用。
金莲花除了具有以上的临床疗效,其粗提物的抗病毒机制还可以通过干预TLR3信号通路,减少炎症因子的分泌,保护人体免受炎症损伤 [30]。
6. 结语与展望
金莲花是一味临床潜力极大的中药材。国内对于金莲花的相关研究还不够多,对于许多用药的副作用的了解并不完善。我们需要做更多的实验以此来探讨金莲花背后的机理、病因、作用机制,为其提供强有力的证明。再通过这些机理运用于临床,找到其临床意义,从而制成不同的药物,治疗更多的病症。如今疫情的形势依然十分严峻。
临床研究表明,国内目前采用的SARS-CoV-2疫苗对COVID-19疫情控制,尤其是控制重症病例发生率及死亡率起极大作用。但是随着SARS-CoV-2传播,进化出数种突变株,导致疫情防控形式变得尤为严峻。其中SARS-CoV-2 Delta突变株(B.1.617.2)是目前导致SARS-CoV-2疫苗突破感染的主要突变株,其感染者的病毒载量大,传播能力强,甚至出现逃避免疫现象,对当前疫情防控及疫苗研发提出了新的挑战。
面临这样窘困的局面,对于具有良好的抗病毒作用机制的金莲花,人们对它抱有了极大的希望,期望学者们能够在不断地研究以及实验中激发它新的潜能,为新冠尽一份力。
基金项目
国家重点研发项目“人参等道地药材品种资源收集筛选及繁育技术研究与示范(2021YFD1600901)”;“黑龙江省中医药经典普及化研究专项课题(ZYW2022-081)”。
NOTES
*通讯作者。