1. 前言
目前,许多研究开展探究植物种子油的成分和功效。作为我国特有的物料作物,文冠果种子含油量大,富含不饱和脂肪酸,可有效预防高血脂、高血压、血管硬化等病症。相较于传统的植物种子油提取方法,如机械压榨法、有机溶剂萃取法、蒸馏法等,设备成熟,工艺简单,但存在提取率低、损伤有效物质生物活性的缺点。作为一项环境友好型的高效油脂提取技术,以二氧化碳膨胀乙醇(CO2-expanded ethanol, CXE)和超临界二氧化碳为代表的加压流体提取更符合时代发展趋势。然而,由于加压流体提取传质过程复杂、影响因素较多,亟需探索可用于帮助流程设计和预测的工具。这项工具便是对提取过程进行动力学建模,评估系统在各种操作条件下的性能,改进工艺流程。此外,将可视化微观显影技术应用于加压流体提取动力学加以辅助,更直观地观察油脂释放动力学过程。
2. 文冠果种子油脂资源概述
2.1. 文冠果种子油脂成分及功能分析
文冠果(Xanthoceras sorbifolia Bunge)属于无患子科、文冠果属,是我国特有的油料树种,种植的总面积超过50,000公顷,文冠果的干种子生物量为0.23~0.69 g、种子长12.16~16.73 mm,种仁约占种子的52.62%。文冠果是一种珍贵的木本油物作料,可用于提取食用油和药用成分,生产生物燃料以及用于沙漠绿化。
根据Ling-Biao Gu等人 [1],文冠果种子具有非常高的产油潜力,油提取率高达61.28%。文冠果种子油中主要脂肪酸为棕榈酸(C16:0) (4.8%)、油酸(C18:1) (27.7%)、硬脂酸(C18:0) (1.9%)、亚油酸(C18:2) (38.2%)、二十碳烯酸(C24:1) (10.07%)、芥酸(C22:1) (8.7%)、神经酸(C24:1) (3.6%)。其他次要脂肪酸如肉豆蔻酸(C14:0)、棕榈油酸(C16:1)、花生酸(C20:0)的含量均小于1%。脂肪酸含量的组成也与Yulong Huang等人之前的报道的值一致。此外,文冠果种子油的高不饱和脂肪酸(85%~93%)含量,可以与市场上一些高不饱和脂肪酸植物食用油相媲美,如葵花籽油、花生油、菜籽油,这表明文冠果种子油可以作为常规植物油的良好替代品。其次,文冠果种子油的亚油酸(38.2%)含量很高,有利于营养和医药应用,具有保护心肌、抗菌和抗糖尿病的作用,油中还含有较多的神经酸(3.6%),这为文冠果种子油提供了调节脑细胞、增强思维记忆的功能。第三,种子油中生育酚含量丰富,抗氧化活性能力强。
因此,富含不饱和脂肪酸的文冠果种子油可以被视为许多其他植物油的健康替代品。此外,文冠果可以广泛种植于干旱、寒冷等不良环境,并且其酸值低(0.5),油量高,是作为生物柴油生产的优质原料。
2.2. 文冠果种子油脂提取技术研究进展
食用植物油通常采用一些传统的提取方法,如机械压榨法、溶剂提取法以及蒸馏法等。然而机械挤压可能会降低活性化合物的保质期,并且提取率低;溶剂提取法通常使用有机溶剂,虽然提取率较高,但由于能源和水的消耗高,成本高,高温过程可能对生物活性成分造成损害 [1]。随着高效、绿色油脂提取技术的需求不断增加,加压流体提取(PLE)技术已成为从植物基质中提取油脂的替代技术。表1为不同方法提取文冠果种子的比较研究。

Table 1. Comparative study of different extraction methods of seed oil from Xanthoceras sorbifolia
表1. 不同方法提取文冠果种子油的比较研究
加压流体包括超临界CO2(SC-CO2)、二氧化碳膨胀乙醇(CXE) [6] 等,加压流体提取因其缩短了提取时间,减少了有机溶剂的消耗,也适用于热敏性物质的提取,已成为从天然产物中提取生物活性物质,生产更清洁的提取物和环境友好的一种优越替代技术。在用于加压流体萃取的各种溶剂中,如二氧化碳、水、乙烷、丙烷、丁烷和乙醇,超临界CO2是应用最广泛的,因为CO2在室温和大气压力下是一种气体,在萃取结束时很容易去除。二氧化碳在萃取中的其他用途是,它发挥非破坏性的作用,从而防止萃取化合物的改变。SC-CO2萃取在选择性分离天然物质中的生物活性和热敏性成分时发挥实际效用,在产品质量方面成为一种有吸引力的技术。更具体地说,食品、化妆品和制药行业对植物提取物使用量的增加,使得使用加压流体提取技术在产品质量方面比传统提取工艺更具吸引力。
3. 加压流体提取动力学模型研究进展
3.1. 加压流体提取概述
加压流体提取已被证明对各种固体基质在技术上和经济上都是可行的。这一事实可以通过全球安装的工业超临界提取(SFE)装置数量的增加得到证实。尽管如此,对于某些生物多样性丰富的国家来说,这项技术尚未在工业上使用。原因之一在于加压流体提取过程影响因素较多以及传质过程较复杂,影响因素如温度、压力、种子粒径等等。此外SFE装置所需的投资较高,因此,需要可用于帮助流程设计和预测的工具。这种工具之一是对提取容器内发生的提取现象进行动力学建模 [7]。对加压流体提取过程进行建模分析以优化提取过程变量是必要的。Sovová [8] 提出了一种用于植物油提取过程的破碎和完整细胞模型,其中研究了葡萄籽研磨效率、溶剂流速和流动方向对提取过程的影响。加压流体提取建模作为一种工具,有助于预测其总产率并提高化合物的选择性。对于提取建模的实施,有必要了解每个输入变量在过程中的作用以及它们的相互作用,以便后续的正确表示。实验数据的数学建模是工程和应用科学领域的一项常见任务,许多动力学提取模型可以在专门的科学文献中找到。这允许开发假设、考虑和调整,以便更好地模拟模型近似观察到的现象。一旦模型得到验证,它就可以评估系统在各种操作条件下的性能,而无需额外的实验,这有助于改进工艺流程。
3.2. 加压流体提取传质过程及影响因素
加压流体提取过程中,溶质和固体结构之间的相互作用,可能涉及到不同的相平衡。通常情况下,如果溶质与基质没有相互作用,则很容易考虑平衡溶解度。另一方面,如果无法忽略溶质–基质相互作用,那么提取率应取决于分析物如何结合到固体基质上,例如在固体结构的外表面或内部,应考虑溶质从基质中的解吸及其在SC-CO2和固体基质之间的分配平衡。除了分析物相平衡之外,SC-CO2的提取速率很大程度上取决于传质系数,其特征在于轴向分散、外部传质系数和内部传质系数(或固体基质中的溶质扩散系数)。
加压流体提取种子油的重要参数是温度、压力 [9]、溶剂流速 [10]、种子粒径,这些参数对SFE中提取物产率的影响很大。
3.3. 破碎和完整细胞(BIC)模型
对于大多数加压流体提取工艺,要提取的天然材料通常在装入提取釜之前经过研磨、碾磨、压碎等预处理。基于这个原因,Sovová [8] [11] 提出的在破碎细胞和完整细胞的概念中引入数学模型来描述天然物质的提取过程是非常合理的,因此Sovová开发了一个破碎和完整的细胞(BIC)模型。BIC模型是最为广泛采用的模型,专门用于需要研磨前处理的固体物料,固体颗粒由完整的细胞和破碎的细胞共同组成。它成功地用于各种溶质的加压流体提取(PLE),如洋甘菊精油 [12]、葡萄籽、向日葵、番茄和花生。
BIC模型适用于以下情况:由于对物料进行机械研磨预处理,部分分析物位于颗粒外表面或破裂的细胞中,PLE溶剂容易接近,而其余分析物位于孔结构或完整细胞的深处,PLE溶剂不易接近。
溶质在PLE溶剂中的溶解度对于评估该工艺的可行性和有效性非常重要。通过实验测定固体在PLE中的溶解度并不是一项容易且廉价的任务,而BIC模型可以关联和预测固体在PLE中的溶解度。该模型也考虑了流体和固相中的传质阻力 [13]。假设破碎细胞的萃取速率比许多完整细胞的萃取速率要快,因为细胞壁引入了额外的传质阻力,在破碎的细胞中,传质机制是对流,而通过完整的内核则是分子扩散。
在BIC模型中,还假设在整个萃取过程中温度和压力恒定,填充床中的粒径和溶质分布均匀,萃取过程中的孔隙率恒定,轴向分散可以忽略。根据BIC模型,PLE萃取过程可以分为三个阶段:恒定提取率(CER)阶段、下降提取率(FER)阶段、扩散控制(DC)阶段。
为了真实地描述植物物质结构,破碎和完整细胞的概念被发展成BIC模型,该模型已被Reverchon和Marrone [14] 验证。这些研究人员利用扫描电子显微镜成功地识别了颗粒表面的破碎细胞,假设破碎细胞在颗粒表面形成单层,就可以很容易地确定不同植物种子的破碎细胞与完整细胞的比例。BIC模型考虑了溶质在溶剂相中的溶解度、流体和固相中的传质系数。从物理上讲,BIC模型通过提出破碎和完整细胞的概念,合理地描述了初始快速提取期后提取率的突然降低。这实际上得到了许多油料种子例子的支持,在这些例子中,提取装置出口处的溶质浓度在提取的早期阶段接近恒定,然后随着提取过程逐渐下降。得到的解析模型极大地简化了从整体提取曲线计算模型参数的过程。因此它是迄今为止使用最广泛的模型。
3.4. 收缩核(SC)模型
收缩核(SC)模型描述了不可逆解吸和扩散在多孔固体中通过孔隙的情况。当内部未被提取的溶质的传质速率远低于外部已被提取的溶质,或溶质浓度远高于溶质在溶剂相中的溶解度时,形状边界可能存在于外部和内部区域之间。以下假设用于开发提取模型:
1) 萃取系统是等温和等压的。
2) 物料是一种多孔材料,其中溶质均匀分布在整个固体颗粒中。
3) 超临界流体的物理性质在萃取过程中是恒定的。
4) 考虑轴向分散,而径向分散由于提取单元直径较小可以忽略。
5) 提取是不可逆解吸。
SC模型已广泛用于模拟植物种子基质的SFE过程,例如芝麻、葵花籽、油菜籽、肉豆蔻种子、葡萄籽等。除了工艺参数外,基于SC模型计算的其他因素也可能影响提取过程,如微观结构、干燥和流动类型。Valle等人 [15] 使用SC模型研究了经过各种高剪切预处理的种子对植物油内部传质的微观结构影响,并探索了微观结构和可提取性关系在模拟SC-CO2提取中的应用。此外,Balachandran等人 [16] 研究了从新鲜、烘干和冷冻干燥的生姜样品中超临界提取油。他们发现,与其他两种干燥样品相比,富含水分的新鲜生姜根茎的提取率更高,提取物更辛辣更具自然风味。SC模型的模拟结果证实,这种产量提高可能主要是由于生姜颗粒内有效扩散率的提高,并且一旦使用干燥的生姜样品,传质速率就会下降。
4. 可视化显影在加压流体提取动力学中的研究进展
4.1. 扫描电镜在加压流体提取动力学中的应用
加压流体提取动力学数学模型参数也与种子的微观结构有关,特别是与含油细胞的几何特征。这些细胞不应与微小的生物细胞混淆。为了获得这些数据,对种子颗粒进行了系统的扫描电镜分析。种子结构分析表明,所研究的各种种子的含油细胞具有不同的形状和大小。种子的SEM图像,如图1和图2所示,分别是香菜种子和葡萄种子的微观结构 [14]。在这些情况下,细胞是球形的,不含任何油,因为图像是由SFE处理的材料拍摄得到的。然而,一些淀粉团聚体仍然存在,并形成小的球形颗粒位于植物结构内部,因为淀粉是不能被超临界二氧化碳提取的。为了评估颗粒表面破碎细胞的总体积,我们通过SEM图像首先确定了球形颗粒面积与单个破碎细胞面积的比值,从这个值,并对细胞的形状做简单的几何考虑,我们可以得到细胞的体积以及粒径。

Figure 1. SEM image of coriander seed particles
图1. 香菜籽颗粒的SEM图像
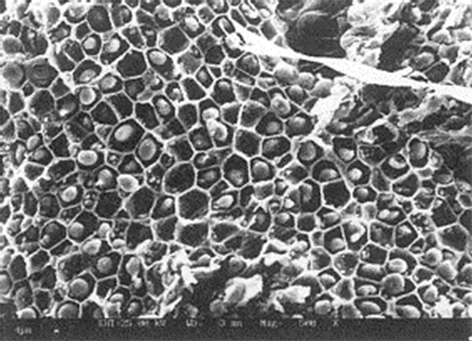
Figure 2. SEM image of grape seed particles
图2. 葡萄籽颗粒的SEM图像

Figure 3. DNA fragmentation associated with programmed cell death in wild-type and mutant anthers determined by TUNEL. Red signals indicate propyl iodide staining, and yellow and green fluorescence indicate TUNEL positive signals
图3. 通过TUNEL测定野生型和突变花药中的程序性细胞死亡相关的DNA片段化。红色信号表示碘化丙啶染色,黄色和绿色荧光表示TUNEL阳性信号
4.2. 油脂染色技术在加压流体提取动力学中的应用
进一步结合油脂染色技术 [17] 和荧光显影观测研究加压流体提取动力学过程分析,可以更直观地监测传质过程中油脂的释放机制。PJ Harris [18] 等用紫外荧光显微镜观察黑麦草未成熟节间的横切面,发现所有的细胞壁都发出蓝色荧光,来研究阿魏酸(肉桂酸的衍生物之一)与多种禾本科牧草细胞壁的多糖结合。Taotao Zhu等人用荧光显微镜结合TUNEL测定(原位缺口末端标记法)检测与野生型花药和突变花药中的程序性细胞死亡相关的DNA片段,发现在突变花药中绒毡层细胞程序性死亡(PCD)过早开始,与绒毡层细胞的早期自噬一致,如图3 [19] 所示。
Kevin Vidot [20] 等开发了一种荧光染色方法,然后通过激光扫描共聚焦显微镜(LSCM)进行冷冻固定和冷冻观察,并将其应用于苹果果实皮层和鲜食葡萄浆果,作为肿胀植物器官的模型。P. Lopez-Ordaz等 [21] 利用激光共聚焦显微镜,探究热超声提取对蓖麻油品质及其残留饼粕微观结构的影响(图4)。

Figure 4. Identification of cellulose-hemicellulose (blue), protein (green), lipid (red) and composite images by confocal laser scanning microscope; (a) natural castor seeds and (b) residual cake after oil extraction by Soxhlet method. The scale corresponds to 10 μm
图4. 激光共聚焦扫描显微镜图像鉴定纤维素–半纤维素(蓝色),蛋白质(绿色),脂类(红色)及综合图像;(a) 天然蓖麻籽;(b )索氏法提取油脂后的残饼。刻度对应10 μm
5. 结论与展望
二氧化碳膨胀乙醇(CXE)和超临界二氧化碳等加压流体属于环境友好型的绿色溶剂,相比于传统有机溶剂提取,超临界二氧化碳提取可得到非极性油脂,提取物不需要脱除溶剂,更加绿色环保;CXE提取可得到中性油脂,多不饱和脂肪酸等功能性成分含量更高,故采取一套CXE和超临界二氧化碳联用的提取方式。但加压流体提取所需的投资较高、传质过程复杂、影响因素较多。因此,需要可用于帮助流程设计优化和预测的工具,这种工具就是对提取过程进行动力学建模。此外,将可视化微观显影技术应用于加压流体提取动力学中,更直观地观察到油脂释放动力学过程,为传统动力学过程提供依据,并有望将动力学模型应用于大规模的实际生产操作中。