摘要: 豆腐柴(Promma microphylla Turcz)是一种药食同源的植物资源,含有丰富的果胶、蛋白质、可溶性糖及多种生物活性成分,逐渐受到人们的关注。为了豆腐柴合理利用开发,本文以豆腐柴的幼嫩叶片、成熟叶片、幼果、未成熟果和成熟果实为材料,采用液质联用技术对其中的类胡萝卜素成分进行比较研究。结果表明:叶片中的主要成分是β-胡萝卜素和叶黄素,在成熟叶片中比嫩叶中积累的更多,成熟叶片中含量分别为33.05 μg/g和425.55 μg/g。果实中则未检出胡萝卜素类成分,含有与叶片相同的6种叶黄素类,即:β-隐黄质、花药黄质、玉米黄质、新黄质、叶黄素、紫黄质。本研究结果为豆腐柴资源的有效开发利用提供了数据支撑。
Abstract:
Promma microphylla Turcz is a kind of medicine food homology plant resources, which is rich in pectin, protein, soluble sugar and varieties of bioactive components. In the present study, the carotenoids components were compared in young leaves, mature leaves, young fruits, immature fruits and mature fruits of Premna microphylla Turcz by liquid chromatography-mass spectrometry. The results showed that the main components in leaves were β-carotene and lutein, which were accumulated more in mature leaves than in young leaves. The contents of β-carotene and lutein in mature leaves were 33.05 μg/g and 425.55 μg/g, respectively. Carotenoids were not been found in the fruits, which contained the same six luteins as the leaves, namely: β-cryptoxanthin, antheraxanthin, zeaxanthin, neoxanthin, lutein and violaxan-thin. The results of this study provide data support for the effective development and utilization of Premna microphylla Turcz.
1. 引言
豆腐柴(Promma microphylla Turcz),是马鞭草科(Verbenaceae)豆腐柴属(腐婢属)(Premna L.)多年生木本植物,中药名为腐婢,又名臭常山、满山香和铁箍散等,在我国主要分布于长江流域以南如华东、中南、华南、四川、贵州等地山坡林下或林缘,其根茎叶均可入药,是一种应用历史悠久的药食兼用植物 [1]。豆腐柴根系具有清热解毒功效,用于治疗疟疾、小儿夏季热、风湿痹痛、风火牙痛、跌打损伤、水火烫伤等,也可以辅助治疗痛风 [2] [3] [4]。豆腐柴的叶中富含黄酮类、萜类、酚酸、生物碱等有效药用成分以及果胶、植物蛋白、可溶性糖、纤维素、矿质元素和18种氨基酸等营养成分,具有消肿解毒等作用;豆腐柴叶片颜色翠绿、天然无污染,豆腐柴叶汁凝胶持水力强、黏弹性好,具有良好的食品加工性能。用其制作的“观音豆腐(绿豆腐)”、果冻、保健饮料等制品清凉解热,风味独特 [5] [6] [7] [8] [9]。豆腐柴可作为绿色医药工业原料和食品原料。
《证类本草》记载腐婢能消酒毒、明目。而现代药理学研究表明,多烯类物质类胡萝卜素(Carotenoids),一般由8个类异戊二烯单位组成,具有抗氧化、防癌症、预防夜盲症等功能。类胡萝卜素中的叶黄素、玉米黄素、以及植物多酚类等化学成分是发挥明目功效的主要物质基础。叶黄素和玉米黄素是视网膜的主要色素成分,无法在体内合成,过量缺乏会失明,必须通过外源获取 [10] [11]。叶黄素和玉米黄素可吸收短波长高能量的蓝色光(UVmax-460 nm),减少其对内层视网膜的损害、降低外层视网光化学损伤,促进视网膜细胞中视紫质再生成,同时作为抗氧化剂用以清除过量的氧自由基,减轻视网膜中脂质过氧化的损伤 [12] [13] [14] [15]。方雪梅等 [16] 研究表明野生豆腐柴中β-胡萝卜素、维生素及矿质元素含量也较高。由于类胡萝卜素中的叶黄素类在植物中既有游离形态,也有与不同脂肪酸结合的酯化形态,为了明确探讨该植物中类胡萝卜素积累差异,我们通过皂化水解反应对豆腐柴叶片和不同发育阶段果实中的类胡萝卜类成分进行比较研究,以期为豆腐柴的开发利用提供基础数据支撑。
2. 材料与方法
2.1. 植物材料
豆腐柴(Promma microphylla Turcz)种植于上海辰山植物园苗圃,实验材料2021年~2022年采自两年生的植株。分别收取幼嫩叶片、成熟叶片、幼果、未成熟果和成熟果实并迅速放置于液氮中,然后置于真空冷冻干燥仪中冻干并保存于−80℃冰箱中,待用。
2.2. 实验仪器与试剂
AB Sciex液相色谱–质谱联用仪(ExionLC™ AD超高效液相色谱和Qtrap® 6500 + 质谱)、真空冷冻干燥仪、莱驰MM400球磨仪、赛多利斯BSA 224S电子分析天平、KQ5200E超声清洗仪。色谱纯的甲醇、乙腈、甲酸、甲基叔丁基醚(MTBE)购自Merck;分析纯的氯化钠、氢氧化钾和丙酮购自国药;色谱纯的2,6-二叔丁基对甲酚(BHT)和正己烷购自Sigma-Aldrich;对照品叶黄素、花药黄质、新黄质、紫黄质、玉米黄质、α-隐黄质、β-隐黄质、β-胡萝卜素、ε-胡萝卜素、α-胡萝卜素、番茄红素、八氢番茄红素、六氢番茄红素、γ-胡萝卜素等购自上海甄准生物科技有限公司。
2.3. 类胡萝卜素的提取方法
参照相关文献 [17] [18] [19] 进行类胡萝卜素皂化提取,用球磨仪将冻干的材料研磨至粉末状,精确称取50 mg的粉末于2.0 mL离心管中,加入0.5 mL含0.01% BHT (g/mL)的正己烷/丙酮/甲醇混合溶液(1:1:1, v/v/v)进行超声波辅助提取2次,提取液中加入0.5 mL饱和NaCl水溶液脱脂2次,混匀后静置待溶液分层,取上清液置于真空浓缩仪中浓缩干燥得到提取物。提取物用0.5 mL MTBE溶解后加入0.5 mL 10% KOH-甲醇溶液,避光60℃恒温振荡器中皂化2 h。然后,加入0.5 mL MTBE、1 mL饱和NaCl水溶液和混匀静置,取上清液于新的离心管中,再加入1 mL饱和NaCl水溶液脱脂2次,将上清液真空浓缩至完全干燥得到样品。样品用100 μL甲醇/甲基叔丁基醚混合溶液(1:1, v/v)复溶,经0.22 μm有机滤膜过滤后,保存于棕色进样瓶中,用于LC-MS/MS分析。每个样本设置3个生物学重复。
2.4. 类胡萝卜素的液相–质谱分析
液相色谱条件基于迈维代谢和Geyer [20] 的方法并进行调整:Accucore C30色谱柱(2.6 μm, 100 × 2.1 mm i.d.);流动相:A相为甲醇–乙腈1:3 (加入0.1% 乙酸、0.1% 10 M乙酸铵、0.01% BHT),B相,乙腈–异丙醇–甲基叔丁基醚1:1:1 (加入0.1%乙酸、0.1% 10 M乙酸铵、0.01% BHT),流速0.7 mL/min,柱温30℃,进样量5 μL,洗脱程序:0~3 min A/B为100:0 (V/V),3~5 min A/B为30:70 (V/V),5~9 min A/B为2:98 (V/V),9~11 min A/B为100:0 (V/V)。
质谱条件:大气压化学离子源(APCI)温度550℃,气帘气(Curtain Gas, CUR) 35 psi。去簇电压(Declustering Potential, DP) 100,每个离子各自自动优化的碰撞能(Collision Energy, CE)进行扫描检测。
2.5. 标准曲线配置
配制0.001 μg/mL、0.005 μg/mL、0.01 μg/mL、0.05 μg/mL、0.1 μg/mL、0.5 μg/mL、1 μg/mL、5 μg/mL、10 μg/mL、50 μg/mL、100 μg/mL、250 μg/mL、400 μg/mL浓度的类胡萝卜素标准品溶液,获取各个浓度标准品的对应定量信号的质谱峰强度数据,绘制相应的标准曲线。
2.6. 数据分析
使用SPSS20软件对数据结果进行统计分析。
3. 结果与分析
3.1. 豆腐柴叶片中类胡萝卜素类成分
如表1所示,在豆腐柴叶片中共检出9种类胡萝卜素类成分,其中胡萝卜素类为β-胡萝卜素、α-胡萝卜素和八氢番茄红素三种;叶黄素类为β-隐黄质、花药黄质、玉米黄质、新黄质、叶黄素、紫黄质六种。
由于豆腐柴的嫩叶可以直接食用,而嫩叶和成熟叶均能用来制作“绿豆腐”,因此本研究分析了皂化后的豆腐柴叶片在嫩叶和成熟叶两个阶段的类胡萝卜素含量。我们发现三种胡萝卜素类成分在成熟叶片中的积累量明显高于嫩叶中的积累量(P < 0.05)。方雪梅等 [16] 研究表明每100 g野生豆腐柴鲜叶片中β-胡萝卜素可达21.8 mg。在我们的栽培豆腐柴叶片中β-胡萝卜素含量也是胡萝卜素类物质中含量最高的,在嫩叶中为5.3 μg/g,而在成熟叶片中则可达到33.05 μg/g,其次是八氢番茄红素依次为1.56 μg/g和9.47 μg/g,α-胡萝卜素含量较低,而ε-胡萝卜素、γ-胡萝卜素、六氢番茄红素和番茄红素则未被检出。六种叶黄素类成分在成熟叶片中的积累量极显著高于嫩叶中的积累量(P < 0.01),其中叶黄素含量最高,在嫩叶中为81.25 μg/g,在成熟叶片中则可达到425.5 μg/g。在检测的七种叶黄素类成分中,仅α-隐黄质未被检出。
此外,从三种胡萝卜素类的比例上看(如图1),从嫩叶到成熟叶的过程中,八氢番茄红素中占比呈现一致性,β-胡萝卜素的占比则伴随α-胡萝卜素减少而呈现增加的趋势。与之相比,六种叶黄素类成分中则是紫黄质、β-隐黄质和叶黄素的占比减少而花药黄质、玉米黄质和新黄质占比相应的增加(如图2)。

Table 1. Carotenoids contents in Promma microphylla Turcz leaves
表1. 豆腐柴叶片中类胡萝卜素类成分含量(DW)
注:数据为平均值 ± SD。

Figure 1. Distribution of three carotene components in leaves of Promma microphylla Turcz (A: Young leaves, B: Mature leaves)
图1. 豆腐柴叶片中类3种胡萝卜素类成分分布(A:嫩叶,B:成熟叶)

Figure 2. Distribution of six lutein components in leaves of Promma microphylla Turcz (A: Young leaves, B: Mature leaves)
图2. 豆腐柴叶片中6种叶黄素类成分分布(A:嫩叶,B:成熟叶)
3.2. 豆腐柴果实中类胡萝卜素类成分
与叶片明显不同的是,如表2所示,在我们的检测范围内,豆腐柴果实中未检测到常见的胡萝卜素类成分,仅检出与叶片相同的6种叶黄素类,即:β-隐黄质、花药黄质、玉米黄质、新黄质、叶黄素、紫黄质。
关于豆腐柴果实中的成分,目前未见相关报道。我们对豆腐柴幼果、未成熟果和成熟果三个阶段的叶黄素类含量进行了分析。结果发现伴随豆腐柴果实发育初期至成熟,叶黄素类成分总含量呈现增加趋势。其中叶黄素类的积累最为主要且呈显著增加趋势,在三个阶段分别可达74.87 μg/g、95.13 μg/g和123.76 μg/g。新黄质的含量也呈现显著增加趋势,在成熟果中达7.94 μg/g。玉米黄质在未成熟果中含量最高,β-隐黄质、花药黄质、和紫黄质的含量在三个阶段则无显著变化。

Table 2. Carotenoids contents in three different mature periods of Promma microphylla Turcz fruits
表2. 豆腐柴三个不同发育阶段果实中类胡萝卜素类成分
注:数据为平均值 ± SD,同行数据上角标字母表示差异显著性(P < 0.05)。
3.3. 豆腐柴叶片和果实中胡萝卜素类和叶黄素类成分总量比较
从图3叶片和果实中胡萝卜素类和叶黄素类两类物质总量比较图可以看出,叶黄素类是叶片和果实中的主要类胡萝卜素类成分,而成熟果实中的叶黄素类成分高于嫩叶中的,也是优质的叶黄素来源。
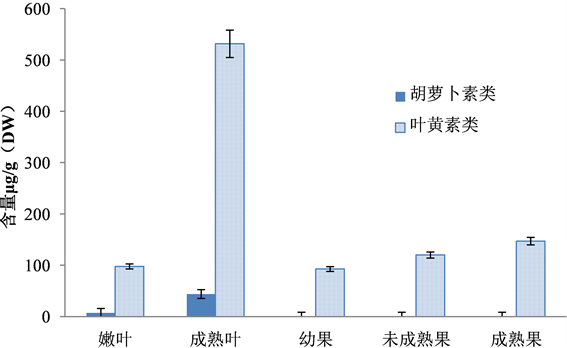
Figure 3. Total amount of carotenes and luteins in leaves and fruits of Promma microphylla Turcz
图3. 叶片和果实中胡萝卜素类和叶黄素类两类物质总量
4. 结论
天然类胡萝卜素可以防止机体白内障、黄斑变性、癌症和心血管疾病的发生,其在保护人类健康中的作用早已受到人们的重视 [21] [22]。特别是叶黄素和玉米黄素这类眼睛视网膜色素组成物质,对人的视觉和认知功能都有重要影响,一旦缺乏会造成老年人群视力丧失甚至不可逆失明 [22] [23],因此从植物中探寻更多的类胡萝卜素来源一直是研究的重点之一。
本研究表明,豆腐柴叶片和果实中富含6种叶黄素类成分,即:β-隐黄质、花药黄质、玉米黄质、新黄质、叶黄素、紫黄质,是极佳的类胡萝卜素源植物。豆腐柴成熟叶片中的叶黄素高达425.55 μg/g DW、成熟果实中也有123.76 μg/g DW。此前未见相关豆腐柴中叶黄素类成分的报道,本研究发现叶黄素含量与紫花苜蓿叶片 [24] 中的相当,并且可达沙棘 [25] 中的一半。此外,成熟叶片中β-胡萝卜素含量也达到33.05 μg/g DW,高于螺旋藻粉 [26] 中的含量。因此,可从豆腐柴叶片和果实中提取类胡萝卜素类物质,具有重要的开发价值。
基金项目
上海市绿化和市容管理局科学技术项目(G192410)。