摘要: 肾癌是泌尿外科肿瘤中常见的一类恶性肿瘤,主要病理类型有肾透明细胞癌、乳头状细胞癌、嫌色细胞癌等,以肾透明细胞癌最为常见,占成人肾恶性肿瘤的70%~80%,传统的肾癌“三联征”:血尿、疼痛、腹部肿块,随着医疗水平的不断提高,以及人们体检意识的增强已经不再常见,大多数出现肾癌三联征的患者多处在肿瘤晚期。约20%~30%的患者就诊时已出现转移,并且这一部分患者的5年生存率较低。肾癌远处转移部位以淋巴结、肺、骨、脑、肝脏等常见,而肾癌伴肌肉及头皮转移少见。本文报道了一例肾癌术后并发肌肉、头皮转移的案例,并对患者的个性化治疗方案进行讨论。
Abstract:
Renal Cell Carcinoma is a common malignant tumor in urologic surgery, the main pathological types include clear cell carcinoma of kidney, papillary cell carcinoma, chromophobe cell carcinoma, etc. Clear cell carcinoma of kidney is the most common, accounting for 70%~80% of adult renal malig-nant tumors. The traditional “triad” of renal cell carcinoma is as follows: Hematuria, pain and ab-dominal mass are no longer common with the continuous improvement of medical level and the enhancement of people’s awareness of physical examination. Most patients with renal cell carcino-ma triad are mostly in the advanced stage of tumor. About 20%~30% of patients have metastases at the time of visit, and the 5-year survival rate of these patients is low. Lymph nodes, lung, bone, brain, liver and other distant metastatic sites of renal cancer are common, but renal cancer with muscle and scalp metastasis is rare. In this paper, we report a case of renal carcinoma complicated with muscle and scalp metastasis after surgery, and discuss the individualized treatment of the pa-tient.
1. 研究背景
目前手术治疗是局限性肾细胞癌患者的唯一治疗手段,对于T1a-b期的肾癌患者建议通过肾部分切除术而非根治性肾切除术进行治疗 [1] 。目前对于局限性肾癌患者,术后仍有高达40%发生远处转移 [2] 。对于出现复发转移的患者,除了手术治疗外,靶向药物治疗也大大提高了这一部分患者的无进展生存期和总生存期 [3] ,然而随着用药时间的延长,大部分患者对靶向药物出现耐药性,从而影响治疗效果 [4] 。除靶向药物治疗外,还可选择靶向药物联合程序性死亡受体1 (programmed death-1 PD-1)/程序性死亡配体1 (programmed death ligand 1 PDL-1)抑制剂治疗 [4] [5] 。多项研究表明靶向药物联合免疫治疗给晚期肾癌的患者带去了希望,结合了两种药物的优势互补,减少了免疫耐受,可有效改善患者的预后 [4] 。
2. 个案报道
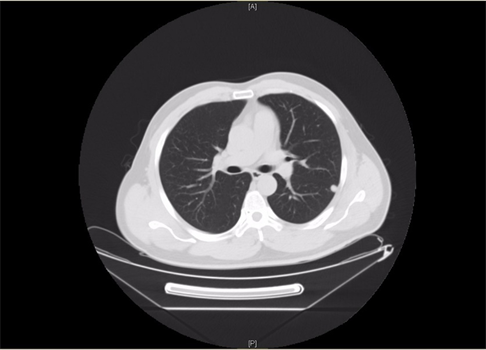
患者男,39岁,2020年10月,患者因“查体发现肾占位性病变9天”收入我科,患者既往糖尿病史,无手术史,术前患者血常规及肾功能均无异常,下腹部增强CT (图1)可见左肾团块状软组织密度影,长径约46 mm × 51 mm,内见钙质影,增强扫描呈明显不均匀强化,与左肾盂分界不清。胸部CT及下腹增强CT均未发现远处转移征象。入院排除禁忌后行腹腔镜下肾癌根治性切除术,术后病理(图2)示:(右肾)透明细胞性肾细胞癌伴坏死(大小5*4*3.5 cm,WHO/ISUP分级:II~III级,局灶呈IV级),紧邻肾被膜,未累及肾盂粘膜及肾窦脂肪,输尿管断端及肾门脉管断端均未见癌累及。免疫组化结果:CK7(−),CD10(+),CD117(−),Vimentin部分(+),CA IX(+),Pax-8(+),P504S(+),TFE3(−),TFEB(−),Ki-67(+, 30%)。患者术后3个月复查时行胸部CT提示左肺多发小结节影,建议患者定期复查随访。2021年7月患者再次复查胸部CT (图3)提示左肺多发结节影,较前增多、增大,考虑转移瘤可能性大。行PET-CT示(图4):1) ① 左肺多个软组织密度结节,边界清,代谢增高,SUVmax为18.0,考虑肺转移瘤;② 左侧腹膜软组织密度结节,代谢增高,SUVmax为2.3,不除外腹膜转移瘤,请结合临床。2) 左肾术后改变,左侧肾区片状软组织密度及高密度吻合线影,代谢轻度增高,SUVmax为2.8,考虑术后改变可能,建议随访。3) 右侧顶部皮下软组织密度结节,代谢增高,SUVmax为13.6,请结合临床必要时获得病理诊断。

Figure 2. Histopathology of the affected kidney
图2. 患肾组织病理学
 (a)
(a) 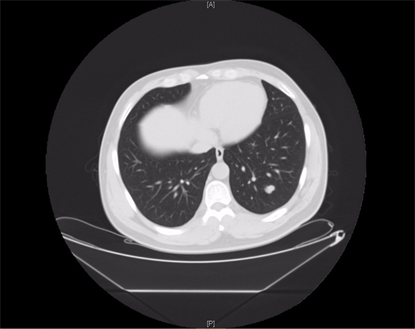 (b)
(b) 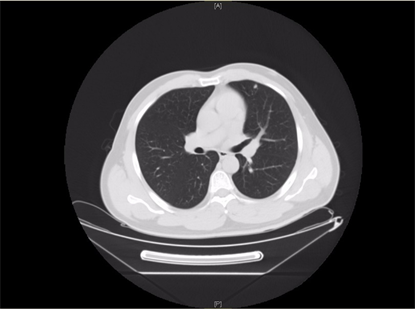 (c)
(c)
Figure 3. Chest CT in July 2021
图3. 2021-7胸部CT

Figure 4. Positron Emission Tomography-Computed Tomgraphy report
图4. PET-CT报告
遂给予患者舒尼替尼靶向治疗,同时为患者头皮肿物行穿刺活检,术后病理示:(头皮)恶性肿瘤,结合病史倾向转移,建议免疫组化进一步确诊。加做免疫组化示:(头皮)转移性肾透明细胞癌(WHO/ISUP4级)免疫组化:Pax-8(+),CA IX(+),CD10(+),P504S(−)。此为患者外院病理我院会诊结果。2021年8月,患者门诊复诊时自述右上肢肿胀,行上肢血管超声示(图5):右肘部下方肌层低回声团块,行肿物穿刺术后病理(图6)示:(右上肢团块穿刺活检)纤维组织中见低分化恶性肿瘤细胞浸润,免疫组化结果:CKpan(+),Vimentin(+),Pax-8(+),CA IX(+),CD10(+),MyoD1(−),Myogenin(−),CDK4(−),MDM2(−),S100(−)。结合免疫组化结果及病史,首先考虑肾细胞癌转移。遂给予替雷利珠单抗200 mg静滴治疗,并继续口服舒尼替尼靶向治疗。
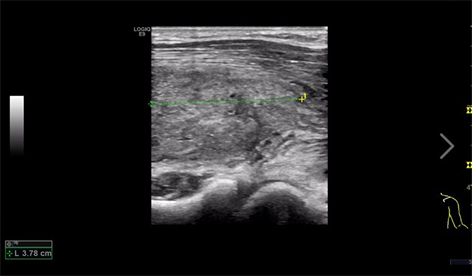
Figure 5. Ultrasonography of upper limb mass
图5. 右上肢肿块超声

Figure 6. Histopathology of upper limb mass
图6. 右上肢肿块组织病理学
3. 诊疗过程
患者于我院行PET-CT检查后诊断为肺继发性恶性肿瘤,给予口服舒尼替尼靶向治疗,1月后门诊复诊取得右上肢肿块病理,遂收入我科,入院后实验室检查结果均未见明显异常,遂给予替雷利珠单抗200 mg静滴治疗,并联合口服舒尼替尼靶向治疗。
4. 预后
经过舒尼替尼联合替雷利珠单抗治疗1周期后患者头皮肿块及右上肢症状已缓解,多周期治疗后复查胸部CT提示肺部转移瘤较前缩小,由于各种因素,患者于当地医院进行了复查,患者仅提供了检查报告(图7,图8)。

Figure 7. Chest CT of August in 2021 (patient-provided)
图7. 2021年8月胸部CT报告(患者提供)

Figure 8. Chest CT report of subsequent visit in 2022 (patient-provided)
图8. 2022年复诊胸部CT报告(患者提供)
5. 讨论
肾透明细胞癌作为一种泌尿系统恶性肿瘤,约有40%的患者死于远处转移 [6] ,该病例中患者出现了头皮转移,在转移至皮肤的恶性肿瘤中,肾癌约占6% [7] ,同时该患者出现肌肉转移,肾癌伴骨骼肌转移较为少见。该病例中的头皮肿物及患者右上肢团块穿刺的免疫组化中,CD10(+),Pax-8(+)符合转移性肾癌的表现 [8] 。肾癌早期缺乏明显的临床表现,以至于大部分患者发现时就已发生了远处转移。
肾癌对于化学治疗及放疗并不敏感 [9] ,但由于肾癌是一种免疫原性较强的肿瘤,因此免疫治疗可用于发生远处转移的患者 [10] ,过去的10几年间,靶向治疗有效的改善了患者的预后 [6] 。在缺氧状态下,缺氧诱导因子α (HIFα)与HIFβ结合形成HIFα/β复合物并调节基因转录,导致受HIF基因调控的如血管内皮生长因子(VEGF)、血小板衍生生长因子(PDGF)、转化生长因子α (TGFα)高表达,并与其同源受体相结合激活一系列激酶依赖性通路,如RAF-MEK-ERK通路及磷脂酰肌醇-3激酶(PI3K)-蛋白激酶B (AKT)-雷帕霉素(mTOR)通路,从而促进肿瘤的发生 [11] 。其中,酪氨酸激酶抑制剂如:舒尼替尼,通过抑制血管内皮生长因子发挥作用 [12] 。虽然靶向药物可改善患者预后,提高患者无进展生存期以及总生存期,但会出现患者耐药而降低治疗效果的现象。近年来,免疫检查点抑制剂的使用改善了转移性肾细胞癌患者的总生存期,NCCN指南中推荐晚期肾透明细胞癌患者免疫联合靶向治疗 [13] ,抗VEGF药物对肿瘤浸润性T淋巴细胞(TILs)和骨髓细胞群具有免疫调节作用 [14] [15] ,而PD-1抗体通过阻断PD-1/PD-L1结合使T细胞恢复活性从而增强免疫应答 [16] ,二者可联合应用起到抑制肿瘤的作用。研究表明,免疫抑制剂联合靶向药物治疗组(阿特珠单抗–贝伐珠单抗)无进展生存期高于靶向药物单药治疗组(舒尼替尼) [17] ,再一次证明了免疫抑制剂联合靶向药物治疗的优越性,给转移性肾癌的患者带去了希望。此病例中同样采用了联合治疗的方案并在短期内取得了临床获益,在药物的选择上结合了当前国际的诊疗共识以及患者自身情况进行了个体化的治疗,以人为本的治疗可缓解患者病情的同时兼顾患者的生活压力,避免出现因病致贫的情况。目前对于晚期肾透明细胞癌的治疗还在进一步的探索,对于一些病情复杂、少见的患者,常规治疗方案效果不佳时,可对治疗方案进行调整。
NOTES
*通讯作者Email: lyj2001353@163.com