1. 引言
盐藻,绿藻门(Chlorophyta)绿藻纲(Chlorophyceae)团藻目(Volvox)衣藻科(Chlamydomonadales)杜氏盐藻科(Dunaliellaceae)杜氏盐藻(D. salina) [1] ,是一种嗜盐的绿色微藻,特别多存在于在海盐田中。由于杜氏盐藻具有能够产生大量类胡萝卜素的能力而闻名,具有抗氧化活性,可用于化妆品和膳食补充剂。几乎没有生物可以像盐藻一样在盐田等高盐度条件下生存。而为了生存,盐藻具有高浓度的β-胡萝卜素以防止强光照射,同时还具有高浓度的甘油来为其提供针对渗透压的保护作用。所以盐藻常用于β-胡萝卜素、甘油等物质的商业生物质生产 [2] 。
杜氏盐藻属的种在形态上与莱茵衣藻相似,其最主要的不同就在于杜氏盐藻既缺乏刚性细胞壁,又缺乏可收缩的液泡。但杜氏盐藻具有一个杯状叶绿体和两个长度相等的鞭毛,其中叶绿体中通常包含了主要的类胡萝卜素 [3] 。叶绿体容纳了大量的β-胡萝卜素,所以通常会呈现出橙红色。β-胡萝卜素的存在有效地保护了有机体免受伤害,当杜氏盐藻暴露于特定强光环境时,β-胡萝卜素可以帮助其免受长期紫外线辐射的影响。杜氏盐藻的形态视具体的环境状况而定,所以其具有各种形状且通常具有对称性。
杜氏盐藻可以通过运动性营养细胞的分裂进行无性繁殖,还可以通过两个配子结合成单一合子而进行有性繁殖。尽管杜氏盐藻可以在盐碱环境中生存,但盐浓度较高(大于100‰)时,杜氏盐藻的有性繁殖显著降低,而低盐浓度时则有利于有性繁殖 [4] 。其有性生殖借助于两个杜氏盐藻鞭毛的接触,进而导致配子的结合。杜氏盐藻的合子非常耐寒,能够在淡水和干燥的条件下生存。萌发后,受精卵最多释放32个单倍体子细胞。
自1966年在苏联建立的第一家用于生产杜氏盐藻β-胡萝卜素试点工厂以来,到现在全世界范围内商业生产杜氏盐藻的β-胡萝卜素已经成为嗜盐生物技术成功的典范之一。现如今,不管是在泻湖中进行低技术的广泛种植,又或是在精心控制的条件下以高细胞密度进行的集约化种植,各种技术都得到了广泛的应用。
β-胡萝卜素作为维生素A原:维生素A是人体中的一种重要的营养元素,在人体中不能合成,只能从外界饮食中获得。维生素A有利于视觉功能的维持,促进骨骼的发育生长,还能抑制肿瘤生长 [5] 。β-胡萝卜素是合成维生素A的前体,在人体的视觉和免疫系统等的正常功能的维系中起着重要的作用 [5] 。缺乏维生素A会导致夜盲症、干眼病、角膜软化、发育异常等症状,严重时会导致失明甚至死亡 [6] 。由于富含丰富的β-胡萝卜素,杜氏盐藻成为了一种广受欢迎的维生素A前体食品补充剂和化妆品添加剂。
杜氏盐藻由于缺乏刚性的细胞壁,使得生物体容易受到渗透压的影响。而甘油的存在可以维持渗透平衡和酶促活性。杜氏盐藻通过维持细胞膜对甘油的低渗透性并从淀粉中合成大量甘油来响应细胞外的高盐浓度,从而保留了高浓度的甘油,这就是杜氏盐藻得以在高盐浓度条件下生存的原因。目前已经有一些利用盐藻积累的高浓度甘油来进行商业生产的尝试,尽管从技术层面可以实现从盐藻中生产甘油,但经济可行性低,且没有利用藻类生产甘油的相关生物工程操作先例 [7] [8] 。β-胡萝卜素是一种橙红色的有机的色素,常见于真菌,植物和水果中。它是胡萝卜素的成员,属于类胡萝卜素(异戊二烯类),由八个异戊二烯单元生化合成,因此具有40个碳。在胡萝卜素中,β-胡萝卜素的特征在于在分子的两个末端都具有β-环。自然界中,β-胡萝卜素通过β-胡萝卜素15,15’-单加氧酶的作用是维生素A的前体(无活性形式)。β-胡萝卜素与其他类胡萝卜素混合物可通过化合物的极性不同而分离。β-胡萝卜素是一种非极性化合物,因此可以用非极性溶剂分离。同时由于高度共轭,因此颜色深,作为一种缺少官能团的烃,它非常亲脂。
类胡萝卜素主要分为两类:叶黄素和胡萝卜素。植物的类胡萝卜素是维生素A的主要膳食来源,因为β-胡萝卜素与维生素A的结构很接近,所以转化率极高,并且存在于许多食物中,所以它常作为膳食补充剂出售 [9] 。类胡萝卜素在小肠的十二指肠被吸收,而且依赖于B类清除剂受体(SR-B1)膜蛋白,该蛋白也负责维生素E (α-生育酚)的吸收。虽然载入人体的β-胡萝卜素可转化为维生素A,但不会出现因摄入过多,维生素A积累而造成中毒现象。β-胡萝卜素存在于许多食品中,并作为膳食补充剂出售。β-胡萝卜素使许多不同的水果和蔬菜呈橙色 [10] 。
β-胡萝卜素和类胡萝卜素对免疫系统有积极作用,可以增加T淋巴细胞,B淋巴细胞和NK细胞的活性和数量。β-胡萝卜素和类胡萝卜素的主要作用是它们具有抗氧化活性,并且可以淬灭或清除自由基,减少细胞,细胞膜及其主要遗传成分的损伤,例如,核酸,蛋白质,脂质等。因此,胡萝卜素和类胡萝卜素可以预防癌症,降低癌症的结实性和发病率。类胡萝卜素的这种正功能由“间隙功能性细胞间通讯”假说支持。尽管流行病调查报告了相反的结果,但在不久的将来将是显而易见的 [11] 。
β-胡萝卜素作为一种重要的天然色素和抗氧化剂,广泛应用于食品制造、医药、化妆品和饲料工业等领域。在食品制造方面,β-胡萝卜素是联合国粮农组织和世界卫生组织食品添加剂联合专家委员会认可的A类营养食品强化剂,为维生素A原。β-胡萝卜素是自然界中最常见、最稳定的天然色素,使许多不同的水果和蔬菜呈现橙色,而且非常适合油脂产品和蛋白质产品的开发。通过微胶囊化处理,β-胡萝卜素可以转化为一种水溶性色素,几乎可以用于任何食品制造中。在医药方面,β-胡萝卜素能降低人类癌症的发病率,大量可靠的研究证明,β-胡萝卜素能抑制肿瘤的形成,具有抗辐射和抗某些化学致癌物质的作用。具有淬灭单线氧、清除自由基、抑制脂质过氧化的能力,可用于预防和治疗因衰老引起的各种退行性疾病。还可用于治疗红细胞生成性尿卟啉病、维生素缺乏症 [12] 。
盐藻作为一种富含胡萝卜素的微藻,其β-胡萝卜素的含量占其干重的1~14%;而胡萝卜中的β-胡萝卜素含量只有0.04% [13] 。而当今许多盐田、盐湖中的天然盐藻藻种所得胡萝卜素的产量多为2~8% [14] 。
天然盐藻β-胡萝卜素的产量无法达到给予适宜培养条件后的产量,而其培养条件难以在野外自然环境中实施。杜氏盐藻富含营养物质,灰分含量是微藻类最低约占细胞干重的4.83%~7.6% (Ginzburg,1988),杜氏盐藻可以分泌多种叶绿素、叶黄素和胡萝卜素且藻细胞内分泌β-胡萝卜素最高可达藻细胞干重的10%,与其他藻类相比是分泌色素含量最高的微藻(Borowitaka, 1984)。
随着当今社会生活水平的提高,人们对于保健产品的需求量增大,如DHA、EPA等。而盐藻富含抗氧化色素β-胡萝卜素,生长周期较短,具有特殊的保健抗癌抗氧化功能,同时工业上提取天然β-胡萝卜素的机制已经较为完善。所以为了提高天然盐藻藻种的β-胡萝卜素产量,可以在藻种优化方面下功夫。
本实验将要筛选出滨州无棣盐田中野外自然条件下的可能含有高胡萝卜素含量的盐藻藻种。扩增藻种,并测定其β-胡萝卜素的含量。
2. 材料与方法
2.1. 藻种
藻种由无棣鲁东大学海洋研究院提供。
2.2. 主要试剂
海水(煮沸),海盐,体积分数为80%的丙酮溶液。
2.3. 实验主要设备
表1为该实验所用的主要设备。

Table 1. Main experimental equipment
表1. 实验主要设备
2.4. 实验步骤
2.4.1. 配置培养基
用锥形瓶配置4瓶100 mL的海水培养基,浓度分别为50‰,100‰,100‰,150‰,用牛皮纸封口后,置于电磁炉煮沸,并静置放凉。
2.4.2. 藻种筛选与接种
将水样静置于强光条件下,盐藻会在水样中呈长条状聚集,用移液枪吸取藻样,迅速接种到配置好的海水培养基中,并及时封口。重新盖上牛皮纸盖并用橡皮筋缠绕牢固。轻轻旋转摇晃接种后的培养基,使藻种混匀并分散,注意不能剧烈摇晃,以免使藻液接触到瓶口的牛皮纸。待混合均匀后将其放于无强光直射的实验台处培养。培养期间每天都要晃动锥形瓶,以免藻种分布密集而没有办法充分吸收营养。
2.4.3. 盐藻细胞密度的测量
用血细胞计数板在显微镜下统计盐藻细胞数。在培养瓶中吸取盐藻细胞培养液,取一滴藻液滴入计数板的计数室,最后换算出单位体积的细胞数,本实验所使用的为XB-K-25型的血细胞计数板。用中间大格计数,要数出四角四个中格加中间中格共五个格子的细胞总数。采用由上至下,由左至右,顺序如弓的顺序,对压边线的细胞采取数上不数下,数左不数右的原则,将每个盐藻培养瓶的藻液计数重复五次,取平均值,按下面的公式(2.1)算出每个培养瓶盐藻藻液的细胞密度:
(2.1)
2.5. 实验分析方法
2.5.1. 盐藻中β-胡萝卜素的含量测定
吸8 mL藻液于离心管中,以3000 r/min转速离心5 min,弃去上清,并重复10次积累盐藻的量。加8 mL 80%的丙酮,再加入等量的4~6个玻璃珠,在振荡混匀器上振荡混匀,提取色素。再次离心5 min,吸上清液保存。按上述方法重复提取,至藻体白色。用分光光度计测450 nm光吸收,按下式计算β-胡萝卜素含量,E (1%, 1 cm) = 2500 (分光光度法在450 nm通过丙酮提取胡萝卜素): [15]
(2.2)
式中:OD (450 nm)表示吸光度值;
V表示提取液的体积(mL);
f表示稀释倍数。
2.5.2. 盐藻干重的测定
取3 mL藻液,放置于分光光度计下,560 nm 处测定其OD值。再依次稀释藻液2倍,4倍,8倍,并在560 nm处测定OD值。随后,用4000 r/min的转速离心10 min后,弃去上清,将盐藻沉淀在80℃烘干之恒重,并称重,并将此重量去除以藻液的总体积,即得到相应OD值下的盐藻细胞的单位干重。以OD值为横坐标,盐藻的单位干重为纵坐标,绘制得到盐藻干重与吸光度的关系曲线 [16] 。
2.6. 主要影响因素分析
2.6.1. 海水培养基
淡水资源的严重短缺导致迫切需要寻求淡水替代品来培养微藻。海水占全球水量的97.5%,且含有丰富的矿物质可供生物利用,因此利用储量丰富的海水培养微藻是比较有潜力的 [17] [18] 。利用海水培养微藻已经成为了研究热点,但由于海水中由于氮磷营养较低,纯海水不能直接支持微藻的生长 [19] ,我们在我们所研究的海水培养基中添加了适量的营养物质来培养盐藻来解决海水中生长营养物质缺乏的问题。我们创设了三种浓度的海水培养基用于培养盐藻,分别为50‰,100‰,150‰当海水培养基的浓度达到100‰时,培养基中的盐藻生长达到一个峰值,藻类数量难以再提高,这可能与培养基内的空间有限相关。
2.6.2. 光照对盐藻细胞β-胡萝卜素含量的影响
光照是影响盐藻光合作用的重要因素,光照强度的变化会显著影响盐藻的生长。过低的光照强度会降低盐藻的光合效率,造成盐藻的生物量减低以及盐藻β-胡萝卜素的合成;过高的光照强度不仅不能被盐藻细胞有效地利用,可能还会抑制盐藻细胞的生长;只有在合适的光照强度下,盐藻才能高效地利用光照进行光合作用,进行β-胡萝卜素的积累。
3. 实验结果
3.1. 高胡萝卜素含量的盐藻藻种筛选结果
3.1.1. 锥形瓶中的藻液
图1为无棣鲁东大学海洋研究所提供的藻样,本团队将采用该藻样进行实验。
图2为盐藻接种到盐度100‰培养基两天后,藻液中盐藻团聚后拍摄的照片。随后便摇匀,使得盐藻能进一步生长。在摇匀后藻液几乎无色。
图3左边盐度为150‰,右边为100‰,同时将盐藻接入不同盐度培养基后3天,肉眼左瓶比右瓶盐度高。

Figure 1. Algal sample provided by the Institute of Oceanology, Wudi East University
图1. 无棣鲁东大学海洋研究所提供的藻样,本团队将采用该藻样进行实验

Figure 2. Algal fluid with salinity of 100‰ (initial stage)
图2. 盐度100‰的藻液(初期)

Figure 3. Comparison of two salinities after 3 days of simultaneous culture
图3. 两种盐度同时培养3天后的对比

Figure 4. Algal liquid in conical bottles of different salinities
图4. 不同盐度锥形瓶中的藻液
图4显示了在不同盐度下盐藻在经历指数期之后的生长情况。从左到右一次为海水(未接种盐藻),盐度分别为50‰,100‰,100‰,150‰的培养基。

Figure 5. Algal fluid at two groups with different salinities
图5. 两组不同盐度下藻液
图5左边盐浓度为150‰,右边为100‰。可以看出在光照条件下,盐藻趋向于避光端。

Figure 6. Salina algal fluid in a conical flask with salinity of 150‰
图6. 盐度150‰锥形瓶内盐藻藻液
图6为盐度150‰的盐藻藻液,在培养至指数期后,摇匀后的藻液颜色如图所示。
3.1.2. 镜检
图7和图8为提高盐度至250‰后5天的镜检结果,可看到明显的β-胡萝卜素的积累。大多细胞都可看到明显的点状橙黄色斑块,个别细胞的整个个体都变得更圆更大通体为橙红色。
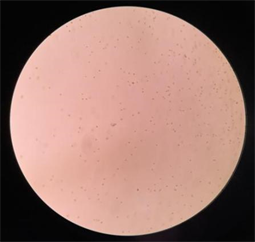
Figure 7. Distribution of salina salina (10 × 10)
图7. 盐藻分布图(10 × 10)
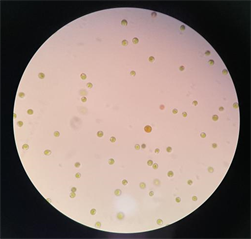
Figure 8. Morphology of Salina salina (40 × 10)
图8. 盐藻形态图(40 × 10)
3.2. 盐藻的生长情况
3.2.1. 盐藻的生长密度

Table 2. Comparison between water samples and cell densities of salina salina cultured in three different salinities
表2. 水样本样与三种不同盐度培养的盐藻细胞密度对比
如表2所示,本实验分别采用50‰、100‰、150‰盐度的培养基培养盐藻。结果表明,盐度在150‰时培养的盐藻细胞密度最大,为3.6 × 105个/mL。
3.2.2. 盐藻的干重
如图9所示,盐藻在560 nm处的吸光度值与盐藻的生物量存在线性关系,且此线性关系的相关系数为0.9737,说明盐藻藻液的吸光度值与盐藻的生物量相关性较为良好,由图表得出,盐藻的生物量与藻液OD值的线性关系为:
y = 1.2328x − 0.016
R2 = 0.9737
式中:y表示盐藻干重(g/L);
x表示在560 nm波长下的吸光度值OD (560 nm)。
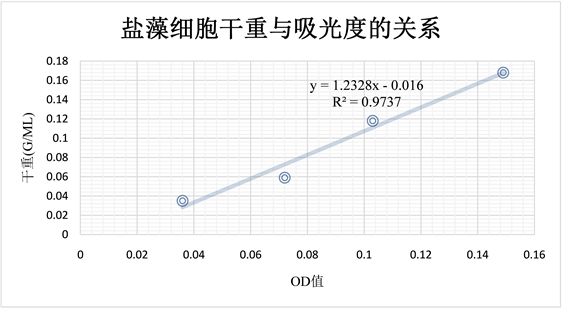
Figure 9. Relationship between cell dry weight and absorbance of salina salina
图9. 盐藻细胞干重与吸光度的关系曲线图
3.3. 盐藻的β-胡萝卜素的含量
图10为离心后的盐藻溶液。将培养的盐藻藻液进行离心分离,得到纯藻种群。在560 nm波长下测出盐藻的吸光度OD值为0.49,由在560 nm下盐藻细胞干重与吸光度关系得出,此时盐藻的细胞干重为0.59 g/L。
y = 1.2328x − 0.016
R2 = 0.9737
式中:y表示盐藻干重(g/L);
x表示在560 nm波长下的吸光度值OD (560 nm)。
在450 nm波长下,测出盐藻的β-胡萝卜素的含量为0.34 mg/L,由此得出盐藻β-胡萝卜素的含量占细胞干重的5.8%。
4. 分析与讨论
4.1. 盐藻的生长情况
盐度50‰:生长缓慢,第一周没有肉眼可见的生长,第二周后盐藻开始大量生长。且扩增后的盐藻沉积在三角烧瓶底部,镜检可见明显圆球形盐藻。
盐度100‰,150‰:生长相对较快,能明显观察到藻液颜色变化。但两周后无明显扩增。盐藻在生长过程中,在有光条件下,趋向于避光生长。因为盐藻在有利于生长繁殖的条件下,需要弱光;而在强光条件下,有利于其积累胡萝卜素和甘油。
整体盐藻的生长情况要比预期低了许多,猜测原因可能有:
海水培养基盐度控制的不够精确,在配置海水培养基过程中,未考虑海盐的含水量,进而导致具体培养基的盐度不够精确;
盐藻藻种的差异,不同盐藻的最适生长浓度可能有所差别,在设置浓度梯度过程中,梯度可能过大,未能有效筛选到最适生长浓度;
营养问题,参考到的有关文献在控制变量过程中有在培养基中加营养物质,而本实验中仅设置了海水培养基的浓度梯度,而未加入相关营养物质,所以导致盐藻生长情况未能够达到预期效果,积累量不多。
整个实验周期有限,未能够逐一排除问题,在未来后续实验中,可针对以上提出的猜测,进一步实验,以排除相关问题,来达到扩增藻种的目的。
4.2. 盐藻的细胞密度
水样中盐藻含量较低,仅能够在光照强度较高的情况下,在水样中形成条带状藻的团聚。所以在具体实验操作过程中,由于筛选藻的过程中需要将嗜盐细菌通过沉淀法而筛除,而使得藻体无法在藻液中均匀分布。进而导致在接种盐藻的过程中,分布到每个培养基中的初始量不同。而初始盐藻细胞分布于整个培养基中后,细胞密度过于低,难以准确测得初期细胞密度。盐藻扩增指数期(一周左右)过后,再次测量细胞密度时,有较大差异。
水样(饱和盐水)中盐藻密度的测量,是在已经筛除过部分藻样过后的细胞密度。由于实验前期计划不周全,考虑欠妥,未能在拿到水样的即刻测量其盐藻密度,所以导致了实验结果中水样中盐藻密度较低。
由于盐藻具有两条鞭毛,所以盐藻在培养基藻液中运动性较高,在测定其细胞密度时,没有将其固定并测量,所以导致盐藻的细胞密度其实浮动性较大,未能测得一个相对准确的细胞密度。
在未来后续实验中,可以针对这次实验过程中的以上问题,来进行进一步的改进与优化。
4.3. 盐藻的胡萝卜素含量
本次实验中所测得盐藻的胡萝卜素含量占其干重的5.8%,对比之前文献中的胡萝卜素含量:
1990年轻工部制盐工业科研所鉴定的β-胡萝卜素占其干重的3% [20] ;
1994年中国科学院海洋研究所和青岛海洋大学生物系共同在研究胁迫条件下盐藻β-胡萝卜素及其异构体累积提到过盐藻中β-胡萝卜素的积累可达其干重10%左右 [21] ;
1996年姜维梅和丁志山的论文中也提到在适当条件下盐藻体内合成β-胡萝卜素可达干重10%以上 [22] ;
1984年莫道克大学指出在适宜条件下盐藻的β-胡萝卜素含量可积累至其干重的14% [23] ;
1995年厦门大学生物系和厦门医药研究所刘广发、游兰英等做的D. salina的两株杜氏藻干杜氏藻中β-胡萝卜素含量为4.03%,但两株具体β-胡萝卜素含量相差了4.5倍(4.03:0.90) [24] 。
盐藻中β-胡萝卜素的含量通常占其干重的2%~8%左右,而本实验在天然情况下所测得盐藻的β-胡萝卜素含量占其干重的5.8%,但查得大多文献中都有在适宜条件下积累β-胡萝卜素可达其干重10%。所以猜测本实验的结果的原因可能有:自然条件下取得的盐藻藻种在被筛选并培养后一直都未加入营养物质;盐藻细胞密度过低,总体β-胡萝卜素含量较少;室内光线较好,不能完全在避光条件下提取β-胡萝卜素,可能有部分色素分解的情况。
同时由于光线较好时,饱和盐度的藻液中的盐藻细胞会聚集,如图6所示观察到的盐藻颜色为黄绿色。而在饱和浓度的海水中,只有盐藻、嗜盐菌和少量原生动物,而原生动物在镜检下几乎为无色半透明状,所以猜测藻液的颜色主要为嗜盐菌的颜色。可以在后续实验中进一步测定嗜盐菌的胡萝卜素含量。
5. 结论
(1) 盐藻在对以海水为基础的培养基适应能力上较优。当海水在培养基中的浓度达到100‰以上时,盐藻培养基中具有最大生物量,最大生物量浓度达到3.6 × 105个/mL,在海水低浓度条件下的生物量较低,主要是由于盐藻细胞对高盐度的需求性较高引起的。
(2) 通过此次实验,成功将无棣海洋研究院提供的盐藻藻种成功分离出来,并测得其胡萝卜素的含量为5.8%。与预测结果有出入,但综合考虑实验过程中的部分实验设计不够完备,所以在未来后续实验中,可以根据此次实验中的分析讨论结果,进一步优化实验方案,以完善该实验过程中的不足之处,进一步测定该盐藻藻种的β-胡萝卜素含量。
参考文献
NOTES
*通讯作者。