摘要: 目的:研究革兰氏阳性细菌所致脓毒症大鼠血浆炎症因子的浓度变化,寻找脓毒症早期免疫干预的方式及最佳时机。方法:选取96只SD雄性大鼠,随机分组革兰氏阳性组(G
+组,n = 48)、生理盐水组(NS组,n = 48),分别腹腔注射热灭活金黄色葡萄球菌(7.35 × 10
12 CFU/Kg)、生理盐水,注射体积均为3 ml,造模成功后分别于2小时、4小时、6小时、8小时、12小时、24小时、48小时、72小时予以乙醚吸入麻醉革兰氏阳性大鼠6只及NS组大鼠6只,尾静脉采血,即刻离心机离心,取上清液用ELISA检测试剂盒检测各组大鼠血清TNF-α、IL-1β、IL-6、IL-10浓度。结果:G
+组大鼠血清IL-10于2小时达到峰值,IL-1β、TNF-α于6小时达到峰值,IL-6于8小时达到峰值,各炎症因子与NS组对比差异具有统计学意义(P < 0.05)。NS组血清IL-10、IL-1β、IL-6、TNF-α从2小时开始变化不大,差异无统计学意义(P > 0.05)。结论:腹腔注射热灭活革兰阳性菌构建的脓毒症模型,2小时内开始免疫增强治疗,可能对脓毒症的治疗极具意义。
Abstract:
Objective: To study the changes of plasma inflammatory factors in septic rats caused by Gram- posi-tive bacteria, and to find the way and the best opportunity for early immune intervention in sepsis. Methods: 96 SD male rats were randomly divided into Gram-positive group (G+ group, n = 48) and normal saline group (NS group, n = 48). Heat-inactivated Staphylococcus aureus (7.35 × 1012 CFU/Kg) and normal saline were injected intraperitoneally respectively, and the injection volume was 3 ml. After successful modeling, 6 Gram-positive rats and 6 NS rats were anesthetized with ether at 2 hours, 4 hours, 6 hours, 8 hours, 12 hours, 24 hours, 48 hours and 72 hours respectively. The chest cavity was opened, blood was taken from the heart, and the supernatant was immediately centrifuged by centrifuge. The serum concentrations of TNF-α, IL-1β, IL-6 and IL-10 in each group were detected by ELISA detection kit. Results: Serum IL-10 in G+ group peaked at 2 hours, IL-1β and TNF-α peaked at 6 hours, and IL-6 peaked at 8 hours. The differences of inflammatory factors be-tween G+ group and NS group were statistically significant (P < 0.05). Serum IL-10, IL-1β, IL-6 and TNF-α in NS group changed little from 2 hours, and the difference was not statistically significant (P > 0.05). Conclusion: The sepsis model established by intraperitoneal injection of heat-inactivated Gram-positive bacteria can start immune enhancement therapy within 2 hours, which may be of great significance to the treatment of sepsis.
1. 引言
脓毒症(sepsis)是重症医学科最常见的疾病之一。虽然在过去几十年中,医疗水平迅速发展,但脓毒症在重症医学科的死亡率仍居高不下,全球每年至少有3000万个脓毒症病例发生,死亡率近30% [1] 。近年来,脓毒症发病期间炎性信号的调节被认为是提高脓毒症存活率和预防脓毒症休克的可能手段 [2] 。多年来对脓毒症患者的深入研究取得不菲的成绩,但患者发病原因不同和就医时间不同、抗生素的滥用等不可控因素,使得脓毒症患者表现出一系列复杂的生理和炎症反应变化,而动物模型可用于帮助提供有关脓毒症的基本病理生理反应。近年来对脓毒症炎症因子探索的模型大多通过盲肠穿刺结扎术感染大鼠,更偏向革兰氏阴性菌,对革兰氏阳性菌的探索的实验相对较少。有实验显示,革兰氏阳性细菌感染比革兰氏阴性细菌感染对脏器的损伤可能更重 [3] 。单一炎症细胞因子作为脓毒症的干预的标志物的作用有限,因此可通过同时观察抗炎和促炎因子的尝试解决这个问题。本实验采用对SD大鼠腹腔注射革兰氏阳性菌模拟脓毒症过程,动态监测脓毒症大鼠血浆中炎症因子TNF-α、IL-1β、IL-6、和IL-10的浓度变化,分析寻找革兰氏阳性细菌感染后机体炎症反应作用时间规律,寻找医源性免疫调控干预的方式及最佳时间。
2. 材料
2.1. 实验动物及分组
雄性SD大鼠96只,(8 ± 1)周龄,体重300 ± 25 g,购自斯贝福(北京)生物技术有限公司,每只大鼠给予标准饲料10 g/100 g∙d,于安静、25℃、12 h昼夜交替的相同环境下分笼饲养,自由进水采食。随机分为革兰氏阳性菌脓毒症组(G+组,n = 48)、生理盐水组(NS组,n = 48),于鼠笼做好标记以便区分。所有动物实验均按照《实验动物管理条例》进行,并得到石河子大学动物伦理委员会的批准。
2.2. 实验器材及试剂
金黄色葡萄球菌标准株由石河子大学医学院第一附属医院检验科获得;大鼠TNF-α、IL-1β、IL-6、IL-10检测试剂盒购买于杭州联科生物技术股份有限公司。
2.3. 实验方法
2.3.1. 模型制备
通过参考文献及本课题组前期研究,攻击SD大鼠的热灭活金黄色葡萄球菌剂量浓度为:7.35 × 1012 CFU/Kg。实验时将SD大鼠进行称重,并计算注射革兰氏阳性菌种的剂量,G+组用浓度为7.35 × 1012 CFU/kg热灭活金黄色葡萄球菌攻击大鼠,抽取生理盐水和热灭活细菌液共3 ml。NS组大鼠腹腔内注射 0.9% NaCl溶液3 ml。注射器抽取相应溶液后,于大鼠左下腹45˚进针,一次性注射完,注射前轻度回抽保证未注射入血管及腹腔脏器,注射完成后大鼠放回原笼,自由进食。
2.3.2. 脓毒症模型构建成功评价
造模成功后每2小时观察1次大鼠情况,通过对大鼠外观、意识水平、活动、对刺激的反应、眼睛、呼吸和呼吸品质这几个方面进行观察,并记录大鼠的行为表现。
2.3.3. 模型处理
各组大鼠分别经过热灭活金黄色葡萄球菌、生理盐水腹腔注射后,置于安静、25℃、昼夜12 h交替的相同环境下饲养,造模后2小时、4小时、6小时、8小时、12小时、24小时、48小时、72小时这8个时间段分别予以雾化吸入乙醚进行麻醉,待大鼠深度麻醉后,尾静脉采血,采血针采取右心室血液2 ml,在1000 rpm下离心20 min,取出上清液,置无菌管中,用大鼠ELISA试剂盒检测细胞因子IL-6、IL-10、IL-1β、TNF-α的浓度。
2.3.4. 统计学方法
采用SPSS26.0统计学软件进行分析,计量资料以均数 ± 标准差(
)表示,采用t检验。以P < 0.05为差异具有统计学意义。
3. 结果
3.1. 大鼠造模后的行为学表现
G+组大鼠:热灭活革兰氏阳性细菌攻击大鼠后,不同时间段表现出不同程度的中毒症状。2 h呼吸幅度增加;4 h开始竖毛,活动开始减少;6 h身体蜷缩,呼吸频率略微下降;8 h开始聚集成堆,进食量减少;12 h反应迟钝,尿量减少;24 h呼吸急促,眼球有少许分泌物,呼吸频率较前下降;48 h出现腹泻、大小便失禁,呼吸频率严重下降;72 h四肢肌张力明显下降,开始出现嗜睡,精神萎靡,无大鼠死亡。
NS组大鼠:腹腔注射3 ml生理盐水后大鼠无明显中毒症状,外表光滑,活动可,意识水平正常,对听觉和触觉刺激立即作出反应,眼睛睁开,呼吸正常,食欲正常,大小便正常,无精神萎靡,无大鼠死亡。
3.2. 大鼠血清炎症因子浓度水平
G+组大鼠血清IL-10于早期升高,2小时达到峰值,此后逐渐下降(见表1、图1),与NS组比较差异具有统计学意义(P < 0.05)。G+组大鼠血清IL-1β于早期升高,6小时达到峰值,此后逐渐下降(见表1、图2),与NS组比较差异具有统计学意义(P < 0.05)。G+组大鼠血清IL-6于早期升高,8小时达到峰值,此后下降(见表1、图3),差异具有统计学意义(P < 0.05)。G+组大鼠血清TNF-α于早期升高,6小时达到峰值,此后下降(见表1、图4),与NS组比较差异具有统计学意义(P < 0.05)。NS组IL-10、IL-1β、IL-6、TNF-α从2小时开始变化不大,差异无统计学意义(P > 0.05)。

Table 1. Comparison of expression levels of serum inflammatory factors in septic rats (
, pg/ml)
表1. 脓毒症大鼠血清炎症因子浓度表达水平比较(
, pg/ml)
注:与生理盐水组对比,#P < 0.05。
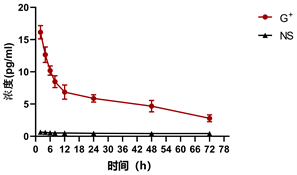
Figure 1. Changes of IL-10 concentration with time
图1. IL-10浓度随时间的变化
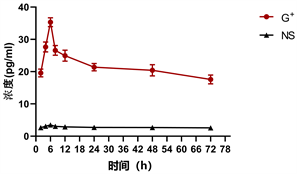
Figure 2. Changes of IL-1β concentration with time
图2. IL-1β浓度随时间的变化
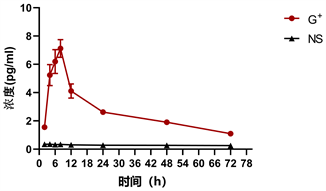
Figure 3. Changes of IL-6 concentration with time
图3. IL-6浓度随时间的变化
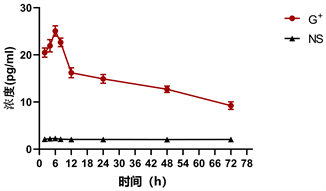
Figure 4. Changes of TNF-α concentration with time
图4. TNF-α浓度随时间的变化
4. 讨论
在脓毒症发病期间,不同细胞因子和免疫系统之间相互作用的复杂网络可能正在发生 [4] 。从20世纪80年代全身抗炎综合征的出现到20世纪90年代末代偿性抗炎反应综合征的提出,近年来,有学者提出峰值学说 [5] ,通过血液净化降低血清中炎症因子水平,进而减弱炎症风暴对组织器官的损伤;也有学者在此基础上进一步提出细胞因子风暴动力模型学说 [6] ,通过降低炎症因子的水平,重建血清与感染部位的炎症因子浓度梯度,从而更好的趋化白细胞等免疫细胞对感染灶的杀灭病原体作用。越来越多研究和治疗显示脓毒症是抗炎因子和促炎因子共同作用的结果。多器官功能障碍综合征(Multiple organ dysfunction syndrome, MODS)是脓毒症最常见的死因,而MODS的最大威胁是来自失控的炎症反应 [7] ,对机体炎症反应的深刻认识有利于早期认识MODS的病理生理变化,并使得早期积极干预成为可能 [8] 。有研究显示 [6] ,促炎因子和抗炎因子持续作用大量释放导致“炎症风暴”是脓毒症导致多器官衰竭的重要机制之一。近年来,全身炎性反应综合征(Systemic inflammatory response syndrome, SIRS)和代偿性抗炎反应综合征(Compensatory anti-inflammatory response syndrome, CARS)的相互制衡是目前公认脓毒症发病的主要机制之一。抗炎因子和促炎因子的相互作用可能导致三种结果:1) 抗炎因子和促炎因子达到相对稳定的平衡状态,机体表现为一过性炎症;2) 抗炎因子强于促炎因子,表现为机体免疫被抑制,增加脓毒症患者对继发感染的易感性,机会性病原体和病毒再激活,原发疾病所致的问题无限放大或二次感染,最终导致机体因免疫力低下而预后极差;3) 抗炎因子作用远远不如促炎因子,全身炎症呈滚雪球式的增强,继而导致炎症风暴,直接或间接损伤各种组织器官,导致全身多器官功能衰竭甚至死亡。
肿瘤坏死因子-α (Tumor necrosis factor-α, TNF-α)通过促进内皮细胞黏附多种白细胞进入炎症部位,进而释放细胞因子,参与和放大SIRS,在脓毒症的启动过程中起主导作用 [9] 。白介素-6 (Interleukin-6, IL-6)能通过诱导细胞毒性T细胞(Tc)的产生,并增强T细胞的杀伤活性参与炎症反应 [10] 。白介素-1β (Interleukin-1β, IL-1β)是急性时相反应蛋白的重要诱导源,能催化、放大炎症反应,可直接反应各组织脏器的损伤程度。白介素-10 (Interleukin-10, IL-10)能下调Th1型细胞因子的表达,进而抑制免疫细胞合成、抑制释放炎症性细胞因子释放并降低多核粒细胞、单核粒细胞和巨噬细胞等的功能。有研究表明 [11] ,IL-10是一种强有力的免疫抑制因子和协同刺激分子。尽管TNF-α、IL-1β、IL-6均是有代表性的促炎因子,但其作用机制不同和作用时间段有差异,因此本实验采用最具代表性的抗炎因子IL-10联合促炎因子TNF-α、IL-1β、IL-6来观察炎症因子的变化规律。
目前单一菌种所致脓毒症模型构建主要通过两种途径,静脉注射或腹腔注射。静脉或腹腔注射活菌所致脓毒症动物模型炎症因子上升速度快,存活时间短,不易观察炎症因子的变化。实验研究显示注射热灭活细菌可以再现脓毒症模型 [2] ,该方法较直接注射活菌更易观测炎症因子的变化。因腹腔注射还能模拟脓毒症导致的多器官功能损伤,所以本实验采用腹腔注射热灭活细菌进行模型的构建。脓毒症造模成功标准有:精神萎靡,嗜睡,进食少、活动减少,眼角出现分泌物等行为学改变以及炎症因子指标出现改变等 [12] 。观察本实验脓毒症组大鼠的行为学表现,发现随着时间的推移,大鼠的上述症状逐步显现,且越来越重,符合脓毒症造模成功标准。
脓毒症多由炎症级联反应启动,早期以促炎因子增高,进而机体产生抗炎因子,下调促炎因子的作用,控制失控的炎症反应,进而降低组织器官的损伤,改善患者的预后 [13] 。本实验结果显示,在没有药物干预情况下,革兰氏阳性菌感染的大鼠血清中抗炎因子IL-10于疾病初期迅速升高,2小时内达到峰值,而促炎因子IL-1β、TNF-α、IL-6分别于6小时、6小时、8小时达到峰值。由此可见早期在促炎因子的作用下,抗炎因子达到峰值的时间早于促炎因子。有研究表明 [14] ,严重腹腔感染死亡的炎症因子在早期就受到抑制。结合本实验数据及结论,当机体感染脓毒症时,血清中早期抗炎因子在促炎因子作用下逐渐产生,迅速达到峰值,8小时后抗炎因子和促炎因子一直下降,这表明大鼠处于免疫抑制期。有研究显示,脓毒症早期若不加控制则会抗炎因子作用强于促炎因子,导致免疫抑制,进而诱发原发病的加重及继发性感染,导致死亡 [15] 。因此在革兰氏阳性菌感染抗炎因子达峰前也就是感染2小时内进行免疫增强治疗,可能延缓患者病情进展,为后续治疗提供充足时间。
本实验的不足:本实验主要研究目前具有代表性的炎症因子,不能反应所有炎症因子的变化情况。且将来可能有比该实验因子更敏感且更具代表性的因子,届时可继续完善相关因子的研究。
基金项目
国家自然科学基金(81801957)。
NOTES
*通讯作者。