1. 引言
青檀(Pteroceltis tatarinowii Maxim)是我国特有的单种属树种,属于第三纪孑遗植物,因其分布范围广,气候适应幅度宽,萌生能力强,根系发达,是石灰岩山地植物群落的常见树种,也是石漠化治理的先锋树种,所以具有重要的学术研究价值和经济利用价值 [1] 。目前,关于青檀的相关研究,主要集中在形态解剖结构及其对生境的适应性 [2] 、群落结构和种群分布格局 [3] [4] 、苗木培育 [5] 、病虫害防治 [6] 、种质资源开发利用 [7] 、遗传特性及生物多样性 [8] 、种子生理生化特性 [9] 、内生真菌的筛选及种群多样性 [10] [11] 、根际土壤肥力及真菌多样性 [12] 等方面。
任豆(Zenia insignis Chun),为苏木科(Caesalpiniaceae)任豆属(Zenia)高大落叶乔木,耐旱性强,主要分布在南方喀斯特地区,对石灰岩钙质土壤环境具有极强的适应能力,其用途广泛,具有良好的生态经济效益,是岩溶地区植被恢复和石漠化治理的优良先锋树种。目前,关于任豆的研究,主要集中在种群分布及群落结构特征 [13] [14] 、种子萌发及苗木培育 [15] [16] 、生理生态特征及抗逆能力 [17] 、饲料开发及资源化利用 [18] - [23] 、退耕模式下土壤微生物多样性 [24] 等方面,但关于我国特有植物青檀和任豆根际土壤微生物多样性的比较研究鲜有报道。
在植物生长的根际土壤环境中,土壤、微生物与植物根系三者之间相互作用,相互影响,植物根际土壤养分的组成及转化受土壤微生物的直接影响 [25] 。目前,关于植物根际土壤微生物的研究,主要集中在微生物种群数量及群落结构特征 [26] 、土壤物质转化的作用机制 [27] 、土壤微生物对植物养分吸收及抗逆性的影响 [28] [29] 、根系分泌物与根际土壤微生物的交互作用等方面 [30] 。近年来,土地微生物多样性及其影响因素的研究已成为生态系统研究的热点 [31] [32] 。因此,本研究将常规研究方法与分子生物学技术相结合,通过比较我国两种特有树种青檀和任豆根际土壤微生物的种群数量、群落结构、土壤理化性质以及土壤微生物多样性的差异,说明青檀和任豆根际土壤理化特性与土壤微生物多样性的关系,以便为岩溶地区植被恢复重建及石漠化治理提供理论参考。
2. 材料与方法
2.1. 样品采集及处理
本调查研究区域位于广西河池市宜州区,调查样地与主城区直线距离不超过10 km,面积不小于400 m2。其中,青檀样地为自然植被样地,任豆样地为人工植被样地,种植时间均有15a以上,平时人为干扰较少,属于半自然状态。在实地调研的基础上,2022年3月至8月,按照普通生态学野外调查采样方法,确定了5个青檀样地和8个任豆样地,采集优势树种根部周围0~20 cm表层的非根际土壤样品和带土的根系样品。将采集的样品装入无菌密封袋,做好相应标记和采样记录,尽快带回实验室处理。
2.2. 实验方法
2.2.1. 土壤理化特性的测定
参照常规的土壤理化分析方法,土壤含水量、pH及有机质含量测定分别用重量法(HJ613-2011) [33] 、电位法 [34] 和分光光度法 [35] ;土壤全磷、速效磷含量测定,分别用NaOH熔融–钼锑抗比色法 [36] 和0.5 mol∙L−1 NaHCO3浸提–钼锑抗比色法 [37] ;土壤全氮、碱解氮含量测定,分别用半微量凯氏定氮法 [38] 和碱解扩散法 [39] 。
2.2.2. 根际土壤和非根际土壤细菌的检测
将采集的青檀和任豆带土根系样品置于超净工作台中,使用无菌刷去除其根表面粘附的土壤颗粒,依次进行称重、无菌水洗涤、超声波洗涤、离心等实验流程,收集的沉淀即为青檀和任豆的根际土壤样品,按照分组方案对样品进行编号,并保存于−86℃超低温冰冻箱中备用。通过高通量测序技术 [40] [41] [42] ,可以获取特定实验样品中的物种组成、物种丰度及微生物群落结构等相关信息,具体流程见图1。
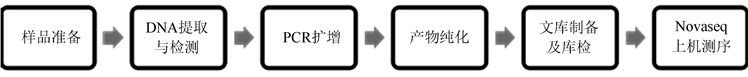
Figure 1. Basic procedures for DNA sequencing of non-rhizosphere and rhizosphere soil bacteria
图1. 非根际和根际土壤细菌DNA序列测定的基本流程
2.3. 数据处理
利用Office Excel 2016和最小显著差数法(LSD法)对实验数据进行统计和差异性分析,通过Origin作图软件绘制相对丰度柱状图;利用微科盟生科云数据处理平台,根据高通量测序结果,分析土壤微生物群落多样性;应用SPSS 22.0软件对根际土壤细菌丰度与土壤理化特性的相关性进行分析。
3. 结果与分析
3.1. 不同植被调查样地的土壤理化特性
两种不同植被(青檀和任豆)调查样地土壤样品的基本理化特性测定结果见表1。

Table 1. Soil physicochemical characteristics of different vegetation survey plots
表1. 不同植被调查样地的土壤理化特性
说明:① 样地编号中,字母YM、HY、XB、LM、LSJ、BLGY分别表示采样点叶茂、怀远、祥贝、六妹村、刘三姐镇、白龙公园,字母QT、RD分别表示青檀样地、任豆样地;② 土壤理化指标中,字母 MC、SOM、TN、AN、TP、AP 分别为水分含量、土壤有机质、全氮、碱解氮、全磷、速效磷;③ 同列数据不同小写字母表示差异显著(p < 0.05),下同。
在13个不同植被的样地中,青檀样地的土壤pH为6.33~6.95,80%属于中性;任豆样地的土壤pH为5.94~6.86,属于中性或弱酸性。该结果与黄必乐等人的研究结果相似 [43] 。
不同植被调查样地土壤含水量有一定的差异,青檀样地的含水量为2.76%~9.04%,其中,YMQT样地的含水量最高(9.04%);任豆样地的含水量为2.75%~8.04%,其中,YMRD-3样地的含水量最高(8.04%)。由此可知,青檀样地的土壤含水量略高于任豆样地,两种不同植被样地均具有较好的水分涵养作用 [43] 。
土壤有机质成分复杂,主要由动植物残体及其分解产物构成,是土壤肥力的重要指标之一 [44] 。由表1可知,大部分(92.3%)调查样地的土壤有机质含量比较丰富,总体表现为青檀样地高于任豆样地,与土壤含水量的测定结果相似。在青檀样地中,土壤有机质含量高低排序为YMQT > LSJQT > LMQT > BLGYQT > HYQT > 40 g/kg。按照我国第二次土壤普查养分分级标准 [45] ,本研究的所有青檀样地土壤有机质含量均达到一级标准(40 g/kg)。
氮是评价土壤肥力高低的重要指标,一般情况下,土壤碱解氮含量与土壤有机质及全氮含量呈正相关。在青檀和任豆样地中,土壤全氮含量为2.99~16.59 g/kg,土壤碱解氮含量为175.92~751.78 mg/kg,其中LSJQT样地的土壤全氮、碱解氮含量最高;所有样地均达到了一级标准,属于很丰富水平。
土壤全磷含量为1.08~2.70 g/kg(>1.0 g/kg),本研究的所有调查样地的土壤全磷含量均达到一级标准(>1.0 g/kg),属于很丰富水平 [45] ;土壤速效磷含量为1.13~22.02 mg/kg,大部分样地属于中等水平。在青檀样地中,土壤速效磷含量为4.83~22.02 mg/kg,其中,YMQT样地速效磷含量最高;在任豆样地中,土壤速效磷含量为1.13~4.11 mg/kg,其中,HYRD-1样地速效磷含量最高。由此可见,青檀自然植被样地的速效磷含量显著高于任豆人工林对照样地。
3.2. 不同植被调查样地细菌种群数量的差异
利用Qiime 2软件中的Dada 2插件对所有样品的全部原始序列(input)依次进行质量控制(filtered)→去噪(纠正测序错误的序列,denoised)→拼接(merged)→去嵌合体(non-chimeric)→形成OTU,经过以上处理步骤之后,剩余序列数目见表2。

Table 2. Statistical table for the process of generating OTU through Dada 2 denoising
表2. Dada 2去噪生成OTU的过程统计表格
说明:① 在样品编号中,字母FGJT、GJT表示为非根际土壤细菌、根际土壤细菌。
OTU是生物学运算的分类单位,指在数量分类学方面作为对象的分类单位的总称。为了分析各样本之间的特有或共有的OTU数目,按不同树种类别及土壤微生物种类对样本进行分组,包括青檀非根际土壤细菌(QTFGJT)、青檀根际土壤细菌(QTGJT)、任豆非根际土壤细菌(RDFGJT)、任豆根际土壤细菌(RDGJT)四个分组。根据分组情况,绘制韦恩图(Venn diagram)分析不同样品组之间特有或共有的OTU,具体结果见图2,在非根际土壤细菌中,任豆特有的OTU为1708,青檀特有的OTU为740,两者共有的OTU为504;在根际土壤细菌中,任豆特有的OTU为1756,青檀特有的OTU为878,两者共有的OTU为484。由此可见,无论是根际土壤细菌,还是非根际土壤细菌,两种不同植被样地均有一定数量的共有菌群,但任豆样地的土壤细菌特有种数量明显大于青檀;在优势树种相同的调查样地中,非根际土壤细菌、根际土壤细菌也有一定差异,但差异相对较少,其数量大小排序均为根际土壤细菌 > 非根际土壤细菌。
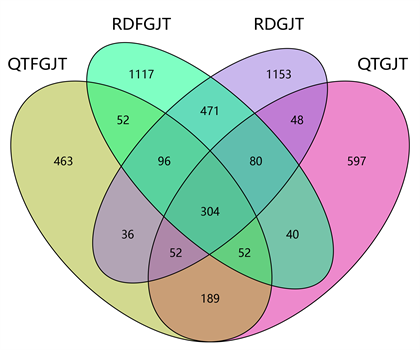
Figure 2. OTU Venn plots of soil bacteria in the non rhizosphere and rhizosphere of Pteroceltis tatarinowii and Zenia insignis in different vegetation survey plots
图2. 不同植被调查样地青檀和任豆非根际和根际土壤细菌OTU Venn图
3.3. 青檀和任豆非根际土壤与根际土壤细菌相对丰度比较
3.3.1. 门水平
为了比较青檀和任豆非根际和根际土壤细菌相对丰度的差异,按照分组方案,绘制相对丰度排名前10的青檀和任豆非根际及根际土壤细菌柱状图,结果见图3。由此可见,两种中国特有树种的土壤优势菌门相同,均为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)及绿弯菌门(Chloroflexi),但相对丰度存在差异;在以上菌门中,除放线菌门外,任豆非根际和根际土壤细菌的相对丰度均大于青檀。

Figure 3. Relative abundance of bacteria in non rhizosphere and rhizosphere soil of Pteroceltis tatarinowii and Zenia insignis plots at the phylum level
图3. 青檀和任豆样地非根际和根际土壤细菌在门水平的相对丰度
为了进一步说明青檀和任豆非根际和根际土壤细菌的差异,选取绝对丰度排名前20的菌门构建聚类树,分析26个样本在门水平的聚类情况,结果见图4。图上方和左侧的聚类树为物种在所有样地的丰度分布相似程度聚类,左侧不同颜色表示不同分组,图中蓝色方格和红色方格颜色深浅表示相对丰度大小,颜色越深,相对丰度越大。横向聚类的结果表示不同样地的土壤细菌在门水平的差异情况。如RDGJT-2和RDGJT-3、RDFGJT-2和RDFGJT-3、QTGJT和RDGJT-1聚为一类,因其距离最短,因此,其所在样地的细菌组成和丰度最相似;纵向聚类结果表示不同菌群在样地之间的相似情况,相似度高的分在同一支,如硝化螺旋菌门(Nitrospirae)和放线菌门(Actinobacteria)、追踪菌门(Elusimicrobia)和疣微菌门(Verrucomicrobia)为同一支,说明硝化螺旋菌门和放线菌门、追踪菌门和疣微菌门在不同植被样地土壤中丰度情况相似。
3.3.2. 纲水平
青檀和任豆土壤细菌相对丰度排名前7且大于1%的优势菌纲均为Alphaproteobacteria、Actinobacteria、Acidimicrobiia、MB A2 108、Chloracidobacteria、Ellin 6529、Nitrospira,其在四个分组中相对丰度之和均超过74%,具体情况见表3。由此可见,青檀和任豆土壤细菌优势菌纲相似,但相对丰度有一定的差异。
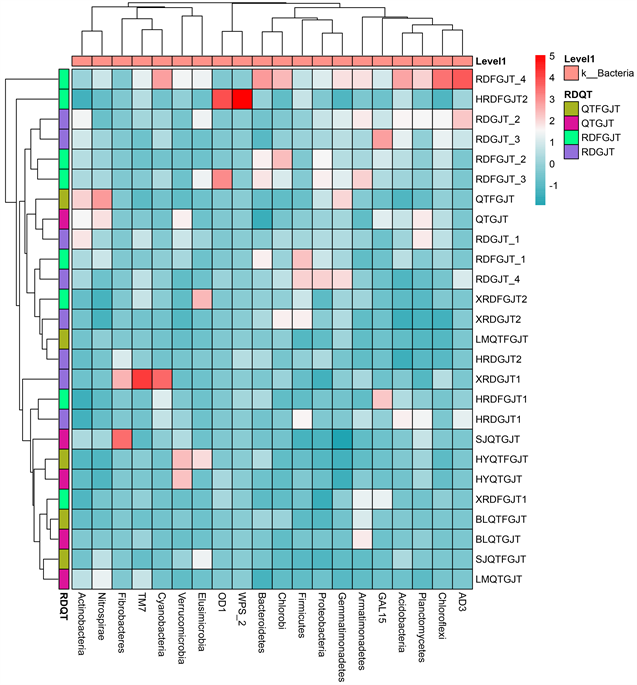
Figure 4. Heat map of species richness of bacterial community in non rhizosphere and rhizosphere soil of Pteroceltis tatarinowii and Zenia insignis at phylum level
图4. 门水平青檀和任豆非根际和根际土壤细菌群落物种丰度热图

Table 3. Comparison of relative abundance of bacteria in non rhizosphere and rhizosphere soil of Pteroceltis tatarinowii and Zenia insignis plots at class level (%)
表3. 纲水平青檀和任豆样地非根际和根际土壤细菌相对丰度比较(%)
3.3.3. 目水平
青檀和任豆土壤细菌相对丰度排名前7且大于1%的优势菌目均为Rhizobiales、Actinomycetales、Acidimicrobiales、unclassified、Rhodospiillales、0319_7L14、Nitrospirales,其在QTFGJT、QTGJT、RDFGJT、RDGJT相对丰度之和分别为79.55%、80.47%、76.56%、80.15%。
3.3.4. 科水平
青檀和任豆土壤细菌相对丰度排名前7且大于1%的优势菌科均为unclassified、Hyphomicrobiaceae、Rhodospirillaceae、Bradyrhizobiaceae、EB 1017、Micromonosporaceae、Mycobacteriaceae,其在QTFGJT、QTGJT、RDFGJT、RDGJT相对丰度之和分别为66.74%、64.85%、70.88%、70.16%。
3.3.5. 属水平
青檀和任豆土壤细菌相对丰度排名前7且大于1%的优势菌属均为unclassified、Rhodoplanes、Bradyrizobium、Mycobacterium、Pedomicrobium、Microlunatus、Streptomyces,其在四个分组中相对丰度之和均超过83%,具体情况见表4。由此可知,青檀和任豆土壤优势菌属相似,非根际和根际土壤细菌的相对丰度虽有一定的差异,但不明显。

Table 4. Comparison of relative abundance of bacteria in non rhizosphere and rhizosphere soils of Pteroceltis tatarinowii and Zenia insignisat genus level (%)
表4. 属水平青檀和任豆非根际和根际土壤细菌相对丰度比较(%)
3.3.6. 种水平
青檀和任豆土壤细菌相对丰度排名前5的优势菌种均为unclassified、massiliensis、mirabilis、ochraceum、vannieli。其中,unclassified和massiliensis在QTFGJT、QTGJT、RDFGJT、RDGJT四个分组的相对丰度分别为96.59%和1.24%、96.00%和1.37%、97.21%和0.95%、96.08%和1.24%;其余3种细菌各分组中相对丰度均低于1%。
3.4. 不同植被根际和非根际土壤细菌多样性的比较
3.4.1. Alpha多样性
为了比较青檀和任豆样地土壤细菌的多样性,利用Alpha多样性指数中的chao1指数、Observed OTUs、Shannon指数及Simpson指数,分别说明四个不同分组土壤细菌多样性的差异。其中Shannon 指数、Observed OTUs指数和Chao1指数的数值越大,Simpson指数值越小,则该样本物种丰富度越高,物种多样性越复杂,反之越低,具体结果见图5~8。在四个分组中,chao1指数值、Observed-features指数值和Shannon指数值的高低排序均为RDFGJT > RDGJT > QTGJT > QTFGJT,而Simpson指数值高低排序为QTFGJT > QTGJT > RDFGJT > RDGJT,与上述3种指数的排序略有不同。由此可见,与青檀样地相比,任豆样地的土壤细菌多样性更高。
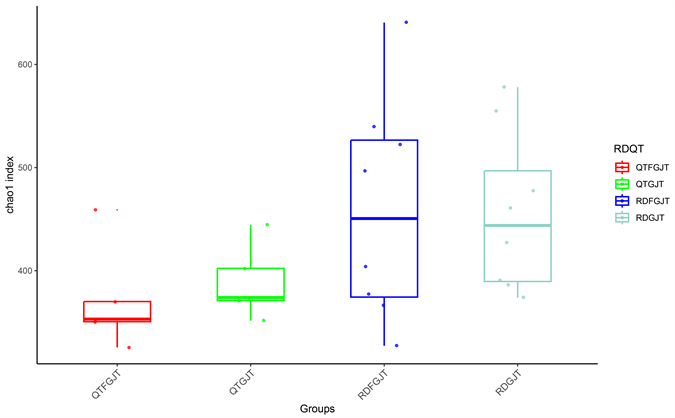
Figure 5. Chao1 index box plot of rhizosphere and non rhizosphere soil bacteria in Pteroceltis tatarinowii and Zenia insignis
图5. 青檀和任豆根际及非根际土壤细菌Chao1指数箱型图
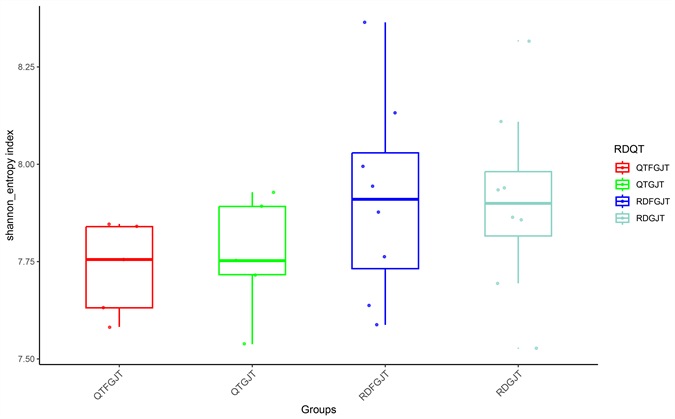
Figure 6. Shannon index box plot of rhizosphere and non rhizosphere soil bacteria in Pteroceltis tatarinowii and Zenia insignis
图6. 青檀和任豆根际及非根际土壤细菌Shannon指数箱型图

Figure 7. Box plot of observed OTUs index of rhizosphere and non rhizosphere soil bacteria of Pteroceltis tatarinowii and Zenia insignis
图7. 青檀和任豆根际及非根际土壤细菌Observed OTUs指数箱型图

Figure 8. Simpson index box plot of rhizosphere and non rhizosphere soil bacteria of Pteroceltis tatarinowii and Zenia insignis
图8. 青檀和任豆根际及非根际土壤细菌Simpson指数箱型图
3.4.2. Beta多样性
Beta多样性分析是用于不同生态系统之间多样性的比较,利用各样本序列间的进化关系以及丰度信息来计算样本间的距离,反映样本间或种间是否具有显著的微生物群落差异,结果见图9。为了进一步说明不同植被样地细菌群落组成的差异,对青檀和任豆非根际、根际土壤样本的OTU组成进行PCoA分析,结果见图10。由此可知,不同植被样地土壤细菌群落距离较远,相似度较低,差异较大;同一树种非根际土壤和根际土壤细菌距离较近,微生物群落结构相似度较高,差异较小。
 说明:两个图中的点代表样本,不同颜色的点属于不同分组样本,点与点之间的距离表示样本菌群差异程度,两点之间的距离越近,表明两个样本之间的微生物群落结构相似度越高,差异越小,下同。
说明:两个图中的点代表样本,不同颜色的点属于不同分组样本,点与点之间的距离表示样本菌群差异程度,两点之间的距离越近,表明两个样本之间的微生物群落结构相似度越高,差异越小,下同。
Figure 9. 2D Map of NMDS analysis of bacteria in rhizosphere and non rhizosphere soils of Pteroceltis tatarinowii and Zenia insignis
图9. 青檀和任豆根际及非根际土壤细菌NMDS分析2D图

Figure 10. 2D Map of PCoA analysis of bacteria in rhizosphere and non rhizosphere soils of Pteroceltis tatarinowii and Zenia insignis
图10. 青檀和任豆根际及非根际土壤细菌PCoA分析2D图
3.5. 相关性分析
由相关性分析结果(见表5)可知,在6种环境因子中,pH与AP呈显著正相关,MC与SOM、TN、AN呈极显著正相关,与TP呈显著相关;SOM与TN、AN呈极显著正相关,AN与TN之间分别呈极显著正相关,与其他不同理化因子有一定的程度相关,但不显著;TP与Chao1指数和Observed_features呈显著正相关;Chao1指数和Shannon指数、simpson及observed_features指数之间都表现为极显著正相关。

Table 5. Correlation analysis between different physicochemical factors and soil bacterial diversity
表5. 不同理化因子与土壤细菌多样性的相关性分析
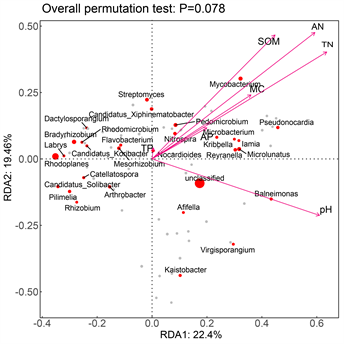 说明:图中每一个点代表一个物种,点越大,对应物种丰度较高、灰色表示丰度低的物种,未在图中标出物种,将物种投影到环境因子箭头上可比较各物种的环境偏好性;红色箭头分别表示环境因子,箭头与箭头之间的夹角,若夹角为锐角表示正相关,钝角表示负相关,直角表示没有相关性,箭头的长度代表某个环境因子与细菌种类分布和群落分布之间相关程度的大小,箭头越长,相关性越大,样本点之间的距离近似于菌群结构差异程度。
说明:图中每一个点代表一个物种,点越大,对应物种丰度较高、灰色表示丰度低的物种,未在图中标出物种,将物种投影到环境因子箭头上可比较各物种的环境偏好性;红色箭头分别表示环境因子,箭头与箭头之间的夹角,若夹角为锐角表示正相关,钝角表示负相关,直角表示没有相关性,箭头的长度代表某个环境因子与细菌种类分布和群落分布之间相关程度的大小,箭头越长,相关性越大,样本点之间的距离近似于菌群结构差异程度。
Figure 11. CCA/RDA ranking diagram of correlation between the relative abundance of rhizosphere soil bacteria in genus level and soil physicochemical factors
图11. 属水平根际土壤细菌相对丰度与土壤理化因子相关性的CCA/RDA排序图
为了进一步说明根际土壤微生物群落组成与土壤理化因子的关系,可将实验结果绘制属水平物种CCA/RDA排序图及属水平根际土壤细菌与土壤理化因子的相互关系热图,结果见图11和图12。由此可知,属水平根际土壤细菌与pH及AP的相关性最大,影响最为显著,与其他土壤理化因子虽有一定程度的相关性,但不显著。在属水平,Nonomuraea、Microlunatus、Pseudonocardia受环境因子的影响最大,分别与MC、AN、SOM、TP、pH、AP呈显著、极显著或极其显著正相关。
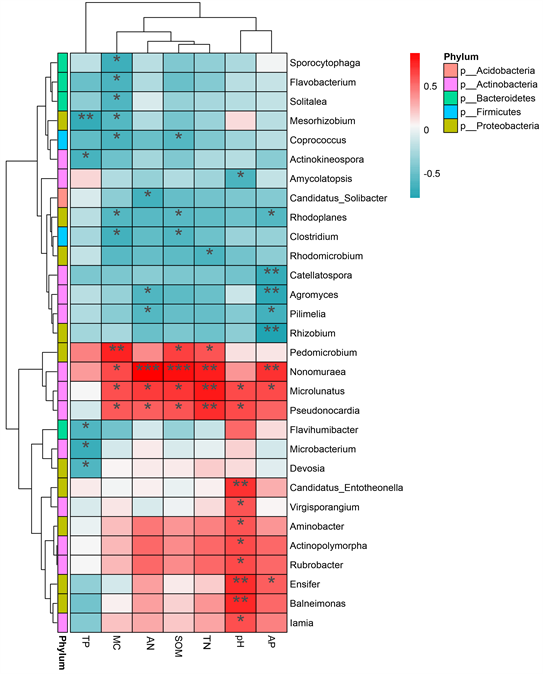 说明:颜色深浅表示相关程度,红色表示正相关,蓝色表示负相关,黑星数目多少表示显著程度。
说明:颜色深浅表示相关程度,红色表示正相关,蓝色表示负相关,黑星数目多少表示显著程度。
Figure 12. Heat map of relationship between rhizosphere soil bacteria and soil physicochemical factors at genus level
图12. 属水平根际土壤细菌与土壤理化因子的相互关系热图
4. 讨论
4.1. 不同植被样地土壤理化特性的差异
广西为典型的喀斯特地区,岩溶地区生态环境脆弱,极易受到人为干扰破坏,造成土地石漠化的严重后果。土壤有机质含量是土壤肥力评价的重要指标 [46] 。从实测数据的比较分析可知,本研究样地的土壤有机质含量较高,可能与其植被组成及优势树种有一定的关系。一些野外调查及实证研究发现,任豆和青檀可以作为岩溶地区植被恢复重建及石漠化治理的优良先锋树种 [46] - [51] ,本研究所得结果与之相似。因为青檀为自然植被样地的优势树种,其凋落物数量多,覆盖面积广,人为活动干扰少,所以,青檀样地的土壤有机质含量较高,水分涵养能力相对较强 [43] ,这可能是其样地土壤碱解氮和全氮含量较为丰富的原因之一。任豆是桂西南和桂西北大石山区退耕还林的优良树种,因其根部具有固氮菌,所以耐贫瘠,对岩溶生境具有极强的适应能力,可明显改善退耕还林地的土壤理化特性,提高植物群落的物种多样性,增强土壤肥力,促进生态系统的逐步恢复 [52] 。在本研究的青檀和任豆两种不同植被样地对比研究中,无论是从非根际土壤细菌和根际土壤细菌数量的比较,均可以说明以上问题。
4.2. 不同植被调查样地细菌多样性的差异
根际是一个很特别的微区域,在离根表1~2 mm土壤中,它由于植物根系的影响,使其周围的微域在物理、化学和生物方面与土壤主体不同。根际土壤中来自根系的有机物质可占植物光合产物的30%左右。因此,根际微生物在正常条件下比非根际明显增多 [53] ,与本研究所得结果相似。从门到种的各个不同水平,无论是根际土壤细菌还是非根际土壤细菌,青檀和任豆的优势菌群相似,但相对丰度有一定差异,与许广等人的研究结果相似 [54] [55] [56] [57] 。在本研究中,土壤细菌多样性的Chao1指数与Observed OTUs指数及Shannon指数呈正相关,且任豆的土壤细菌多样性指数值均大于青檀,其在各分组的高低排序均为RDFGJT > RDGJT > QTGJT > QTFGJT;青檀的土壤细菌Simpson指数大于任豆,其高低排序为QTFGJT > QTGJT > RDFGJT > RDGJT,反映了土壤细菌群落从根际到非根际的变化,以及不同植被土壤细菌多样性的差异。通常情况下,土壤细菌多样性指数越高,其物种数量越多 [58] [59] 。在不同植被调查样地中,因为青檀和任豆相距较远,所以其土壤细菌相似度较低,差异较大。在同一树种调查样地中,因其非根际和根际土壤距离相近,所以土壤微生物群落结构相似度较高,差异较小,该结果与汪其同等人所得结果相似 [57] 。
4.3. 土壤理化因子对土壤细菌多样性的影响
土壤理化因子与土壤细菌多样性有一定的相关性,不同的土壤理化因子对土壤细菌群落结构及物种多样性有不同的影响,其中,TP与Chao1指数及Observed_features指数呈显著正相关。在众多环境因子中,pH及AP与属水平根际土壤细菌群落结构的相关性最大,影响最为显著;其他环境因子与土壤细菌群落结构有一定的相关性,但不显著。
5. 结论
1) 不同植被土壤细菌群落结构存在一定的差异,任豆样地的土壤细菌群落结构比较复杂,种群数量相对较大;青檀样地的土壤细菌群落结构比较简单,其种群数量相对较少;
2) 青檀和任豆样地的优势菌门相同,但相对丰度有差异,相对丰度排名前5的优势菌门依次为变形菌门,放线菌门,绿弯菌门,酸杆菌门及拟杆菌门。在以上5个优势菌门中,除放线菌门外,任豆的土壤细菌相对丰度均大于青檀;
3) 从不同植被调查样地的土壤细菌alpha多样性比较,chao1指数、Observed OTUs指数、Shannon指数均为任豆大于青檀,其在四个不同分组中的高低排序为RDFGJT > RDGJT > QTGJT > QTFGJT,但青檀的Simpson指数高于任豆,其高低排序为QTFGJT > QTGJT > RDFGJT > RDGJT;
4) 岩溶地区土壤的空间异质性较大,同一树种非根际土壤和根际土壤距离相近,其微生物群落结构相似度较高,差异较小;不同树种的空间距离较远,其微生物群落相似度较低,差异较大。因此,青檀与任豆根际土壤细菌多样性有较明显的差异。
基金项目
桂西北特色资源研究与开发广西高校重点实验室(桂教科研[2010] 6号),广西高校大学生创新创业训练计划项目(202210605026),河池学院高层次人才科研启动费项目(XJ2018GKQ015, XJ2018GKQ016)。
参考文献
NOTES
*通讯作者。