1. 引言
雪茄烟叶经过大田期的生长发育,积累了大量的大分子物质,过多的大分子物质会影响雪茄烟叶的感官品质,产生抽吸时的不良气体,影响燃烧性等。晾制过程可以初步分解部分大分子物质,但晾制后的烟叶无法满足工业生产需求,因而发酵过程是生产雪茄的必需的制造环节,也是晾制过程的延续。良好的发酵能有效改善雪茄烟叶的外观质量、化学成分以及抽吸感官等方面。
微生物在整个发酵过程中发挥了重要作用,随着目前对微生物研究的增加,微生物的应用也在雪茄发酵中表现良好 [1] [2] [3] [4] [5] 。烟草发酵过程中的微生物能够产生纤维素酶、淀粉酶等多种水解酶,因此微生物的活动同时主导着物质降解与转化,这些物质含量的改变也影响着烟叶品质和抽吸感官的变化 [6] 。例如淀粉和纤维素是烟叶的基本成分,含有50%左右的碳水化合物和5~15%的蛋白质,碳水化合物其中含有约10~30%淀粉、10~25%纤维素、12%果胶,这些指标的含量均影响着烟叶的品质 [7] 。燃烟时,当烟叶中的成分暴露在燃烧环境中;纤维素会导致刺激性烟雾的释放,导致吸烟者感到口味苦涩。一些涉及分析烟叶中纤维素热解产物的研究表明,烟草烟雾中已经鉴定出一些小分子醛和多环芳烃(PAHs),其中PAHs被认为具有致癌性和细胞毒性等毒性性质 [8] 。淀粉在燃烟时也会影响烟叶的燃烧速度和燃烧的完整程度,并且由于淀粉燃烧时会产生不良的焦化气味而干扰成香反应。因此,淀粉、纤维素的适当降解是提高烟叶品质的关键。为此,以山东雪茄烟叶为材料,通过平板涂布法从雪茄烟叶表面分离并筛选淀粉酶和纤维素酶活力最高的菌株并优化其产酶培养基,旨在为利用微生物降解雪茄烟叶淀粉和纤维素,改善雪茄烟品质提供依据。
2. 材料与方法
2.1. 试验材料
2.1.1. 供试材料
供试样品为2023年已晾制完成的品质较均一的雪茄茄衣中部烟叶,品种为QX-103,由山东临沂烟草有限公司提供。
2.1.2. 培养基配方
LB液体培养基:胰蛋白胨2.0 g/L,酵母粉1.0 g/L,NaC1 2.0 g/L,pH 7.0;
LB固体培养基:胰蛋白胨2.0 g/L,酵母粉1.0 g/L,NaCl 2.0 g/L,琼脂20.0 g/L,pH 7.0;
淀粉酶筛选培养基:可溶性淀粉10 g/L,蛋白胨5.0 g/L,NaCl 5.0 g/L,牛肉膏5.0 g/L,琼脂粉20.0 g/L,pH 7.0;
纤维素酶筛选培养基:CMC-Na 10.0 g/L,蛋白胨5.0 g/L,酵母膏0.5 g/L,琼脂粉 20.0 g/L,pH 7.0;
基础生长培养基:牛肉粉3 g/L,蛋白胨10 g/L,NaCl 5 g/L,pH 7.2。
2.2. 性质鉴定方法
2.2.1. 雪茄烟叶中菌株的分离
参照于少藤等的方法 [9] ,将雪茄烟叶剪碎后,称取发酵过程中的烟叶3 g置于含有300 ml灭菌水的三角瓶内,瓶内加入适量灭菌玻璃珠,将三角瓶放于摇床中,转速为150 r/min振荡30 min,制备得到细菌悬液,取1 ml细菌悬液加入9 ml的灭菌水进行稀释,得到10−1的稀释液,并依次逐步稀释得到10−2,10−3,10−4的稀释液。倒平板待LB培养基凝固后,按常规方法进行平板涂布分离,吸取适合浓度的菌悬液0.1 ml进行平板涂布,将不同浓度的稀释液涂布于LB平板,每个处理涂布五个平板,置于37℃培养箱中培养48 h,观察菌落的生长情况,挑选不同菌落形态的菌株进行分离纯化。
2.2.2. 雪茄烟叶中菌株的纯化
将培养后分离出的细菌继续在LB平板上划线,培养出单菌落,置于恒温箱进行培养,待菌落长岀后,检查其特征是否一致,同时用显微镜检查是否为单一的微生物。若发现有杂菌,需再一次进行分离纯化,直至获得纯培养的单一菌落。
2.2.3. 雪茄烟叶中菌株的筛选
将上述分离获得的细菌参照陈伦旺的方法 [10] ,由单菌落取样依次接种到淀粉、纤维素降解菌选择培养基上,将菌株在恒温恒湿箱中37℃培养。通过观察菌落周围是否存在透明圈来判断细菌是否能够降解相应大分子物质,观察透明圈明显程度,选择酶活力较高的菌株为对象,保存菌种并开展进一步测定。
2.2.4. 雪茄烟叶中菌株的鉴定
将挑取的单菌落经纯化后,采用快速提取试剂盒提取基因组DNA,通过PCR扩增16S rDNA序列,扩增后的DNA序列由公司测定,从数据库中获得相关序列。用MEGA11软件对确定的16S rRNA基因序列和从NCBI数据库获得的参考序列进行比对。再利用MEGA11软件构建系统发育树。
2.3. 菌株生长条件优化
2.3.1. 菌株生长最佳温度的优化
将3 ml液体LB培养基准备在三支培养管(10毫升)中。在121℃下高压灭菌20分钟后,接种1%的新鲜细菌接种物(OD600为0.8) [11] 。菌株在广泛的温度范围内进行培养,设立25℃,30℃,35℃,40℃,45℃温度梯度,pH为7,220 r/min振荡培养24 h,加入等量无菌水,稀释3倍,使吸光值读数范围在0.2~0.7 [12] ,测定OD (600 nm)值。
2.3.2. 菌株生长最佳pH的优化
将3 ml液体LB培养基准备在三支培养管(10毫升)中。在121℃下高压灭菌20分钟后,接种1%的新鲜细菌接种物(OD600为0.8)。菌株在广泛的温度范围内进行培养,设立pH为4.0,5.0,6.0,7.0,8.0,9.0的梯度,在各菌株最佳生长温度条件下,220 r/min振荡培养24 h,加入等量无菌水,稀释3倍后,测定OD (600 nm)值。
2.3.3. 菌株生长最佳碳源的优化
参照洪鹏的研究方法 [13] ,配置基础生长培养基,分别替换添加等量淀粉、蔗糖、葡萄糖作为唯一碳源,其碳源量为1.0%,调节培养基pH至各菌株最佳生长pH,将前期活化的试验菌液以1%接种浓度(OD600为0.8)接种于液体培养基中,在各菌株最佳生长温度条件下,220 r/min振荡培养24 h,加入等量无菌水,稀释3倍后,测定OD (600 nm)值。
2.3.4. 菌株生长最佳氮源的优化
同上配置基础生长培养基,分别替换添加等量硫酸铵、硝酸钾、硝酸铵作为唯一氮源,其氮源含量为1.5%,调节培养基pH至各菌株最佳生长pH,将前期活化的试验菌液以1%接种浓度(OD600为0.8)接种于液体培养基中,在各菌株最佳生长温度条件下,220 r/min振荡培养24 h,加入等量无菌水,稀释3倍后,测定OD (600 nm)值。
2.4. 数据处理
试验数据用SPSS 26.0软件进行差异显著性分析,用Microsoft Excel 2019软件作图并进行分析。
3. 结果与分析
3.1. 雪茄发酵烟叶优势菌株的分离与筛选
通过稀释涂布法,从发酵雪茄烟叶中分离纯化得到18株细菌菌株,由图1、图2可见,通过淀粉、纤维素降解菌选择培养基,筛选得到2株产生透明圈的菌株,分别命名为SN-1 (图1)、SN-2 (图2)。由图观察可知SN-1对于淀粉和纤维素的降解透明圈相对于菌株SN-2,范围更大,降解能力更高。SN-2对于纤维素的降解透明圈范围偏小,可见其对淀粉的降解能力高于对纤维素的降解。
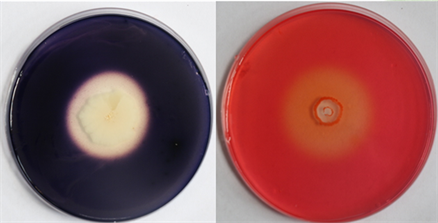
Figure 1. Growth of SN-1 strain cultured on amylase and cellulase producing screening medium for 48 h
图1. SN-1菌株在产淀粉酶、纤维素酶筛选培养基上培养48 h的生长情况
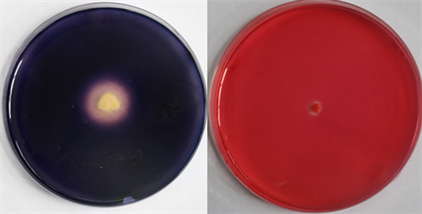
Figure 2. Growth of SN-1 strain cultured on amylase and cellulase producing screening medium for 48 h
图2. SN-2菌株在产淀粉酶、纤维素酶筛选培养基上培养48 h的生长情况
3.2. 菌株的鉴定

Figure 3. Phylogenetic tree of SN-1 strain
图3. SN-1菌株系统发育树
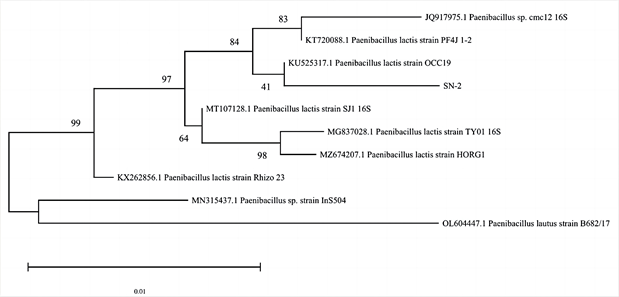
Figure 4. Phylogenetic tree of SN-2 strain
图4. SN-2菌株系统发育树
将两种菌株分别提取16S rDNA电泳后,将PCR产物测序,聚类在一起,用MEGA11软件对确定的16S rRNA基因序列和从NCBI数据库获得的参考序列进行比对。再利用MEGA11软件构建系统发育树(图3、图4)。结果显示,菌株SN-1与MN581178.1 Staphylococcus arlettae strain EE107-P1(3)聚类在一起,构成一个分支,确定其为阿尔莱特葡萄球菌(Staphylococcus arlettae)。菌株SN-2与KU525317.1 Paenibacillus lactis strain OCC19聚类在一起,构成一个分支,确定其为乳酸芽孢杆菌(Paenibacillus lactis)。
3.3. 菌株生长条件优化
3.3.1. 不同温度对菌株生长的影响
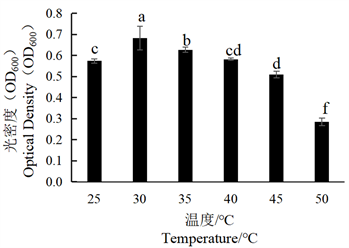
Figure 5. Effect of different temperatures on the growth of tobacco strain SN-1
图5. 不同温度对烟叶菌株SN-1生长的影响
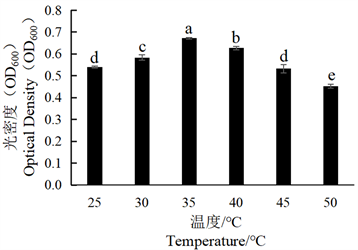
Figure 6. Effect of different temperatures on the growth of tobacco strain SN-2
图6. 不同温度对烟叶菌株SN-2生长的影响
将SN-1、SN-2菌株分别在不同温度条件下培养,加入等量无菌水,稀释3倍后,利用分光光度计测定其菌体生长量(OD600),结果显示,由图5可见SN-1菌株在30℃时生长量达到最大,之后随着温度升高,其生长量逐渐降低,在50℃时生长量最低。由图6可见SN-2菌株随着温度升高,生长量升高,35℃时生长量最高,温度再升高时,其生长受到抑制,生长量逐渐下降。综上可得,SN-1的最佳生长温度为30℃、SN-2的最佳生长温度为35℃。
3.3.2. 不同pH对菌株生长的影响
将SN-1、SN-2菌株分别在不同pH条件下培养,加入等量无菌水,稀释3倍后,利用分光光度计测定其菌体生长量(OD600),结果显示,由图7可知SN-1菌株在pH为6时,生长量最高,在pH为5~8时其生长量相近,说明其对酸碱环境的适应性较高。由图8可知SN-2菌株在pH为6时,生长量最高,且在pH为9是其仍可以生长,并保持一定的生长量。综上可得,SN-1、SN-2的最佳酸碱度均为6,说明这两种菌株在偏酸的环境下更适宜生长。
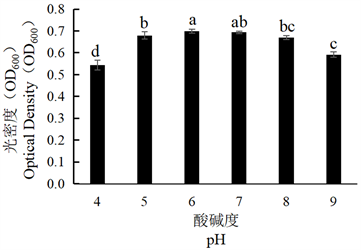
Figure 7. Effect of different pH on the growth of tobacco strain SN-1
图7. 不同pH对烟叶菌株SN-1生长的影响

Figure 8. Effect of different pH on the growth of tobacco strain SN-2
图8. 不同pH对烟叶菌株SN-2生长的影响
3.3.3. 不同碳源对菌株生长的影响
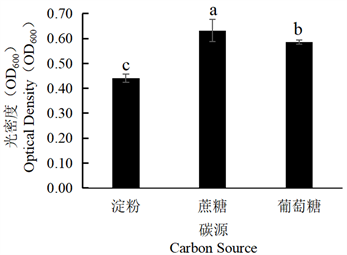
Figure 9. Effect of different carbon sources on the growth of tobacco strain SN-1
图9. 不同碳源对烟叶菌株SN-1生长的影响
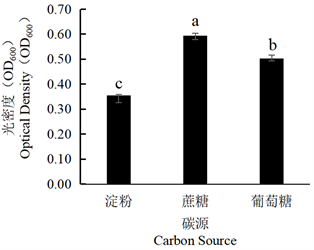
Figure 10. Effect of different carbon sources on the growth of tobacco strain SN-2
图10. 不同碳源对烟叶菌株SN-2生长的影响
将菌株SN-1、菌株SN-2分别在不同碳源培养基下培养,加入等量无菌水,稀释3倍后,利用分光光度计测定其菌体生长量(OD600),结果显示,由图9可见,菌株SN-1最适碳源为蔗糖,其次为葡萄糖,淀粉。由图10可见,菌株SN-2最适碳源为蔗糖,其次为葡萄糖,淀粉。
3.3.4. 不同氮源对菌株生长的影响

Figure 11. Effect of different nitrogen sources on the growth of tobacco strain SN-1
图11. 不同氮源对烟叶菌株SN-1生长的影响
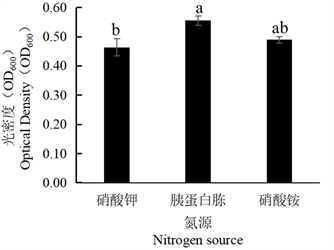
Figure 12. Effect of different nitrogen sources on the growth of Nicotiana tabacum strain SN-2
图12. 不同氮源对烟叶菌株SN-2生长的影响
将SN-1、SN-2菌株分别在不同氮源培养基下培养,加入等量无菌水,稀释3倍后,利用分光光度计测定其菌体生长量(OD600),结果显示,由图11可见,菌株SN-1最适氮源为胰蛋白胨,其次为硝酸钾。由图12可见,菌株SN-2最适氮源为胰蛋白胨,其次为硝酸铵,且该菌株在硝酸铵与硝酸钾的培养基中生长量相近。
4. 讨论
烟叶中淀粉含量过高在燃吸时会有焦糊气味出现,可使烟叶的抽吸感官品质下降。淀粉降解产物中水溶还原糖还能够促进烟叶抽吸时的感官品质的改善,当淀粉降解不充分时会导致还原糖含量较低,造成烟叶糖碱比不协调 [14] 。目前,已研究出的能够降解淀粉微生物有苏云金芽抱杆菌 [15] 、解淀粉芽抱杆菌 [16] 、巨大芽抱杆菌 [17] 等。纤维素也是烟叶中的主要大分子物质之一,它在烟叶内是构成细胞骨架的基本物质,低等级的烟叶纤维素含量较多 [18] [19] [20] 。当烟叶中纤维素含量过高时,会导致烟草在热解过程中产生有害物质,这些化合物其中部分还具有致癌性,会影响到烟草制品的安全性 [21] 。同时,过多的纤维素在燃吸时产生青杂气会掩盖烟叶的烟草本香,影响烟草的感官品质 [22] 。
越来越多的研究表明烟叶微生物可以促进雪茄烟叶中大分子物质的降解。在本研究中,获得了两株具有降解淀粉和纤维素能力的菌株SN-1、SN-2分别为阿尔莱特葡萄球菌(Staphylococcus arlettae)和乳酸芽孢杆菌(Paenibacillus lactis)。在部分有关发酵雪茄烟叶微生物变化规律的试验中,也有多个研究指出葡萄球菌属 [23] 、芽孢杆菌属 [24] 等属于雪茄烟叶的主要优势菌属。芽孢杆菌在烟叶发酵上增香的应用已有部分研究 [25] ,关于葡萄球菌在烟叶中应用的报道较少,在食品应用上,有研究使用葡萄球菌发酵制作香肠来进一步提升香肠的清晰味、甜香味、果香味和花香味 [26] 。
5. 结论
本研究从QX-103雪茄烟叶中分离得到18种菌株,经过纯化和筛选得到2种能够进行降解纤维素和降解淀粉的菌株,并命名为SN-1与SN-2,通过形态学和生理生化鉴定,这两种菌株分别为阿尔莱特葡萄球菌(Staphylococcus arlettae)和乳酸芽孢杆菌(Paenibacillus lactis)。通过对这2种菌株的最佳温度、最佳pH、最佳碳源和最佳氮源的生长条件进行优化,筛选出SN-1最优生长条件为30℃、pH为6、碳源为蔗糖、氮源为胰蛋白胨,SN-2最优生长条件为35℃、pH为6、碳源为蔗糖、氮源为胰蛋白胨。为进一步改善烟叶品质,后期应通过研究这两种菌株在雪茄烟叶发酵过程中的应用,探究菌株的最佳发酵条件,优化发酵工艺。
基金项目
中国烟草总公司山东省公司重点项目(KN294)。
NOTES
*通讯作者。