1. 引言
癌症是威胁全球健康的最严重的疾病之一。肿瘤的体积一直都是临床中作为评估放疗方案效果的重要指标 [1] 。如何在基于肿瘤细胞生长、凋亡的机理过程下对肿瘤体积的建模一直是备受关注的问题。目前的研究主要都是围绕着肿瘤细胞的增殖行为以及复氧的过程来建立的,较少模型以细胞凋亡为研究目标。然而,有必要意识到,对于肿瘤体积建模来说,细胞凋亡也是导致肿瘤体积变化的一个十分重要的因素。在历经放疗后,大多数肿瘤细胞转化为致死性或是非致死性损伤细胞。然而,辐射虽然对细胞造成了不可逆转的致命破坏,这些死亡细胞仍有可能以某种完整的形式存在 [2] 。这部分的死亡细胞虽然不能继续维持肿瘤细胞的一系列生物学活动,但仍是肿瘤体积的一部分。为了保证肿瘤体积这一临床指标对肿瘤控制效果预估的准确性,我们有必要对致死性损伤的死亡细胞的解体动力学进行研究,从而保障对临床肿瘤体积的预估准确性。
在大部分的肿瘤体积建模中,对细胞凋亡行为的考虑往往只将细胞凋亡看作一个统一的整体,考虑整个细胞内部的凋亡行为都由一个相同的指数凋亡行为来控制。然而已有研究观察到淋巴细胞的增殖、解体行为时,发现了两个巨噬细胞亚群,这两个细胞亚群分别对应着不同的凋亡时间 [3] 。为了进一步对肿瘤的凋亡种群进行区分,本文以肿瘤细胞在放疗期间的凋亡行为为研究对象,通过对肿瘤内部进行异质性区分,划分出了两个不同凋亡行为的种群,从而实现了种群的异质性凋亡行为建模。
2. 研究理论基础
2.1. 损伤修复模型
本节主要介绍放疗期间,由于辐照诱导的细胞损伤产生的机理性过程以及本文采用的一个存活分数的机理性模型 [4] 。

Figure 1. The process of radiation induced damage generation and repair during irradiation and repair
图1. 辐照期间以及修复期间辐射诱导损伤产生以及修复过程
如图1(a),在辐照期间由于辐射诱导,产生致死性损伤以及亚致死性损伤。不同于致死性损伤的不可逆,亚致死性损伤是可修复的。由于修复性质的不同,可能导致亚致死性损伤的两种不同的命运:1) 正确修复:亚致死性损伤被正确修复,从而不再是损伤细胞,转换为常的存活细胞;2) 二元错配修复:两个亚致死性损伤相互作用,导致损伤修复失败,从而产生两个致死性损伤细胞。因此,在辐照期间,上述机理过程可由如下一个微分方程组来刻画
(1)
其中
为致死性损伤细胞数,
为亚致死性损伤细胞数,
为剂量率,
为每单位剂量下亚致死细胞的产生速率,
为每单位时间内亚致死性损伤的正确修复率,
为每单位时间内亚致死性损伤的二元错配修复率,
为每单位剂量下致死细胞的产生速率。如图1(b),辐照结束后由于剂量停止注射,剂量直接诱导的那部分损伤不在产生,只剩下亚致死性损伤细胞的修复过程导致的损伤细胞的变化,此时其动力学过程由如下方程组刻画
(2)
根据上述模型,由于辐照诱导的损伤是随机的,考虑损伤的泊松分布,就可以得到高剂量近似下的存活分数为
(3)
2.2. 肿瘤异质性模型
肿瘤是一个复杂的整体,这一点体现在肿瘤的高度异质性上。在放疗肿瘤体积建模过程中,有必要先对肿瘤内部进行异质性的区分。在数学生物学中,实体肿瘤球状体经常作为无血管肿瘤的初步体外模型进行研究 [5] 。受到格林斯潘肿瘤模型的启发 [6] ,我们考虑如图2所示的双层球壳的球体瘤模型
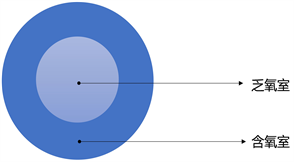
Figure 2. Double layered spherical tumor model during tumor growth process
图2. 肿瘤生长过程中的双层球体瘤模型
该模型的最外层为含氧腔室,由于氧气的扩散良好,该区域内细胞不仅能维持正常细胞活动,还能活跃地进行细胞凋亡行为;内层为乏氧腔室,由于氧气的扩散限制,细胞虽能进行凋亡行为,但细胞凋亡行为不如外层含氧良好的区域那么活跃。
3. 凋亡模型
3.1. 肿瘤细胞凋亡模型
通过对一些临床实验数据的观察,我们发现在放疗后期往往会出现比前期更高的细胞丢失率。图3是关于非小细胞肺癌在分次放疗中的细胞丢失率,本文选取了三例临床数据,其照射总剂量均为55 Gy,并在十天内完成放疗照射。通过对细胞丢失率的数据观察发现,随着照射次数的增加,肿瘤体积在后期的细胞丢失率相比于初期都有比较明显的增加。造成这一现象的原因,可能是由于照射后期,由于肿瘤体吸收了大量的照射剂量,导致有大量的死亡细胞产生,这部分死亡细胞一部分被分解,一部分仍以完整的形式存在肿瘤体积中。死亡细胞的分解导致含氧圈层区域出现空缺,这部分空缺将由乏氧圈层的细胞补上,这就导致了原来属于缺氧圈层的肿瘤由于复氧变成了含氧良好圈层的肿瘤细胞,而转化为含氧良好区域的肿瘤细胞就预示着它们将面临着更为活跃的细胞凋亡行为,这也是后期肿瘤呈现出更高的细胞丢失率的原因。

Figure 3. Cell loss rate during radiotherapy for non-small cell lung cancer (data from [7] )
图3. 非小细胞肺癌在放疗过程中的细胞丢失率(数据源自 [7] )
基于上述假设,我们沿用了细胞种群的指数凋亡模式。通过前面的双层球体模型,对细胞的种群进行区分,假设这两个区域内部的肿瘤分别对应着不同的细胞凋亡常数
与
。其中含氧良好区域的肿瘤面临着更活跃的细胞凋亡行为
,乏氧区域的肿瘤中存在的是有着频率较低的凋亡行为的细胞凋亡种群
。在经历辐照以后,含氧细胞和乏氧细胞产生大量致死性损伤,这些致死性损伤在历经细胞凋亡后的数量变化如下
(4)
其中
与
分别表示历经凋亡之后与之前仍以完整形式存在的含氧细胞致死性损伤的数量,
与
分别表示历经凋亡行为之后与之前仍以完整形式存在的乏氧致死性损伤细胞的数量,
表示含氧死亡细胞的凋亡因子,
表示乏氧细胞的衰减常数,
表示致死性损伤细胞的凋亡时间。根据上述,可以计算出肿瘤细胞的体积丢失率
如下
(5)
通过肿瘤异质性对肿瘤的凋亡行为进行区分,不仅能够刻画出凋亡种群不同的不同凋亡行为,且由于肿瘤存在复氧行为,导致肿瘤后期大量复氧,含氧良好的细胞面临着更为活跃的增殖与解体行为,从而加速了大规模堆积的死亡细胞的凋亡行为,这一异质性区分能够帮助我们刻画这一加速凋亡行为。
3.2. 模型对比
本节,我们通过Matlab模拟了肿瘤在放疗过程中的体积变化情况。模拟的数据参考肺小细胞癌的放疗方案,总剂量为55 Gy并且以单次剂量为11 Gy对肿瘤进行辐照。其中考虑相同凋亡常数的肿瘤体积模型以潜在倍增时间
天,
天进行模拟 [8] [9] 。本文的异质性模型区分了两个种群的凋亡常数,根据伯恩海姆等人的对人体淋巴细胞的巨噬细胞种群凋亡结果来看,两个种群细胞的解体时间比值约为2.8 [2] 。因此,我们以2.8为两个种群凋亡常数的比值,以16.5为两个种群的中位值,计算得出
天,
天。
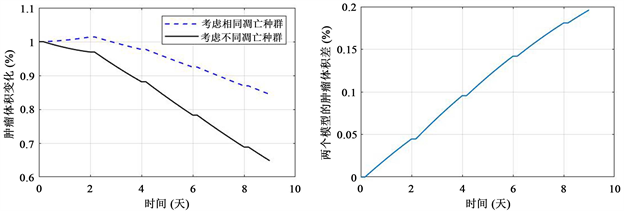
Figure 4. The simulation of tumor volume during radiotherapy
图4. 模拟在放疗过程中的肿瘤体积变化
图4为按照上述数值模拟肿瘤体积变化的结果,从图中可以看出,本文的模型和只考虑单个凋亡常数的模型相比,在治疗的后期,肿瘤体积的变化率更高,即导致肿瘤后期呈现出更高的肿瘤体积丢失,且该体积丢失率会随着时间的增加而增加。
为了进一步验证模型的可靠性,我们将两个模型与非小细胞肺癌的临床数据进行拟合。为了更好地模拟临床数据,且考虑到不同患者之间的差异性,我们以
和
为优化参数来进行数据拟合。图5显示了两个模型与三例临床数据的拟合结果。从结果可以看出,本文的模型与只考虑相同的凋亡常数模型相比,能够较好地拟合那些临床数据。
4. 结论
通过对肿瘤细胞的异质性划分,本文建立了一个有着两个种群的细胞凋亡模型。相比于只考虑相同
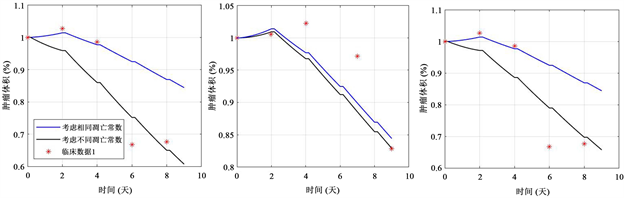
Figure 5. Fitting results of model and clinical data
图5. 模型与临床数据的拟合结果
凋亡常数的模型来说,该模拟结果显示这种异质性区分有助于更好地拟合肿瘤的体积变化。表1列出了为了实现较好地拟合结果的
和
的拟合值。从拟合结果可以看出,临床数据二的
和
值和其他两例的拟合值存在较大的差距。这种差距可能是由于患者间的异质性导致的,也可能是由于不同的肿瘤类别导致的。

Table 1. The fitting values of clinical data
表1. 临床数据的拟合值
通过对临床数据进行分析可以发现,肿瘤放疗后期往往会面临着更大的体积丢失率,且这种变化会随着时间的推移变得更加明显。而本文的模型,能够更好地模拟肿瘤后期的这一加速凋亡现象,即使这一加速凋亡现象不明显,我们也可以根据不同患者的凋亡常数的异质性来进行调整,从而刻画不同的临床数据。
基金项目
福建省自然科学基金(No. 2021J01660)。