摘要: 改进GB 5009.22-2016《食品安全国家标准食品中黄曲霉毒素B族和G族的测定》中高效液相色谱法测定复杂食品基质(花椒、胡椒和辣椒等)中的黄曲霉毒素B1的方法,将提取时甲醇–水溶液(70:30)用量提高至30 mL,上样液混匀后重复高速离心一次,上样液滴完后加入5 mL PBS缓冲液淋洗免疫亲和柱,色谱条件改为梯度洗脱,分别提高色谱柱温度和衍生反应管温度为44℃和80℃,该优化方法较好地减少了样品中黄曲霉毒素B1的损失,净化过程更简单、快速,能大幅减少高效液相色谱分析时间,回收率和精密度更满意,适用于花椒、胡椒和辣椒类样品中黄曲霉毒素B1的检测分析。
Abstract:
To improve the method of high performance liquid chromatography for the determination of aflatoxin B1 in complex food matrices (pepper, etc.) in GB 5009.22-2016 “Determination of Aflatoxin B and G Group in Food Safety National Standard for Food Safety”, the amount of methanol-aqueous solution (70:30) during extraction was increased to 30 mL, the loading solution was mixed and the high-speed centrifugation was repeated once, and 5 mL PBS buffer was added to wash the immunoaffinity column after the loading solution was dropped, and the chromatographic conditions were changed to gradient elution. The optimized method increased the column temperature and derivatization reaction tube temperature to 44˚C and 80˚C, respectively, which reduced the loss of aflatoxin B1 in the samples, made the purification process simpler and faster, greatly reduced the analysis time of high-performance liquid chromatography, and the recovery rate and precision were more satisfactory, which was suitable for the detection and analysis of aflatoxin B1 in Zanthoxylum, pepper and capsicum samples.
1. 引言
黄曲霉毒素B1是二氢呋喃氧杂萘邻酮的衍生物,是已知的化学物质中致癌性最强的一种 [1] 。黄曲霉毒素B1对人和若干动物具有强烈的毒性,其毒性作用主要是对肝脏的损害 [2] 。在天然食物中以黄曲霉毒素B1最为多见,危害性也最强,因此黄曲霉毒素B1是动物饲料中安全性监测的重要指标,同时也是食品安全监督抽检实施细则(2023年版)中大部分坚果炒货食品、米面制品的必检项目之一 [3] 。针对黄曲霉毒素各国都制定了严格的限量标准。美国和欧盟规定17种不同食品中黄曲霉毒素总量(AFB1 + AFB2 + AFG1 + AFG2)的限量要求,其中最大残留限量为15 μg/kg [4] [5] 。我国GB 2761-2017 [6] 《食品安全国家标准 食品中真菌毒素限量》规定了AFB1在不同食品类别中的限量,其中花生制品最高限量值为20 μg/kg。食品样品基质复杂,这对黄曲霉毒素的检测方法提出了很高的要求 [7] [8] [9] 。因此,为了预防和控制黄曲霉毒素对食品的污染,保障人们的身体健康,为食品安全监管提供技术支撑,加强黄曲霉毒素检测方法的研究具有重要的意义 [10] 。
2. 材料与方法
2.1. 试剂与材料
1) 水:GB/T 6682规定的一级水。
2) 甲醇(CH3OH):色谱纯。
3) 乙腈(CH3CN):色谱纯。
4) 氯化钠(NaCl)。
5) 磷酸氢二钠(NaHPO4)。
6) 磷酸二氢钾(KH2PO4)。
7) 氯化钾(KCl)。
8) 吐温-20 (C58H114O26)。
9) 溴衍生试剂:三溴化吡啶(C5H6Br3N2)。
2.2. 仪器与设备
1) 匀浆机。
2) 高速粉碎机。
3) 超声波/涡旋振荡器。
4) 天平:感量0.01 g和0.00001 g。
5) 涡旋混合器。
6) 高速均质器:转速6500 r/min~24000 r/min。
7) 离心机:转速 ³ 6000 r/min。
8) 固相萃取装置(带真空泵)。
9) 氮吹仪。
10) 液相色谱仪:配荧光检测器。
11) 液相色谱柱:Agilent C18柱(柱长250 mm,柱内径4.6 mm;填料粒径5 μm)。
12) 溶剂柱后衍生装置。
13) 免疫亲和柱。
14) 一次性微孔滤头:带0.22 μm微孔滤膜。
15) 筛网:1 mm~2 mm试验筛孔径。
2.3. 试验方法
仪器测定条件
1) 流动相:A相:水;B相:甲醇;
2) 梯度洗脱条件见表1;

Table 1. Gradient elution conditions
表1. 梯度洗脱条件
3) 色谱柱:C18柱(柱长250 mm,柱内径4.6 mm,填料粒径5 μm);
4) 流速:1.0 mL/min;
5) 色谱柱柱温:44℃;
6) 进样量:50 μL;
7) 衍生溶液:5 mg/L三溴化吡啶水溶液;
8) 衍生溶液流速:0.2 mL/min;
9) 衍生反应管温度:80℃;
10) 激发波长:360 nm;发射波长:440 nm。
3. 结果与讨论
3.1. 提取条件的优化
提取过程是黄曲霉毒素B1检测的第一步。采用合适的提取液,利用有效的提取方式,将黄曲霉毒素从复杂样品中充分地转移到溶剂中并均质化,为以后的净化和定量检测做准备 [11] [12] [13] 。常见的黄曲霉毒素B1的提取溶剂有70%甲醇水、80%乙腈水、80%丙酮水等 [14] [15] [16] [17] 。分别对含有黄曲霉毒素B1的花椒样品进行提取,比较这3种提取溶液的提取效率。结果表明,3种不同提取溶液提取效果均较好,结果差异小,乙腈与丙酮相较甲醇价格较贵,同时甲醇毒性小于乙腈,考虑到经济实用以及实验安全,最终选择70%的甲醇水作为提取溶剂。不同提取液提取效率结果见图1。

Figure 1. Comparison of extraction rates of different extraction solutions
图1. 不同提取溶液提取率比较
提取溶剂与样品充分混匀并均质化的方式一般有三种:高速均质、超声提取和振荡 [3] 。在同样使用70%甲醇–水溶液作为提取液的条件下,分别用以上3种方式进行提取。实验结果表明,三种提取方式中高速均质1~2 min与超声提取30 min均具有较高的提取效率。当样品个数不多时,可选择高速均质,均质速度快、效果好 [8] 。而超声波振荡器能同时容纳多个样品进行提取,因此,在处理大量样品时,选择超声提取效果好且同时提取结果更具有可比性 [18] 。本次实验样品量大,因此本次实验选取超声振荡30 min进行提取。实验结果见图2。
为进一步提高提取效率,可将提取液分多次提取样品 [19] [20] 。提取液70%甲醇水,超声提取30 min的条件下,比较了10 mL、20 mL、30 mL、40 mL提取液各分两次提取样品的提取率。实验结果表明,30mL与40 mL提取液分两次提取率相当,优于10 mL与20 mL提取液的提取率。出于实验操作快速简便,经济节约的考虑,最终采用30 mL 70%甲醇水分两次超声提取。具体结果见图3。
3.2. 净化条件的优化
此次实验基质复杂,如不净化,会干扰目标化合物的测定,同时缩短色谱柱寿命。因此,对提取液进行有效净化成为前处理的关键步骤 [7] 。黄曲霉毒素B1净化方式常常选取免疫亲和柱。免疫亲和柱是一种特殊的固相萃取柱,其反应原理见图4。
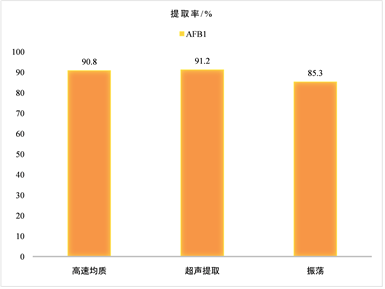
Figure 2. Comparison of extraction rates of different extraction methods
图2. 不同提取方式提取率比较

Figure 3. Comparison of extraction rates of different extraction volumes
图3. 不同提取体积提取率比较

Figure 4. Immunoaffinity column purification principle
图4. 免疫亲和柱净化原理
此次实验对象为复杂食品基质(花椒、胡椒和辣椒等),为避免实验过程中堵塞免疫亲和柱,影响实验结果,可在提取液分取与1%吐温-20混匀为上样液后再进行一次高速离心,然后将该上清液加入免疫亲和柱中,在上样液从免疫亲和柱内滴完后,再分别加入1 mL 1%吐温溶液、10 mL超纯水、5 mL PBS缓冲液淋洗免疫亲和柱,从而更好的去除杂质,提高净化效果。
3.3. 色谱条件的优化
3.3.1. 流动相比例优化
复杂食品基质在免疫亲和柱净化后,如采取常规的等度洗脱,干扰物仍需较长的时间方能从色谱柱上洗脱下来,增加了分离时间,为改善这一现象,此次实验采取表1的梯度洗脱。
3.3.2. 柱温优化
柱温箱,能够准确稳定的控制色谱柱的温度稳定性,从而可以大大提高色谱分析中的精密度,改善谱峰的分离率,缩短分析时间,提高分离速度,并保证了研究结论的真实性和重现度 [4] [12] 。
对液相色谱而言,调整柱温将对分离效率产生很大影响 [6] 。合理优化柱温在此次实验中尤为重要。根据实验结果,如表2所示,综合柱压,响应值以及保留时间等因素,最终确定本次实验柱温44℃。

Table 2. Results of column temperature optimization
表2. 柱温优化结果表
3.3.3. 衍生反应管温度优化
实验表明,衍生反应温度为80℃时,目标物响应值高于60℃和70℃。因此,衍生反应管温度选择80℃,不同衍生反应温度响应值如表3所示。
3.4. 线性关系和检出限的考察
配置一系列适度浓度的标准曲线,在本文所确定的色谱条件下,以目标物浓度为横坐标(X),对应的响应值为纵坐标(Y),进行线性回归,通过向阴性样品中添加目标物来考察方法的定量限。线性回归方程、线性关系,定量限和线性范围分别见表4。

Table 3. Results of temperature optimization of derivatization tubes
表3. 衍生反应管温度优化结果表

Table 4. Linear equation and linear relation of AFB1
表4. AFB1的线性方程与线性关系
3.5. 优化前检验结果及其影响分析
优化前检验结果色谱图见图5,目标物与杂质不能完全分离,手动积分时不能排除杂质干扰,影响目标物的准确定量,所包含的杂质完全经过色谱柱需要花费较长分析时间。常规等度洗脱,分析时间40分钟后仍有杂质从色谱柱中洗脱,会严重干扰下一个样品的测定。
3.6. 优化后检验结果及影响分析
1) 优化后色谱图见图6,杂质干扰明显减少,目标物分离明确,手动积分干扰大大减少,目标物定量准确度大幅提高。
2) 优化后进行3个不同浓度水平加标,每个浓度进行6次重复测定,考察方法回收率和精密度。结果见表5。

Table 5. Recovery test (n = 6)
表5. 回收率试验(n = 6)
按上述实验方法操作,选择两种基质样品上分别进行3个浓度6次平行加标回收试验,加标回收率范围在84.2%~92.5%之间,表明优化后准确度较高;三浓度水平加标相对标准偏差RSD < 5%。表明优化后精密度较好。
3.7. 实际样品的测定
对市场上的6批花椒、4批胡椒和7批辣椒样品采用优化后的前处理和分析条件处理,结果表明,优化后的目标峰与杂峰达到了完全分离,目标物可准确定量。以花椒为例,优化后图谱见图7。
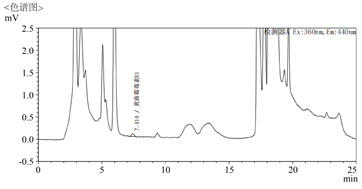
Figure 7. Chromatography after matrix optimization of Zanthoxylum bungeanum
图7. 花椒基质优化后色谱
4. 结论
本试验从样品前处理和色谱条件两个角度出发,进行改进和优化,在样品前处理时将提取溶液甲醇–水溶液(70:30)用量提高至30 mL,进行免疫亲和柱净化前将上样液混匀后重复高速离心一次,进行免疫亲和柱进化时在上样液滴完后加入5 mL PBS缓冲液淋洗免疫亲和柱;色谱条件改为梯度洗脱,分别提高色谱柱温度和衍生反应管温度至44℃和80℃,该优化方法较好地减少了样品中黄曲霉毒素B1的损失,净化过程更简单、快速,能大幅减少高效液相色谱分析时间,回收率和精密度更满意,适用于花椒、胡椒和辣椒类样品中黄曲霉毒素B1的检测分析。
NOTES
*通讯作者。