1. 引言
番茄潜叶蛾是一种世界范围内的重大入侵害虫 [1] ,原产于南美洲西部,寄主范围广泛,主要为害茄科作物,包括番茄、马铃薯、龙葵和烟草等,可在多种植物上产卵和发育 [2] 。其危害表现为对植物叶片形成不规则连片潜道,影响光合作用;嫩茎受到潜蛀而多形成龟裂,影响植株整体发育;果实受害常导致孔洞和畸形,使其失去商品价值 [3] 。该害虫可对寄主植物造成严重损害,危害严重的大棚危害率可达100% [4] 。
自2017年8月番茄潜叶蛾首次在新疆伊犁地区发现以来,这一入侵害虫在中国境内迅速扩散 [5] [6] [7] [8] ,化学药剂是防止番茄潜叶蛾迅速扩延的最常用方法,但由于其潜叶危害特性,可以帮助其躲避一部分杀虫剂侵害,加之农药的过度使用已导致番茄潜叶蛾种群对多种合成杀虫剂产生抗药性。因此,需要开发特殊的、环境友好型的控制策略,如昆虫不育技术(SIT)、性诱剂诱杀等,这些方法正在不断发展并在一些地区取得了初步成果。在这些新兴的防治方法中,有性生殖是确保其成功的关键焦点。有报道番茄潜叶蛾可以通过孤雌生殖进行无性繁殖 [9] ,如果番茄潜叶蛾进行孤雌生殖,那么将会对多种不育技术防治方法效益大大缩减。
孤雌生殖是一种独特的生殖方式,与昆虫宿主生殖表型相关的α-蛋白细菌中最具代表性的菌属有沃尔巴克氏菌(Wolbachia sp.)和立克次体(Rickettsia sp.) [10] ,其他与生殖表型相关的菌属还有拟杆菌(Cardinium sp.)和螺原体(Spiroplasma sp.)等。在这些微生物中,沃尔巴克氏体被认为是存在最广泛的内共生菌;据认为,它感染了一半以上的节肢动物物种 [11] ,广泛存在于节肢动物的生殖组织中,据估计约有80%的鳞翅目物种感染了沃尔巴克氏体 [12] 。
以上所提到的所有生殖内生共生菌通过母体传播可以操纵宿主的性别,决定繁殖和发育 [13] ,以加强自身的传播和持久性,从而有可能达到孤雌生殖效果。
为明确入侵到南疆的番茄潜叶蛾种群是否存在孤雌生殖现象,首先对三个地区的番茄潜叶蛾进行了生殖共生菌的检测。此外,在阿拉尔地区,我们采集了处女蛾进行了饲养观察,检阅是否存在孤雌生殖现象。研究结果可为迷向技术应用提供理论支撑。
2. 材料与方法
2.1. 供试虫源
番茄潜叶蛾成虫或幼虫来自新疆南疆的阿拉尔市、和田县、库车县的温室大棚,随机选择60个个体用于后续实验,孤雌生殖观察实验虫源来自阿拉尔市塔里木大学校园园艺实验站番茄大棚。
2.2. DNA的提取
番茄潜叶蛾整只成虫或幼虫用Ezup柱式动物基因组DNA抽提试剂盒(上海生工)提取总DNA,取番茄潜叶蛾虫体组织用液氮研磨成粉末加入到1.5 mL离心管中,加入180 µL Bufrer ACL,再加入20 µL Proteinase K溶液,震荡均匀,56℃水浴1 h至细胞完全裂解。再加入200 µL Buffer CL,充分颠倒混匀;加入200 uL的无水乙醇,充分颠倒混匀;将吸附柱放入收集管中,用移液器将溶液和半透明纤维状悬浮物全部加入吸附柱中,静置2 min,再10,000 rpm室温离心1 min,倒掉收集管中废液。将吸附柱放回收集管中,向吸附柱中加入500 µL CW1 Solution,10,000 rpm离心30 s,倒掉收集管废液。将吸附柱放回收集管中,向吸附柱中加入500 µL CW2 Solution,10,000 rpm离心30 s,倒掉收集管废液。将吸附柱重新放回收集管中,于12,000 rpm室温离心2min去残留的CW2 Solution,取出吸附柱,放入一个新的1.5 mL离心管中,加入50~200 µL CE Ruffer置3 min,12,000 rpm塞温离心2 min,收集DNA溶液。检测DNA样品的质量,DNA样品的质量和数量用超微量分光光度计(k5600)进行了分析。
2.3. 生殖内生菌的分子检测
根据前人的研究成果委托生工生物工程(上海)股份有限公司合成引物(表1),反应体系25 μL,包括上下游引物各1 μL、DNA模板1 μL、2 × T5 Super PCR Mix (Basic) 12.5 μL和ddH2O 9.5 μL,扩增条件为98℃预变性3 min、98℃变性10 s、55℃~60℃退火10 s、72℃延伸15 s,35个循环,72℃终延伸5 min。取4 μL PCR产物进行1%琼脂糖凝胶电泳(北京市六一仪器厂,DYY-12C型电泳仪)检测,测试了以下细菌共生菌:Wolbachia sp.、Spiroplasma sp.、Arsenophonus sp.、Cardinium sp.和Rickettsia sp. [14] [15] [16] [17] [18] 。

Table 1. Detection primer sequence, annealing temperature and product sequence length of reproductive endosymbionts
表1. 生殖内共生菌的检测引物序列、退火温度及产物序列长度
2.4. PCR产物测序与比对
选取每个地区所得结果的6个PCR产物进行测序,一共测序了18个阳性pcr产物。运用DNAMAN软件对测序结果进行拼接校对并提交到NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi)系统中,查找相似性最高的典型菌株并比对。
2.5. 孤雌生殖观察
获得的虫源于养虫室条件(温度25℃ ± 1℃,相对湿度75% ± 5%,光周期为16L:8D)下继续饲养,待其化蛹之后单独分离,蛹羽化后按性别对其进行分类,随机抽取出种群中的100只处女蛾,在透明塑料杯内单独饲养观察,每隔1~2 d加入蜂蜜水为其保证营养。另外单独抽取10只处女蛾,与同天刚羽化雄性潜叶蛾进行配对用作对照。在这两种处理中,每天观察雌性番茄潜叶蛾在植株上的产卵量,直至死亡。记录了雌虫的产卵量和寿命,继续观察卵孵化情况。
3. 结果与分析
3.1. 番茄潜叶蛾生殖内共生菌检测
不同地区的样品中都检测到了沃尔巴克氏体(Wolbachia sp.)的存在(表2),而生殖共生菌螺原体(Spiroplasma sp.)、杀雄菌(Arsenophonus sp.)、拟杆菌(Cardinium sp.)和立克次氏体(Rickettsia sp.)检测均为阴性。

Table 2. The positive rate of Wolbachia detection in tomato leafminer
表2. 番茄潜叶蛾沃尔巴克氏体检测阳性率
3.2. 番茄潜叶蛾沃尔巴克氏体序列比对
被检测的Wolbachia sp.的核苷酸序列一致,通过ncbiblast搜索结果显示与感染Wolbachia (KX146859.1、KX146854.1)的Wolbachia内共生菌相似度达100% (表3)。

Table 3. Comparison results of Wolbachia strains and database type strains of tomato leafminer
表3. 番茄潜叶蛾Wolbachia菌株与数据库类型菌株对比结果
3.3. 番茄潜叶蛾孤雌生殖观察
番茄潜叶蛾处女蛾单雌产卵量在0~19粒,平均2.24粒,而雌雄配对处理的单雌产卵量27~244粒,平均135.8粒,雌雄配对后的雌虫产卵量显著增加(图1)。另外,进行雌雄配对的番茄潜叶蛾雌成虫与未进行交配的番茄潜叶蛾雌成虫平均寿命分别为13.7天和23.1天,雌成虫寿命存在显著差异(图2)。在未与雄性番茄潜叶蛾进行配对的雌性番茄潜叶蛾的所产卵中,均未发现卵粒孵化,卵在一定时间后,变为干瘪,失去活力。
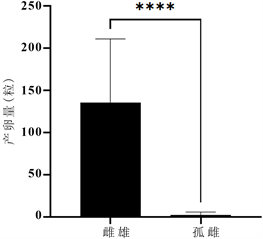
Figure 1. Difference of oviposition between female and male paired females and parthenogenetic females
图1. 雌雄配对雌虫与孤雌产卵量差异性
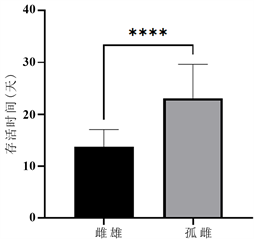
Figure 2. Differences in longevity between female and male paired females and parthenogenetic females
图2. 雌雄配对雌虫与孤雌寿命差异性
4. 结论
对南疆三个地区的番茄潜叶蛾种群进行分析的主要结果是发现了共生菌Wolbachia sp.的存在,而没有检测到螺原体(Spiroplasma sp.)、杀雄菌(Arsenophonus sp.)、拟杆菌(Cardinium sp.)和立克次氏体(Rickettsia sp.)。在每个地区选取的用于试验的60只番茄潜叶蛾中,阿拉尔市所检测出的Wolbachia sp.阳性率为66.6%,库车市所检测出的Wolbachia sp.阳性率为11.6%,和田县所检测出的Wolbachia sp.阳性率为20.0%,随后进行序列比对,相似度与感染Wolbachia (KX146859.1、KX146854.1)的Wolbachia 内共生菌相似度达100%。在阿拉尔地区继续进行孤雌生殖试验的结果证明,所进行试验的处女蛾虽然进行产卵,但并未发现卵孵化。处女蛾寿命要比雌雄配对的雌性寿命更加长,而产卵量却远远不如雌雄配对的产卵数量多。
5. 讨论
对三个地区的番茄潜叶蛾种群进行分析的主要结果是发现了共生菌Wolbachia sp.的存在,但是并没有检测到螺原体(Spiroplasma sp.)、杀雄菌(Arsenophonus sp.)、拟杆菌(Cardinium sp.)和立克次氏体(Rickettsia sp.),这也与Cagnotti等人所研究结果一致 [10] 。在阿拉尔地区继续进行孤雌生殖试验时,所进行试验的处女蛾虽然进行产卵,但并未发现卵孵化。本试验结果与Caparros Megido等人在实验室内发现了番茄潜叶蛾可以孤雌产卵且成活率高达39.9%的结果相矛盾 [19] 。结果可能表明,孤雌生殖可能是一种偶然现象,而不是一种固定的繁殖机制 [20] 。又或者是番茄潜叶蛾只有在面对环境胁迫时才会发生的一种生殖方式,番茄潜叶蛾孤雌生殖还需要更大样本量进行观察,具体引起孤雌生殖原因尚待深入研究。总的来说,本次孤雌试验尽管发现单性番茄潜叶蛾可以进行产卵,并且产卵量在个位数甚至可以达到十位数,但是并未发现卵孵化情况,却发现进行配对的雌性潜叶蛾寿命与未进行配对的雌性潜叶蛾寿命存在差异,本研究对潜叶蛾的生殖行为及其生态学特性的理解具有一定的科学意义。