1. 引言
癌症是当今世界最令人生畏的疾病之一,抗癌技术研发领域的进展不断突破,新的抗癌药物层出不穷,化疗因其独特优势在肿瘤治疗中发挥重要作用。但由于化疗药物选择性差,对肿瘤细胞和正常细胞均具有抑制作用,在治疗的过程中常引起严重的毒副作用。因此,在肿瘤的治疗中,提高化疗药物对肿瘤细胞的靶向性显得尤为重要。高效低毒的治手段对攻克肿瘤具有重大意义。
Fe3O4纳米粒子具有良好的生物相容性、超顺磁性、光热等特性,因而被广泛的应用到纳米药物载体领域。其中共沉淀法制备得到的Fe3O4纳米粒子尺寸分布均一,稳定性好,且表面含有大量容易被修饰的羟基,使其具有丰富的可修饰性。
二氧化硅因为其具低毒性和良好的生物相容性 [1] 而在医药材料领域 [2] [3] 被广泛应用。由病理学知识 [4] [5] 可知,围观条件下药物和药物载体的比表面积越大,载体中药物颗粒的扩散速度就越快。纳米尺寸的介孔二氧化硅具有高的比表面积,且孔道排列整齐、大小均一、结构稳定。利用其作为载药材料,可以使得一些原先难以被人体直接吸收或者毒性大的药物能够缓慢的分解释放,起到治疗效果。另外,在载体中引入具有靶向的物质,可以通过外部环境控制药物载体内的分布和释放 [6] [7] [8] ,达到精准控制、高效治疗的效果。二氧化硅因表面大量的羟基为其带来了良好的化学修饰条件,如图1所示,图1(a)为二氧化硅成球机理图,图1(b)则为其表面羟基与硅烷偶联剂反应机理图。
磁性介孔二氧化硅纳米药物载体的优秀性能吸引着广大研究者们的兴趣。制备出高载药、低毒且能靶向输送的磁性纳米粒子为本实验的研究目的。
2. 实验部分
2.1. 共沉淀法制备Fe3O4纳米粒子
本实验采用共沉淀法 [3] [5] 制备四氧化三铁纳米粒子。首先称取60 g的氢氧化钠固体,溶解在500 mL的水中,将溶液转移至三口烧瓶中,搅拌,并通氮气30 min。称取10.271 g六水合氯化铁固体,将其溶解在44 mL pH = 3的盐酸中,通氮气30 min,然后加入4.5 g氯化亚铁固体,继续通氮气,至氯化亚铁固体全部溶解后,用注射器以60 mL/h的速度注入到三口烧瓶中。注射完成后将溶液加热到78℃,反应一个小时。反应完成后,将溶液转移到大烧杯中,加入适量超纯水,将烧杯静置于磁石上,待铁沉淀后,将上层液倒出,再加入超纯水,如此反复,直至溶液pH = 7为止。将洗好的四氧化三铁用pH = 3的盐酸溶液分散,取分散液,装入离心管,超声20 min后称重配平,然后离心20 min,离心机转速10000 r。离心后上层液即为所制得的四氧化三铁,将其用吸管取出,分别测量其粒径值和OD值,贴上标签,放置4℃的冰箱中,离心管内剩余物滴加pH = 3的盐酸继续分散,然后超声、称重配平、离心,如此反复操作直至分散液粒径不满足实验要求为止。
2.2. Stöber法制备Fe3O4@mSiO2
取0.1 g上述制备粒子分散到30 mL超纯水中,超声30 min,分散均匀后倒入三口烧瓶中,加入50 mL水,40 mL乙醇,搅拌10 min,然后加入75 mg 十六烷基三甲基溴化铵(CTAB)模板剂,搅拌1 h (注意搅拌速度,不能起泡),加入1mL氨水(质量分数28%),搅拌10 min,混合均匀后,将200 μL正硅酸四乙酯(TEOS)分散到20 mL乙醇中,然后用注射泵以20 mL/h的速度注射到溶液中,搅拌反应6 h。然后将产物磁分离,用乙醇洗三次以除去多余的TEOS和少量的CTAB,然后配制无水碳酸钠的乙醇溶液(浓度6 g/L)在60℃条件下回流搅拌20 h,重复三次以除去粒子介孔中的模板剂CTAB,即可制备得到Fe3O4@mSiO2纳米粒子。
2.3. 粒子表面巯基化修饰
将前面制备得到的Fe3O4@mSiO2纳米粒子与65 mL无水甲苯在超声条件下均匀混合,使其分散均匀,在氮气保护作用下,加入5 mL的硅烷偶联剂(γ-球丙基三乙氧基硅烷),在110℃并通氮气保护的条件下冷凝回流48 h。待其自然冷至室温却后,磁分离除去上层甲苯。残留物先用二氯甲烷洗涤2次以去除残留的甲苯,再用无水乙醇洗涤3次以去除残余的未反应完全的巯基化试剂以及二氯甲烷。
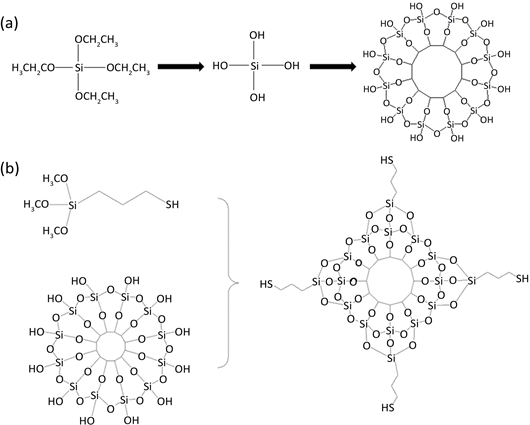
Figure 1. (a) Schematic diagram of SiO2 structure, (b) Schematic diagram of SiO2 surface mercapto modification
图1. (a) TEOS水解及二氧化硅成球机理图,(b) 粒子表面巯基化修饰机理图
3. 结果与讨论
3.1. 粒子基本表征
如图2所示,图2(a),图2(b)分别为Fe3O4和Fe3O4@mSiO2粒子透射电镜图片,图2(c),图2(d)则为与之对应的扫描电镜图片,由图可以看出,共沉淀法制备的单颗的Fe3O4纳米粒子的粒径尺寸为20 ± 5 nm,对其表面修饰即包裹介孔二氧化硅后的复合粒子粒径为60 ± 10 nm,由透射电镜可以清晰的看到介孔二氧化硅均匀的包裹在Fe3O4纳米粒子表面。复合了SiO2之后的Fe3O4@mSiO2纳米粒子具有良好的形貌和良好的分散性。由此可见二氧化硅的引入解决了单一的四氧化三铁存在的分散性差这一缺陷。
图3为Fe3O4@mSiO2的氮气吸附-脱附曲线图和孔径分布图(小图),该吸附-脱附曲线仍保持了IV型吸附-脱附等温线 [10]。在P/P0 = 0.4~0.7处氮气吸附量和脱附量增加迅速,说明粒子具有较高的孔道有序性。在孔径分布图中,粒子孔径集中分布在1~4 nm之间,也印证了孔道的有序性,这一结果与图2中的TEM结果相符。粒子比表面积271.52 m2/g,孔径3.5 nm。对于药物载体来说,大的比表面积、合适的介孔孔径,更利于药物分子附载,这是由于大量得介孔结构给药物分子提供了足够的物理空间,且粒子介孔中大量的亲水性集团——羟基为药物分子提供了有利的化学因素。
如图4(a)所示,为实验中各步产物粒子的傅里叶红外图,图中依次向下分别为为Fe3O4、Fe3O4@mSiO2、Fe3O4@mSiO2-SH和SiO2的红外图,分别可以观察到Fe3O4和SiO2各自的特征峰。在Fe3O4@mSiO2的红外图中可以清晰的看到Fe3O4和SiO2各自的特征峰,如578 cm−1处为Fe3O4中的Fe-O峰,1045 cm−1处则为SiO2中的Si-O峰。Fe3O4@mSiO2-SH为表面巯基化后的磁性介孔二氧化硅纳米粒子,巯基化过程是硅烷偶联剂与磁性介孔二氧化硅粒子表面羟基反应从而接上巯基的过程,相较于Fe3O4@mSiO2,羟基峰

Figure 2. (a) (b) the TEM of Fe3O4 and Fe3O4@mSiO2, (c) (d) the SEM of Fe3O4 and Fe3O4@mSiO2
图2. (a) 共沉淀法制备得到的四氧化三铁纳米粒子TEM图,(b) 为包裹了介孔二氧化硅的TEM图,(c) (d) 分别与之对应的SEM图

Figure 3. N2 adsorption-desorption curve and pore size distribution diagram of Fe3O4@mSiO2
图3. Fe3O4@mSiO2粒子氮气吸附-脱附曲线及孔径分布图
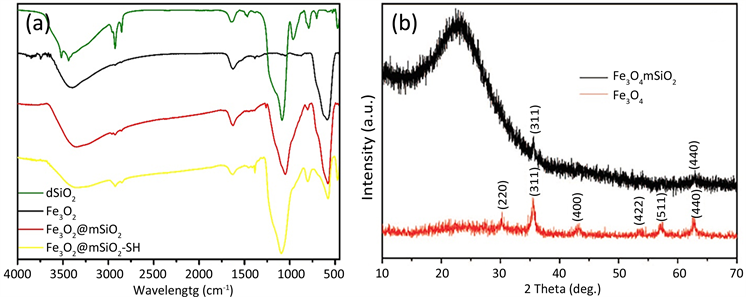
Figure 4. (a) FT-IR of particles, (b) XRD of Fe3O4 and Fe3O4@mSiO2
图4. Fe3O4@mSiO2的傅立叶红外光谱图与XRD图
从3390 cm−1处转移至3356 cm−1处,表明磁性介孔二氧化硅纳米粒子表面被成功修饰上硅烷偶联剂。通过图4(a) FT-IR和4b的XRD分析,我们可以通过各物质的特征吸收峰大致的判断出所制备的粒子是由Fe3O4、SiO2复合而成,且粒子表面被巯基化,载药时部分药物分子与粒子以双硫键的形式复合在一起,达到了我们设计的初衷。这一结果与文献报道一致 [9] [10]。
由于该核-壳结构的纳米粒子是以Fe3O4为核复合而成,故预期纳米载体能够在外加磁场存在下显示磁靶向性。我们通过永磁体吸引和电磁铁振动样品磁强计(VSM)对载体的磁性涌动行为,磁滞回线和饱和磁强度进行表征和测定。在图5磁滞曲线图中,红色线为Fe3O4粒子磁滞曲线,磁饱和强度为36.7 emu/g,黑色线为Fe3O4@mSiO2粒子,磁饱和强度为32.5 emu/g,且没有出现磁滞环,这一结果说明了纳米粒子不仅可以在外部磁场下快速响应,且当没有磁场时,不会因为内部相互作用而团聚,从而避免了在注射时造成的血栓等副作用。

Figure 5. The hysteresis curve of Fe3O4 and Fe3O4@mSiO2
图5. Fe3O4和Fe3O4@mSiO2磁滞曲线
3.2. 药物释放
所制备的纳米粒子具有较高的载药量,为研究所制备纳米粒子的药物释放性能,本实验分别在是否含有GSH的PBS缓冲液中进行载药粒子体外药物释放实验。如图6所示,a为载药的Fe3O4@mSiO2粒子在pH 7.4 PBS和10 mM GSH条件下的释放曲线,在前8个小时中,药物释放速度最快,药物释放率达到77%,12 h后释放趋于平衡,24 h后通过计算得知最终释放82.7%的药物。b则为载药粒子在pH 7.4 PBS条件下的释放,相较于a,b在前8个小时中释放速度最快,可能是由于介孔中的药物分子本身扩散,12 h之后释放趋于平缓,最终释放药物70.2%。相较于a,b的药物释放量只有70.2%,可见部分药物分子通过双硫键与载药粒子结合,在没有GSH环境下双硫键很难断裂,从而释放量相较于a有所减少。为进一步验证此猜想,我们设计了一下实验,如曲线c所示,载药粒子在pH 7.4 PBS条件下药物释放,12 h后药物释放趋于平衡,此过程的药物释放主要为通过物理作用负载在介孔之中的药物分子。随后,将释放环境更换为含有10 mM GSH的PBS溶液,结果如曲线d所示,继续出现药物释放,此时的药物释放主要为GSH环境下通过双硫键与药物载体复合的药物分子因双硫键断裂而被释放出来,继续释放6 h后趋于平衡,最终释放84.5%的药物,其中化学在GSH条件下释放约占比21.2%。此实验充分证明了Fe3O4@mSiO2载体具有显著的还原刺激响应性。此外,在释放曲线中并未出现明显的突释暴释现象,长达24 h的持续释放也是“键合载药”所带来的优势。
3.3. 细胞毒性试验
试验采用不载药粒子作为参照,通过MTT法来考察载体对HeLa细胞的毒性作用,如图7a所示,在一定浓度范围内,不载药的Fe3O4@mSiO2粒子并未对HeLa细胞的增殖产生明显的影响,即使在粒子浓度40μg/mL的条件下,细胞存活率仍在65%以上,证明了所制备的粒子本身具有非常好的生物相容性和低毒性。图7b则为载药粒子孵育HeLa细胞48小时的细胞存活率,从图中可以明显看出DOX和Fe3O4@mSiO2的半致死率分别为0.87 μg/mL和0.72 μg/mL(DOX浓度)。说明在通过纯药衡量后同样的细胞水平上,纳米载体的引入使得药效大大增强。这是由于药物富集在载体之上,当通过内吞作用进入细胞之后才被释放出来,使得药物主要富集在靶向部位,从而达到高效治疗的效果。

Figure 6. Drug release curve of Fe3O4@mSiO2
图6. Fe3O4@mSiO2的释药曲线图

Figure 7. Cytotoxicity of pure particles (a) and drug loaded particles (b)
图7. (a)粒子细胞毒性图,(b)载药粒子细胞毒性
3.4. 结论
在本研究中,以共沉淀法制备Fe3O4纳米粒子,以Fe3O4纳米粒子为核,再通过Stöber法在其表面包裹上介孔结构的壳,所制备得到的具有核-壳结构的Fe3O4@mSiO2纳米粒子。再用γ-球丙基三乙氧基硅烷对粒子表面巯基化修饰,药物分子以物理包埋和化学键合两种方式负载在做制备的纳米粒子上。通过TEOS在碱性条件下水解得到二氧化硅分子,二氧化硅分子之间相互脱水,与磁性纳米粒子之间的静电作用自组装制备,反应条件温和,制备工艺简单,所制得的纳米粒子生物相容性好。实验制备的Fe3O4@mSiO2纳米药物载体为超顺磁性,毒性较低,包封率为91.4%,且具有还原响应性,能作为磁靶向药物载体高效杀死癌细胞。在细胞实验中,达到显著的抗癌效果,同时通过外加磁场吸附发现其显著的磁性增效作用。
4. 展望
通过Stöber法成功制备出尺寸80 nm的磁性介孔二氧化硅纳米药物载体,并在其表面巯基化修饰后,药物分子以双硫键的形式负载在粒子表面,药物分子以物理包埋和化学键合两种方式负载在纳米载体之上,充分发挥了载体的结构优势。且二氧化硅粒子表面含有大量的羟基,这为其表面修饰提供了良好的化学环境基础,使其具有丰富的可修饰性,从而具有广泛的应用前景,因而在生物材料如药物载体方面具有非常重要的地位。本实验尽管目前仍处于实验室的研究阶段,但是我们相信,伴随研究的不断深入,在不久的将来,纳米药物载体将会表现出更卓越的性能,具备更广阔的应用前景。
致谢
感谢武汉工程大学、绿色化工教育部重点实验室提供的实验场地以及科研资源,感谢课题组各老师的悉心教导以及对于本文的批评指正。